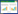文章信息
- 王美莲, 张耀文, 刘北星
- WANG Meilian, ZHANG Yaowen, LIU Beixing
- 日本血吸虫与伯氏疟原虫并发感染时树突状细胞免疫应答的变化
- Changes in the dendritic cell immune response during concurrent infection with Schistosoma japonicum and Plasmodium berghei
- 中国医科大学学报, 2020, 49(7): 642-645, 650
- Journal of China Medical University, 2020, 49(7): 642-645, 650
-
文章历史
- 收稿日期:2019-10-16
- 网络出版时间:2020-06-24 9:24
疟疾主要在撒哈拉以南的非洲地区流行,儿童较成人更易感染。疟原虫感染机体可造成全身多个系统及器官发生损伤[1]。实验室研究中主要利用伯氏疟原虫(Plasmodium berghei,P.b)感染实验动物进行相关免疫机制的研究,感染初期即发生强烈的Th1反应,其中树突状细胞在诱导适应性免疫过程中起到重要作用。已有研究[1]报道树突状细胞参与了疟疾感染期间T细胞介导的免疫过程的建立与调节。血吸虫感染是热带与亚热带另一种常见寄生虫病,人们对其免疫过程的研究[2]证实血吸虫卵可影响树突状细胞产生细胞因子的过程。此外,体外卵源性抗原刺激的树突状细胞可增强体内的Th2反应。因此,树突状细胞免疫应答在血吸虫感染中起重要作用[2]。
从流行病学角度来说,疟疾与血吸虫病可在相同区域内流行,因此也可能在同一人群中并发。在这样情况下,感染血吸虫病可能会对感染疟疾机体产生的免疫应答造成一定的影响。本研究探讨P.b与日本血吸虫(Schistosoma japonicum,S.j)并发感染时树突状细胞免疫应答的改变;在改变两种感染的寄生虫数量或浓度时,树突状细胞免疫应答有无进一步改变。
1 材料与方法 1.1 实验动物感染与分组选取5~6周C57BL/6雌性小鼠,分为低浓度组(小鼠感染150条S.j尾蚴8周后接续感染5×104 P.b)、高浓度组(小鼠感染300条S.j尾蚴8周后感染5×104 P.b)、对照组(单独感染P.b小鼠)。分别在小鼠感染P.b后0、2、5、8 d后处死小鼠。本研究已获得中国医科大学医学研究动物伦理委员会批准。
1.2 脾细胞分离与培养处死小鼠后在无菌状态下分离脾脏,取出后常规用0.17 mol/L NH4Cl对其内红细胞进行裂解。随即加入浓度为10%的FCS及PRMI1640对脾细胞的浓度进行调整。将脾细胞悬液置于培养板中,37 ℃环境下加入5%的CO2培养48 h后收集上清液,-80 ℃环境下冷冻用于后续实验。
1.3 细胞表面染色剂胞内染色(1)取单份样品,分别加入CD11b-FITC单克隆抗体、CD11c-PE单克隆抗体及CD45R/B220-PerCP单克隆抗体,进行3种颜色分析。于染色管中加入脾细胞液后,加入FcγⅡ封闭抗体,再加入CD11b-FITC单克隆抗体、CD11c-PE单克隆抗体及CD45R/B220- PerCP单克隆抗体行细胞表面染色。(2)取单份样品,分别加入CD11c-PE单克隆抗体、MHCⅡ -FITC单克隆抗体及CD86-PerCP单克隆抗体,进行3种颜色分析。于染色管中加入脾细胞液后,加入FcγⅡ封闭抗体,再加入CD11c-PE单克隆抗体、MHCⅡ -FITC单克隆抗体及CD86-PerCP单克隆抗体。离心后去掉上清液,重新悬浮细胞后加入流式细胞仪进行检测。(3)取单份样品,分别加入CD11c-PE单克隆抗体及TLR-4-FITC单克隆抗体后进行2种颜色分析。染色管中加入脾细胞液后,加入FcγⅡ封闭抗体,再加入CD11c-PE单克隆抗体及TLR-4-FITC单克隆抗体。(4)取单份样品,加入CD11c-PE单克隆抗体并进行2种颜色分析。染色管中加入脾细胞液后,加入FcγⅡ封闭抗体,进行固定并行透膜,加入生物素-TLR9单克隆抗体。
流式细胞仪进行数据检测分析,激发波长设置为488 nm及635 nm,使用FACS Cell quest软件对样品中的细胞进行分析。确定目标细胞群后,以阴性对照管内的细胞为对照进行分析。
1.4 统计学分析采用SPSS 22.0软件行统计学分析,计量资料采用x±s表示,多组间比较采用方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 树突状细胞亚群的变化本研究检测的细胞群中,CD11c+CD11b+以及CD11c+CD45R/B220+为2种树突状细胞。对并发S.j与P.b感染后不同时间检测树突状细胞亚群数量的结果显示,所有小鼠脾细胞树突状细胞亚群中的细胞于感染P.b后第5天达峰值,继而下降。在感染P.b后第5天及第8天,低浓度及高浓度组小鼠树突状细胞亚群的数量较对照组显著降低(P < 0.05)。与低浓度组比较,高浓度组在感染P.b后第5天及第8天可进一步减少树突状细胞亚群的细胞数(P < 0.05),见图 1。
|
| A, CD11c+CD11b+DCs; and B, CD11c+CD45R/B220+ DC. * P < 0.05; #P < 0.01. DC, dendritic cell. 图 1 3组小鼠感染后不同时间脾细胞中树突状细胞数比较 Fig.1 Comparison of the number of mice splenic dendritic cells among the three groups at different time points of post-infection |
2.2 树突状细胞成熟度的变化
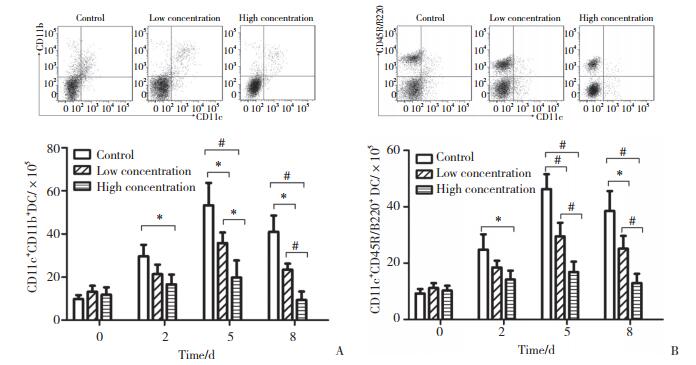
CD86及MHCⅡ 2种树突状细胞分子是评价树突状细胞成熟度的指标。结果显示,所有小鼠脾细胞中树突状细胞分子在感染P.b后逐渐增高,第5天达峰值后逐渐降低。在感染P.b后第5天及第8天,与对照组比较,低浓度及高浓度组小鼠树突状细胞分子数量显著降低(P < 0.05)。与低浓度组比较,高浓度组在感染P.b后第5天及第8天树突状细胞分子数量进一步减少(P < 0.05),见图 2。
|
| A, CD11c+CD86+DC; B, CD11c+MHCⅡ +DC. * P < 0.05; # P < 0.01. DC, dendritic cell. 图 2 3组小鼠感染后不同时间脾细胞中树突状细胞相关分子比较 Fig.2 Comparison of the number of mice splenic dendritic molecules among the three groups at different time points of post-infection |
2.3 Toll样受体数量的改变
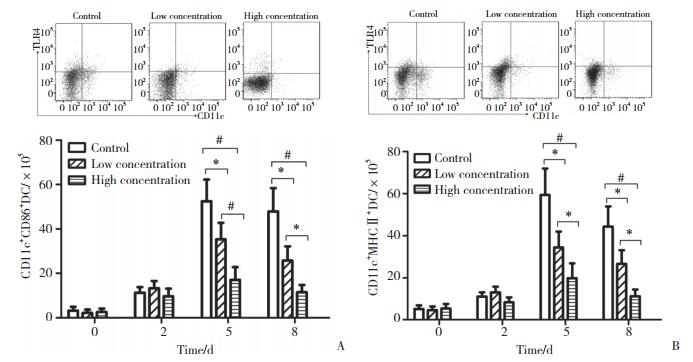
Toll样受体分布于不同免疫细胞表面,有时在其内部。本研究中利用CD11c+来定义树突状细胞,TLR4+及TLR9+来定义不同的Toll样受体。本研究利用流式细胞仪检测的CD11c+TLR4+和CD11c+TLR9+为树突状细胞中2种不同Toll样受体的数量。结果显示,所有小鼠脾细胞中2种Toll样受体数量在感染P.b后均开始增高,第5天达峰值后降低。在感染P.b后第5天及第8天,与对照组比较,低浓度及高浓度组Toll样受体数量显著减低(P < 0.05)。与低浓度组比较,高浓度组在感染P.b后第5天及第8天2种Toll样受体数量进一步减低(P < 0.05),见图 3。
|
| A, CD11c+TLR4+ DC; B, CD11c+TLR9+DC. * P < 0.05; #P < 0.01. DC, dendritic cell. 图 3 3组小鼠感染后不同时间树突状细胞中Toll样受体数量比较 Fig.3 Comparison of the number of Toll-like receptors among the three groups at different time points of post-infection |
3 讨论
疟原虫感染与血吸虫感染均为热带及亚热带地区常见的寄生虫病,且在当地二者并发感染亦十分常见[2-3]。人群可感染不同种属的疟原虫(恶性疟原虫及P.b等)与血吸虫(埃及血吸虫及曼氏血吸虫等),其发病过程、免疫机制及最终的结局也有所不同[4]。S.j主要存在于我国江浙一带地区,而P.b则在东南亚地区较为流行,关于S.j与疟原虫并发感染的实验室研究罕有报道。此外,大多数关于原虫与蠕虫并发感染的研究主要集中在Treg介导的Th1/Th2调节性免疫应答,主要涉及适应性免疫过程,鲜有关于并发感染时固有免疫机制变化的报道。
树突状细胞是固有免疫机制中涉及的主要细胞之一,在原虫感染过程中,首先由其发现并吞噬疟原虫寄生的红细胞,且在机体感染致病体后树突状细胞会增强其吞噬功能,通过抗原提呈作用将其识别的抗原提交给CD4+ T细胞,从而引发T细胞介导的适应性免疫过程[5-7]。在此过程中,树突状细胞的活化可进而调节CD4+ T细胞的表达形式及活性[8]。小鼠脾脏树突状细胞群中主要存在髓样树突状细胞与浆样树突状细胞2种细胞,在进行细胞标记时分别为CD11c+CD11b+以及CD11c+CD45R/B220+。本研究结果表明S.j与P.b并发感染时,2种树突状细胞的细胞数均较P.b单独感染时显著下降,这也可能对Th1免疫应答有潜在的抑制作用。增加感染S.j数量时树突状细胞的数量进一步降低,这也进一步提示了S.j感染对固有免疫应答的抑制作用。
机体对疟原虫感染的免疫应答中Toll样受体发挥了不可替代的作用[9]。TLR4会针对于原虫感染时机体内存在的糖基磷脂酰肌醇发生免疫应答,而TLR9则会与原虫感染时产生的疟色素发生反应产生相应的免疫应答。随后,机体发生进一步反应分泌相关细胞因子与化学因子,从而产生更多的共刺激分子。事实上,实验性脑型疟疾产生大脑的病理损伤可能与脑细胞中过多存在的树突状细胞以及CD8+ T细胞有关,而在敲除TLR9等Toll样受体的小鼠中发生原虫感染时不会发生实验性脑型疟疾,这也说明实验性脑型疟原虫感染产生的固有免疫过程中TLR9主要发挥免疫损伤作用[9]。本研究结果显示S.j与P.b并发感染较P.b单独感染时其脾细胞内的Toll样受体的数量显著降低。增加感染S.j数量时Toll样受体数量进一步降低,这也进一步提示了S.j感染对固有免疫应答的抑制作用。
已有研究[10]表明树突状细胞成熟的主要特征是MHCⅡ及CD86等分子表达的增加,此时树突状细胞的抗原提呈作用加强,从而进一步上调机体适应性免疫向Th1方向偏移。换言之,树突状细胞成熟度增高或减低会改变原虫感染中Th1/Th2的平衡点。本研究结果表明S.j预感染会降低与P.b并发感染时树突状细胞的成熟度,而增加感染S.j尾蚴的数量时将进一步抑制树突状细胞的成熟。这将最终影响原虫感染中Th1免疫应答。
综上所述,S.j与P.b并发感染时对小鼠的固有免疫产生一定的影响,与P.b单独感染比较,并发感染时小鼠脾细胞的树突状细胞数量、分化形式及成熟度表型会有显著差异。这也说明了S.j感染可抑制P.b感染所产生的固有免疫应答,在改变感染的S.j尾蚴数量时,将对并发感染过程中的固有免疫应答产生进一步影响。在后续研究中,应进一步明确并发S.j感染对P.b感染Th1/Th2免疫应答的影响以及其产生的前炎性细胞因子与抗炎性细胞因子的影响。
| [1] |
秦晓松, 王庆辉, 刘军, 等. 异株约氏疟原虫再感染BALB/c小鼠树突状细胞的变化[J]. 中国病原生物学杂志, 2012, 7(11): 851-854. DOI:10.13350/j.cjpb.2012.11.015 |
| [2] |
孙钰浚, 李钊琪, 吕芳丽. 日本血吸虫虫卵肉芽肿免疫病理机制研究进展[J]. 中国寄生虫学与寄生虫病杂志, 2019, 37(6): 713-717, 722. |
| [3] |
CERVI L, MACDONALD AS, KANE C, et al. Cutting edge:dendritic cells copulsed with microbial and helminth antigens undergo modified maturation, segregate the antigens to distinct intracellular compartments, and concurrently induce microbe-specific Th1 and helminth-specific Th2 responses[J]. J Immunol, 2004, 172(4): 2016-2020. DOI:10.4049/jimmunol.172.4.2016 |
| [4] |
李英桐, 王佳琦, 王祝宁, 等. 疟原虫和血吸虫混合感染免疫机制研究进展[J]. 中国医科大学学报, 2018, 47(11): 1032-1035. DOI:10.12007/j.issn.0258-4646.2018.11.017 |
| [5] |
TOKPLONOU L, NOUATIN O, SONON P, et al. Schistosoma haematobium infection modulates Plasmodium falciparum parasite density and antimalarial antibody responses[J]. Parasite Immunol, 2020, 42(4): e12702. DOI:10.1111/pim.12702 |
| [6] |
MOLINA-FRANKY J, CUY-CHAPARRO L, CAMARGO A, et al. Plasmodium falciparum pre-erythrocytic stage vaccine development[J]. Malar J, 2020, 19(1): 56. DOI:10.1186/s12936-020-3141-z |
| [7] |
KESWANI T, SENGUPTA A, SARKAR S, et al. Dendritic cells subsets mediated immune response during Plasmodium berghei ANKA and Plasmodium yoelii infection[J]. Cytokine, 2015, 73(2): 198-206. DOI:10.1016/j.cyto.2015.02.023 |
| [8] |
ZHENG W, WANG QH, LIU YJ, et al. Distinct host-related dendritic cell responses during the early stage of Plasmodium yoelii infection in susceptible and resistant mice[J]. Parasite Immunol, 2010, 32(5): 324-334. DOI:10.1111/j.1365-3024.2009.01190.x |
| [9] |
孙斐, 许兵红, 杨小林, 等. TOLL样受体在疟疾感染小鼠模型中表达量变化规律的研究[J]. 湖北农业科学, 2013, 52(15): 3589-3592, 3595. DOI:10.14088/j.cnki.issn0439-8114.2013.15.033 |
| [10] |
陈光, 刘蕾. 疟疾发病中树突状细胞/调节性T细胞/Th17细胞的功能变化及其交叉调控机制[J]. 中国寄生虫学与寄生虫病杂志, 2014, 32(4): 304-307. |
 2020, Vol. 49
2020, Vol. 49