文章信息
- 王澈, 杨宏辉, 李庆民, 杜秋波, 朱利杰, 李清曼, 张彩丽
- WANG Che, YANG Honghui, LI Qingmin, DU Qiubo, ZHU Lijie, LI Qingman, ZHANG Caili
- ASB14通过调控泛素化介导的线粒体自噬改善小鼠心力衰竭
- ASB14 ameliorates mouse heart failure by regulating ubiquitination-mediated mitochondrial autophagy
- 中国医科大学学报, 2020, 49(7): 636-641
- Journal of China Medical University, 2020, 49(7): 636-641
-
文章历史
- 收稿日期:2019-04-01
- 网络出版时间:2020-06-24 16:16
随着我国人口老龄化的加快,心力衰竭的患病率逐年升高。心力衰竭诱发的心肌肥厚常伴随着心肌细胞中蛋白质的分解及合成,保持蛋白质分解与合成之间的平衡是维持心脏功能的重要条件[1-3]。研究[4]证实,泛素蛋白酶体系统(ubiquitin proteasome system,UPS)在主动脉瓣狭窄模型中出现心肌泛素化蛋白水平升高,说明心衰过程中存在心肌泛素化过程。
线粒体自噬是一个特异性选择的过程,受多种基因和蛋白调控[5]。研究[6]发现,心力衰竭模型中线粒体自噬不足可能会加重心肌损伤,同时E3泛素连接酶Parkin的低表达可能导致心肌细胞中线粒体功能的失调及心律失常的加重,说明泛素化降解介导的线粒体自噬在心力衰竭中发挥至关重要的作用。
锚蛋白重复序列和抑制细胞因子信号盒(ankyrin repeats and suppressor of cytokine signaling box,ASB)14是ASB家族中的成员之一,本研究旨在构建压力负荷诱导的心力衰竭小鼠模型,利用ASB14基因的腺相关病毒转染小鼠,上调其心脏组织中ASB14表达,探讨ASB14参与心力衰竭发生及发展可能的作用机制。
1 材料与方法 1.1 实验动物与分组SPF级C57BL/6雄性小鼠40只,体质量30~35 g,购自辽宁长生生物有限公司[SCXK(辽):2017-0001];小鼠分笼饲养,自由进食和饮水,室温维持在20~25 ℃,每日光照12 h。在适应性饲养1周后,采用随机数字法将小鼠随机分为假手术(Sham)组、模型(Model)组、模型+ASB14-siRNA载体(siRNA)组及模型+ ASB14腺相关病毒转染(ASB14)组,每组10只。
1.2 主要试剂ASB14腺相关病毒及ASB14-siRNA表达载体购自上海吉玛生物科技有限公司;RNA逆转录试剂盒购自Fermentas公司;TransStart Top Green qPCR SuperMix购自北京全式金公司;ASB14及β-actin引物合成于北京奥科鼎盛生物科技有限公司;p62、ASB14、PINK1、Parkin、Mfn2、TIM23、COXIV及LC-3B抗体购于英国Abcam公司。
1.3 方法 1.3.1模型制备与处置:根据文献[7]报道的方法,将ASB14腺相关病毒及ASB14-siRNA表达载体利用无菌PBS稀释成浓度为1.0× 1012μg/mL后,利用尾静脉注射的方法注射到小鼠体内,每只200 μL,其余组小鼠给予等量的阴性病毒稀释液。在注射3周后,除Sham组小鼠外,其余小鼠均根据文献[8-9]报道的方法构建心力衰竭小鼠模型,具体方法如下:小鼠手术前24 h禁食不禁水,1.5 %戊巴比妥钠腹腔注射麻醉小鼠,皮肤消毒、备皮后,将小鼠仰卧位固定于手术台中,于左侧第2~3肋间剪开皮肤,切口0.5~1 cm,用镊子钝性分离肌肉,暴露胸主动脉,于胸主动脉弓部下方0.5 cm处挑起胸主动脉,将注射器针头平行放置于胸主动脉上,利用手术线结扎,抽出针头,使胸主动脉缩窄,逐层缝合。Sham组打开胸腔后,手术线不结扎,其余步骤均与Model组相同。术后6 h内禁食不禁水。
1.3.2超声检测心功能:于手术后第4周,利用小动物超声心电图机检测各组小鼠心脏功能,将探头在二维模式下置于胸骨前,检测缩短分数(left ventricular shortening fraction,FS)、射血分数(ejection fraction,EF %)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)、左心室收缩末期内径(left ventricular late systolic diameter,LVEDs)和左心室舒张末期后壁厚度(left ventricular posterior wall thickness,LVPWd)。
1.3.3HE染色:术后4周后,脱颈处死小鼠,取出心脏,于4 %多聚甲醛中固定,脱水、透明、石蜡包埋随后切片,厚度5 μm左右,石蜡切片在室温下稍微干燥后,置于60 ℃恒温烤箱中烤干使用。切片用二甲苯脱蜡,梯度乙醇溶液水化,蒸馏水冲洗1 min;Harris苏木精染液(60 ℃)染色5 min,流水洗去苏木素液;l %盐酸乙醇分化1~3 s,流水冲洗;1 %氨水洗5~10 s,流水冲洗;伊红染液染色2 min,镜下观察颜色变化,流水冲洗;梯度乙醇脱水:80 %乙醇1 min,95 %乙醇1 min,无水乙醇1 min;二甲苯透明2 min,切片晾干,中性树胶封片。每组小鼠选取6张切片标本,光镜下观察组织学改变。
1.3.4Masson染色:石蜡切片常规脱蜡脱水后,Masson染色液染色5 min,0.5 %醋酸水溶液冲洗,5 %磷钨酸染液染色10 min,0.5 %醋酸水溶液冲洗,0.5 %苯胺蓝染色5 min,0.5 %醋酸水溶液冲洗,梯度乙醇脱水:80 %乙醇1 min,95 %乙醇1 min,无水乙醇1 min;二甲苯透明2 min,切片晾干,中性树胶封片。每组小鼠选取6张切片标本,光镜下观察心肌纤维化情况。
1.3.5实时PCR:利用TRIzol法提取心脏组织中总RNA,取各组小鼠心脏组织加入1 mL TRIzol进行匀浆,匀浆液置于离心管中;每管加入0.2 mL氯仿,冰浴5 min。4℃,12 000 r/min离心10 min;取上层水相,加入0.5 mL异丙醇,冰浴10 min。4℃,12 000 r/min离心10 min;弃上清,加入1 mL用DEPC处理的水配置的75%乙醇,洗涤沉淀。4℃,7 500 r/min离心5 min;弃上清,自然吹干后用0.01% DEPC溶解沉淀,待用。按照试剂盒说明书合成cDNA。取2 μL cDNA为模板,按照实时PCR说明书进行体外扩增,以β-actin作为内参,DNA引物序列如下:β-actin引物上游5’ -GGGAAATCGTGCGTGACA T-3’,下游5’ -TCAGG AGGAGCAATGATCTTG-3’;ASB14引物上游5’ -TG CAGAAAGGAGCTGACGTT-3’,下游5’ - GCAGGTGG CCTGAACTCTTA-3’。结果使用2 -△△Ct法计算基因相对表达变化。反应体系50 μL,反应条件如下:在95 ℃预变性5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,循环30次,72 ℃ 1 min。
1.3.6Western blotting:将心脏组织剪碎,提取总蛋白,4 ℃,12 000 r/min离心20 min,使用BCA蛋白定量试剂盒对蛋白进行定量,进行SDS-聚丙烯酸胺凝胶电泳,使用PVDF膜转膜2 h,5%脱脂奶粉封闭液封闭1 h,TBST洗膜,分别加入p62、ASB14、PINK1、Parkin、Mfn2、TIM23、COXIV、LC-3B及β-actin一抗(1 : 1 000),TBST洗膜加入相应HRP标记二抗稀释浓度为1 : 1 000,室温孵育1 h。TBST洗膜,ECL发光试剂盒发光,凝胶成像系统成像,Image J软件计算灰度值,采用目的条带与内参蛋白条带光密度比值作为结果进行统计分析。
1.4 统计学分析采用SPSS 20.0软件进行分析处理。数据以x±s表示,多组间比较采用单因素方差分析,两两组间比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠ASB14 mRNA和蛋白的表达变化取各组小鼠的心脏组织进行了实时PCR及Western blotting检测,与Sham组相比,siRNA组ASB14 mRNA和蛋白表达明显降低,差异有统计学意义(P < 0.05);而ASB14组ASB14 mRNA和蛋白表达明显增加,差异有统计学意义(P < 0.05),见图 1。

|
| 1, Sham group; 2, ASB14; 3, siRNA. 图 1 Western blotting检测各组ASB14蛋白表达 Fig.1 ASB14 protein expression in each group was detected by Western blotting |
| Group | n | ASB14 mRNA | ASB14 protein |
| Sham | 10 | 1.19±0.09 | 1.16±0.10 |
| ASB14 | 10 | 4.32±0.261) | 4.14±0.361) |
| siRNA | 10 | 0.30±0.041) | 0.34±0.031) |
| 1)compared with sham group,P < 0.05. | |||
2.2 ASB14对心力衰竭小鼠心脏功能的影响
在模型建立后第4周,对小鼠进行了心脏超声检查。与Sham组相比,Model组FS、EF显著降低,LVEDd、LVEDs和LVPWd明显增加,差异有统计学意义(P < 0.05);与Model组相比,siRNA组FS、EF进一步降低,且LVEDd、LVEDs和LVPWd也明显增加,差异有统计学意义(P < 0.05);而转染ASB14后能显著增加FS、EF,并且降低LVEDd、LVEDs和LVPWd,与Model组相比差异有统计学意义(P < 0.05)。见表 2。
| Group | n | FS(%) | EF(%) | LVEDd(mm) | LVEDs(mm) | LVPWd(mm) |
| Sham | 10 | 28.27±0.89 | 60.48±0.53 | 2.54±0.11 | 1.80±0.11 | 0.96±0.13 |
| Model | 10 | 16.98±0.751) | 29.37±0.621) | 4.49±0.341) | 3.84±0.101) | 2.05±0.131) |
| ASB14 | 10 | 21.38±0.862) | 41.96±0.462) | 3.19±0.202) | 2.37±0.182) | 1.30±0.092) |
| siRNA | 10 | 9.76±0.622) | 23.31±0.672) | 5.33±0.172) | 4.40±0.112) | 2.91±0.142) |
| 1)compared with sham group,P < 0.05;2)compared with model group,P < 0.05. | ||||||
2.3 ASB14对心力衰竭小鼠心脏病理损伤及纤维化的影响
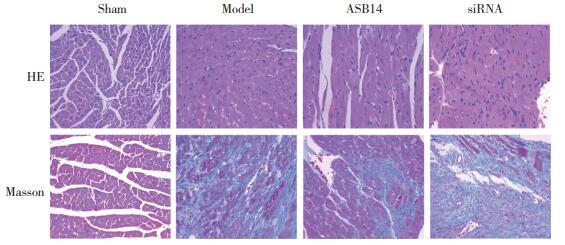
HE染色结果(图 2)显示,Sham组心肌纤维排列整齐,细胞核呈卵圆形,无皱缩、染色正常,未见心肌细胞肥大,无炎症细胞浸润现象;Model组及siRNA组小鼠心肌纤维排列紊乱,细胞核皱缩深染,心肌纤维肥大增厚,炎症细胞浸润,凋亡细胞多见,且siRNA组较Model组心脏病理损伤严重;ASB14组心肌纤维排列较Model组整齐,心肌细胞肥厚减轻,炎症细胞及凋亡细胞减少,心脏病理损伤减轻。Masson染色结果显示,与Sham组相比,Model组小鼠心肌纤维化程度明显加重,胶原纤维表达明显增多;与Model组相比,siRNA组小鼠胶原纤维表达也显著增加;而转染ASB14后,小鼠胶原纤维表达降低,纤维化程度减轻,提示ASB14能够减轻心力衰竭小鼠心脏病理损伤及纤维化程度。
|
| 图 2 ASB14对心力衰竭小鼠心脏病理损伤及纤维化的影响HE×200 Fig.2 Effect of ASB14 on cardiac pathological damage and fibrosis in mice with heart failure HE×200 |
2.4 ASB14对心力衰竭小鼠PINK1、Parkin及Mfn2表达的影响
Western blotting检测各组小鼠心肌组织中泛素化相关蛋白的表达,与Sham组相比,Model组小鼠心肌组织中泛素化相关蛋白PINK1、Parkin表达明显增加,Mfn2表达明显降低,差异有统计学意义(P < 0.05);转染ASB14-siRNA后小鼠心肌组织中泛素化相关蛋白PINK1、Parkin表达显著降低,Mfn2表达明显增加,与Model组相比,差异有统计学意义(P < 0.05);此外,转染ASB14后小鼠心肌组织中泛素化相关蛋白PINK1、Parkin表达进一步增加,Mfn2表达也显著降低,与Model组相比,差异有统计学意义(P < 0.05)。见表 3,图 3。
| Group | n | PINK1 protein | Parkin protein | Mfn2 protein |
| Sham | 10 | 0.25±0.03 | 0.51±0.02 | 1.23±0.08 |
| Model | 10 | 0.91±0.111) | 1.30±0.071) | 0.62±0.091) |
| ASB14 | 10 | 1.47±0.042) | 2.08±0.072) | 0.39±0.012) |
| siRNA | 10 | 0.61±0.112) | 0.98±0.102) | 0.78±0.062) |
| 1)compared with sham group,P < 0.05;2)compared with model group,P < 0.05. | ||||

|
| 1, sham group; 2, model group; 3, ASB14 group; 4, SiRNA group. 图 3 Western blotting检测各组PINK1、Parkin及Mfn2蛋白表达 Fig.3 Effect of ASB14 on the expression of PINK1, Parkin, and Mfn2 in mice with heart failure |
2.5 ASB14对心力衰竭小鼠TIM23、COXIV、LC-3B及p62表达的影响
Western blotting检测各组小鼠心肌组织中线粒体自噬相关蛋白的表达。与Sham组相比,Model组小鼠心肌组织中线粒体自噬相关蛋白TIM23、COXIV及p62蛋白明显降低,而LC3Ⅱ/LC3Ⅰ的比例显著增加,差异有统计学意义(P < 0.05);转染ASB14- siRNA后小鼠心肌组织中线粒体自噬相关蛋白TIM23、COXIV及p62蛋白明显增加,而LC3Ⅱ/LC3Ⅰ的比例显著降低,与Model组相比,差异有统计学意义(P < 0.05);此外,转染ASB14后小鼠心肌组织中线粒体自噬相关蛋白TIM23、COXIV及p62蛋白表达进一步减少,而LC3Ⅱ/LC3Ⅰ的比例显著增加,与Model组相比,差异有统计学意义(P < 0.05)。见表 4,图 4。
3 讨论心力衰竭是多种心血管疾病的终末阶段,其发病可能与心脏超负荷、心肌损伤以及心肌炎症等因素有关[10]。ASB14是ASB家族中的成员之一,ASB14是心力衰竭的潜在标志物,其可能通过蛋白质泛素化参与心力衰竭的进展[11-12]。因此,本研究利用ASB14腺相关病毒或ASB14-siRNA转染小鼠以促进或抑制心肌细胞中ASB14的表达,并通过主动脉缩窄手术建立压力负荷诱导的心力衰竭小鼠模型,探讨ASB14对心力衰竭小鼠的影响极其作用机制。研究结果发现,小鼠转染ASB14腺相关病毒或ASB14-siRNA载体后,心肌内ASB14 mRNA及蛋白的表达明显升高或降低,可用于后续研究。
| Group | n | TIM23 protein | COXIV protein | LC3Ⅱ/LC3Ⅰ protein | p62 protein |
| Sham | 10 | 1.43±0.07 | 2.17±0.18 | 1.02±0.09 | 2.68±0.16 |
| Model | 10 | 0.79±0.021) | 1.24±0.051) | 1.68±0.081) | 1.54±0.041) |
| ASB14 | 10 | 0.56±0.062) | 0.56±0.042) | 2.20±0.082) | 1.27±0.082) |
| siRNA | 10 | 1.02±0.052) | 1.56±0.062) | 1.40±0.052) | 2.18±0.062) |
| 1)compared with sham group,P < 0.05;2)compared with model group,P < 0.05. | |||||

|
| 1, Sham group; 2, model group; 3, ASB14 group; 4, siRNA group. 图 4 Western blotting检测各组TIM23、COXⅣ、p62及LC3B蛋白表达 Fig.4 Effect of ASB14 on the expression of TIM23, COXⅣ, p62, and LC3B in mice with heart failure |
心肌细胞肥厚是心力衰竭患者的早期临床表现,同时心肌细胞肥厚还会引起心肌细胞纤维增生,诱发心肌胶原纤维化。过量沉积的胶原纤维会使在正常情况下彼此聚合的心肌细胞分离开,心肌细胞之间的信息传递受到阻碍,心肌舒张及收缩功能受损,从而导致心肌泵血功能障碍[13-15]。本研究结果显示,ASB14高表达能够明显改善压力负荷诱导的心力衰竭小鼠心室功能不全及心室扩张、减轻心肌病理性损伤并减少胶原沉积,改善心肌纤维化。
心肌细胞肥厚伴随着蛋白质的分解与重新合成,为了维持心肌内蛋白质分解及合成的相对平衡,UPS的泛素化过程会清除掉心肌内变异的蛋白质,维持心肌细胞蛋白质的分解与合成稳态[16-18]。Pink1是一种丝氨酸/苏氨酸激酶,Parkin是一种E3泛素连接酶。当线粒体在受损状态时,线粒体膜电位下降,Pink1在线粒体外膜迅速积累,导致Parkin向受损线粒体集聚,增加E3泛素连接酶的活性,加速受损线粒体基质蛋白的泛素化[19-21]。Mfn2是Parkin的受体,当心肌受损后,Mfn2表达降低,从而组织了Parkin易位至线粒体内膜,导致其在受损的线粒体上集聚[22]。本研究结果发现,ASB14高表达能够促进Pink1及Parkin的表达,降低Mfn2的表达,说明ASB14可以激活E3泛素连接酶的活性,启动泛素化,加快其对变异蛋白质的清除。
有研究[23-25]表明,Parkin活性增加和启动泛素化,会促进线粒体自噬。研究[26]显示在心力衰竭患者的心脏组织线粒体中自噬相关蛋白LC3Ⅱ的表达明显增加、p62的表达明显降低,说明线粒体自噬可能与心力衰竭的发展有关。本研究通过Western blotting检测线粒体内膜相关蛋白及自噬相关蛋白的表达来探讨线粒体自噬的激活情况,结果发现,当压力负荷诱导的心力衰竭小鼠模型高表达ASB14后,p62、TIM23、COXⅣ的表达明显降低,而LC3Ⅱ的表达明显增加,进一步说明了ASB14可能通过增加泛素化水平,激活线粒体自噬水平来改善小鼠心力衰竭。
综上所述,本研究发现ASB14可能是通过激活了泛素化介导的线粒体自噬,从而发挥改善心力衰竭的作用。本研究初步探讨了ASB14对心肌细胞泛素化及线粒体自噬的影响以及其在改善心力衰竭中的作用,为心力衰竭患者的治疗提供了新的靶点。
| [1] |
卢玉俊, 赵信科, 代晶晶. 参桂保心方对慢性心力衰竭大鼠基质金属蛋白酶2、基质金属蛋白酶抑制剂1、B型脑钠肽及心室重构的影响[J]. 中国医科大学学报, 2018, 47(3): 231-236. DOI:10.12007/j.issn.0258-4646.2018.03.009 |
| [2] |
陈作, 梁勇, 李艳灵, 等. 心复康丸对压力超负荷大鼠心肌肥厚的影响[J]. 中西医结合心脑血管病杂志, 2016, 14(4): 358-360. DOI:10.3969/j.issn.1672-1349.2016.04.007 |
| [3] |
DAY S M. The ubiquitin proteasome system in human cardiomyopathies and heart failure[J]. Am J Physiol Heart Circ Physiol, 2013, 304(10): H1283-H1293. DOI:10.1152/ajpheart.00249.2012 |
| [4] |
RANEK MJ, ZHENG HQ, HUANG W, et al. Genetically induced moderate inhibition of 20S proteasomes in cardiomyocytes facilitates heart failure in mice during systolic overload[J]. J Mol Cell Cardiol, 2015, 85: 273-281. DOI:10.1016/j.yjmcc.2015.06.014 |
| [5] |
YAMASHITA SI, KANKI T. How autophagy eats large mitochondria:autophagosome formation coupled with mitochondrial fragmentation[J]. Autophagy, 2017, 13(5): 980-981. DOI:10.1080/15548627.2017.1291113 |
| [6] |
GAO J, QIN SY, JIANG CG. Parkin-induced ubiquitination of Mff promotes its association with p62/SQSTM1 during mitochondrial depolarization[J]. Acta Biochim Biophys Sin(Shanghai), 2015, 47(7): 522-529. DOI:10.1093/abbs/gmv044 |
| [7] |
刘帅烨, 周越, 何昕, 等. 脑钠肽对压力负荷诱导的小鼠心力衰竭的影响及作用机制[J]. 中山大学学报(医学版), 2018, 39(4): 510-520. DOI:10.13471/j.cnki.j.sun.yat-sen.univ(med.sci).20180607.026 |
| [8] |
冯品, 楚轶, 曾迪, 等. PAK1-nNOS-NO信号通路在有氧运动减轻压力负荷小鼠心肌肥厚中的作用及其机制[J]. 临床与病理杂志, 2017, 37(11): 2310-2316. DOI:10.3978/j.issn.2095-6959.2017.11.005 |
| [9] |
DU PZ, CHANG YW, DAI FJ, et al. Role of heat shock transcription factor 1(HSF1)-upregulated macrophage in ameliorating pressure overload-induced heart failure in mice[J]. Gene, 2018, 667: 10-17. DOI:10.1016/j.gene.2018.04.042 |
| [10] |
洪飞, 汪磊. 慢性心力衰竭患者血清CA125、hs-CRP和TNF-α水平及其与心功能的关系[J]. 中国医科大学学报, 2017, 46(9): 787-790. DOI:10.12007/j.issn.0258-4646.2017.09.005 |
| [11] |
WANG C, YANG HH, GAO C. Potential biomarkers for heart failure[J]. J Cell Physiol, 2019, 234(6): 9467-9474. DOI:10.1002/jcp.27632 |
| [12] |
闫翠, 周政, 梁碧荣, 等. 养心康片调节自噬对慢性心力衰竭小鼠心肌纤维化的影响[J]. 中国实验方剂学杂志, 2019, 25(3): 53-58. DOI:10.13422/j.cnki.syfjx.20190340 |
| [13] |
李铁志, 张晓刚, 潘丽丽, 等. 血浆脑钠肽和内皮素1在心力衰竭患者中的浓度变化及相关性[J]. 中国医科大学学报, 2008, 37(1): 105-106. DOI:10.3969/j.issn.0258-4646.2008.01.035 |
| [14] |
MARQUES FZ, PRESTES PR, BYARS SG, et al. Experimental and human evidence for lipocalin-2(neutrophil gelatinase-associated lipocalin[J]. J Am Heart Assoc, 2017, 6(6): e005971. DOI:10.1161/JAHA.117.005971 |
| [15] |
MA D, LIU L, ZHAO HW, et al. Thoracic epidural anesthesia reversed myocardial fibrosis in patients with heart failure caused by dilated cardiomyopathy[J]. J Cardiothorac Vasc Anesth, 2017, 31(5): 1672-1675. DOI:10.1053/j.jvca.2017.05.014 |
| [16] |
BARAC YD, EMRICH F, KRUTZWAKD-JOSEFSON E, et al. The ubiquitin-proteasome system:a potential therapeutic target for heart failure[J]. J Heart Lung Transplant, 2017, 36(7): 708-714. DOI:10.1016/j.healun.2017.02.012 |
| [17] |
卢颖, 潘磊, 林超, 等. 线粒体自噬在心血管疾病中的作用及研究进展[J]. 中国药学杂志, 2016, 51(23): 1989-1992. DOI:10.11669/cpj.2016.23.001 |
| [18] |
LI X, ELMIRA E, ROHONDIA S, et al. A patent review of the ubiquitin ligase system:2015-2018[J]. Expert Opin Ther Pat, 2018, 28(12): 919-937. DOI:10.1080/13543776.2018.1549229 |
| [19] |
NAKAGAWA T, YOKOE S, ASAHI M. Phospholamban degradation is induced by phosphorylation-mediated ubiquitination and inhibited by interaction with cardiac type Sarco(endo)plasmic Reticulum Ca (2+)-ATPase[J]. Biochem Biophys Res Commun, 2016, 472(3): 523-530. DOI:10.1016/j.bbrc.2016.03.009 |
| [20] |
GEHRKE S, WU ZH, KLINKENBERG M, et al. PINK1 and Parkin control localized translation of respiratory chain component mRNAs on mitochondria outer membrane[J]. Cell Metab, 2015, 21(1): 95-108. DOI:10.1016/j.cmet.2014.12.007 |
| [21] |
RAKOVIC A, GRÜNEWALD A, KOTTWITZ J, et al. Mutations in PINK1 and parkin impair ubiquitination of mitofusins in human fibroblasts[J]. PLoS One, 2011, 6(3): e16746. DOI:10.1371/journal.pone.0016746 |
| [22] |
MCLELLAND GL, GOIRAN T, YI W, et al. Mfn2 ubiquitination by PINK1/parkin gates the p97-dependent release of ER from mitochondria to drive mitophagy[J]. Elife, 2018, 7: e32866. DOI:10.7554/eLife.32866 |
| [23] |
YEO D, KANG C, GOMEZ-CABRERA MC, et al. Intensified mitophagy in skeletal muscle with aging is downregulated by PGC-1alpha overexpression in vivo[J]. Free Radic Biol Med, 2019, 130: 361-368. DOI:10.1016/j.freeradbiomed.2018.10.456 |
| [24] |
SUN HP, ZOU SF, CANDIOTTI KA, et al. Octreotide attenuates acute kidney injury after hepatic ischemia and reperfusion by enhancing autophagy[J]. Sci Rep, 2017, 7: 42701. DOI:10.1038/srep42701 |
| [25] |
MOLINA-JIJÓN E, APARICIO-TREJO OE, RODRÍGUEZ-MUÑOZ R, et al. The nephroprotection exerted by curcumin in maleateinduced renal damage is associated with decreased mitochondrial fission and autophagy[J]. Biofactors, 2016, 42(6): 686-702. DOI:10.1002/biof.1313 |
| [26] |
LI RL, WANG XX, WU SS, et al. Irisin ameliorates angiotensin Ⅱ-induced cardiomyocyte apoptosis through autophagy[J]. J Cell Physiol, 2019, 234(10): 17578-17588. DOI:10.1002/jcp.28382 |
 2020, Vol. 49
2020, Vol. 49