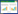文章信息
- 刘源, 杜冰, 张雪, 金美玉, 郑志红
- LIU Yuan, DU Bing, ZHANG Xue, JIN Meiyu, ZHENG Zhihong
- FOXO3和转录因子SOHLH1对卵母细胞特异性表达基因Bmp15转录活性的调控
- FOXO3 and SOHLH1 regulated transcriptional activity of the oocyte-specific gene, Bmp15
- 中国医科大学学报, 2020, 49(7): 628-635
- Journal of China Medical University, 2020, 49(7): 628-635
-
文章历史
- 收稿日期:2019-03-27
- 网络出版时间:2020-06-24 9:35
卵泡连续多阶段的发育过程受多因素调节。在原始卵泡形成到原始卵泡活化阶段,卵泡发育不依赖促性腺激素,而依赖于卵母细胞和颗粒细胞之间的信息传递[1-3],多种转录因子和旁分泌因子在这一阶段发挥重要作用。骨形态发生蛋白15(bone morphogenetic protein 15,BMP15)属于转化生长因子β(transforming growth factor-β,TGF-β)家族成员,是卵泡内重要的旁分泌因子,在卵泡发育不依赖促性腺激素阶段,对卵泡增殖分化、类固醇激素合成和卵丘扩张等发挥重要作用,敲除Bmp15后小鼠排卵率降低[4-5]。但卵泡内调控Bmp15的因素目前尚未明确。研究[6]表明,叉头转录因子O3(forkhead box O3,Foxo3)转基因小鼠与野生型小鼠相比,BMP15蛋白表达水平明显下降。此外,本课题组通过对雌性精子发生和卵子发生的特定基本螺旋-环-螺旋1(spermatogenesis and oogenesis specific basic helixloop-helix 1,Sohlh1)(-/-)型小鼠卵巢的基因表达谱芯片分析,发现Bmp15基因表达水平也显著下调,因此推测FOXO3、SOHLH1可能调控Bmp15。本研究拟探讨FOXO3和转录因子SOHLH1是否通过调控旁分泌因子BMP15影响卵母细胞与颗粒细胞交流,旨在完善转录因子SOHLH1影响卵母细胞与颗粒细胞间信号交流的分子机制。
1 材料与方法 1.1 材料实验用SPF级C57BL/6J雌鼠均由中国医科大学实验动物部提供,饲养于屏障系统内,环境温度保持在20~26 ℃之间,相对湿度40%~70%,光控交替时间12/12 h。本研究经过中国医科大学实验动物福利与伦理委员会及实验动物管理和使用委员会审查通过。
主要试剂:2×Phanta Max Master酶(中国诺唯赞Vazyme公司),AxyPrep DNA Gel Extraction Kit(美国爱思进AXYGEN公司),T4连接酶、BamHⅠ、KpnⅠ -HF、HindⅢ -HF限制性内切酶(美国NEW ENGLAND Biolabs公司),DH-5α感受态细胞(日本TaKaRa公司),lipofectamine 3000 Reagent转染试剂盒、荧光二抗(美国Invitrogen公司),双荧光素酶报告基因检测试剂盒(北京普洛麦格Promega公司),EZChIP Chromatin Immunoprecipitation Kit(德国默克MERCK公司),FOXO3、SOHLH1抗体(英国Abcam公司),小鼠IgG抗体(美国赛默飞公司)。
1.2 Bmp15-pGL3.0重组质粒构建 1.2.1获取Bmp15基因启动子区目的片段:应用Primer 5软件对Bmp15启动子-2 000 bp~+200 bp区域序列进行引物设计,上、下游引物分别添加KpnⅠ - HF(GGGTACCC)和HindⅢ -HF(GGATCC)的酶切位点。引物序列如下,Bmp15-F,5’ -CGGGGTACCTAAA CGAGCATGGTAAGGGCG-3’,位于-1 279 bp~ -1 264 bp;Bmp15-R,5’ -CCCAAGCTTACAGGCTAA AGTAACCGAGGAG-3’,位于-447 bp~-431 bp。提取C57BL/6J小鼠卵巢组织基因组DNA作为模板,扩增Bmp15启动子区。PCR反应体系50.0 µL,包括DNA 2.0 µL,Bmp15-F(10 µmol/L)2.0 µL,Bmp15-R(10 µmol/L)2.0 µL,2×Phanta Max Master 25.0 µL,DDW19.0 µL。PCR反应条件:95 ℃3 min;95 ℃15 s,58 ℃15 s,72℃2 min,30个循环;72 ℃退火5 min。
1.2.2重组质粒连接及鉴定:将1.2.1得到的PCR产物进行凝胶回收纯化,随后使用KpnⅠ -HF、HindⅢ - HF限制性内切酶将PCR产物及pGL3.0-Basic载体酶切。将酶切后的Bmp15启动子区目的片段和pGL3.0- Basic载体连接,转化至DH5-α感受态细胞,平皿培养并测序鉴定。
1.3 Foxo3-pcDNA3.0质粒构建应用Primer 5软件对Foxo3 CDS区进行引物设计,上、下游引物分别添加HindⅢ(GGATCC)和BamHⅠ(AAGCTT)的酶切位点。引物序列:Foxo3-F,5’ - CCCAAGCTTAAGATGGCAGAGGCAC CAGC-3’;Foxo3-R,5’ -CGGGATCCAGGGTCTGCTT TGCCCATTTC- 3’。由于本实验构建质粒需插入的Foxo3 CDS区片段较长,为保障提取RNA的完整性,采用中国博科BioBase公司UPure Tissue RNA Kit进行RNA提取,后续步骤同1.2。
1.4 Foxo3-pcDNA3.0和Sohlh1-pcDNA3.0质粒表达分析采用免疫荧光实验分析Foxo3-pcDNA3.0和Sohlh1-pcDNA3.0(中国医科大学实验动物部前期构建)在HEK293T细胞中的表达水平。将盖玻片放入6孔板中,每孔加入3 mL完全培养基。接种HEK293T细胞(2.5×105/孔)。12 h后,按照lipofectamine 3000 Reagent转染试剂盒操作说明分别转染100 µg纯化后的Foxo3-pcDNA3.0和Sohlh1-pcDNA3.0质粒,培养24 h、48h后,取出6孔板内盖玻片。冷丙酮固定生长在盖玻片上的HEK293T细胞8 min,5%BSA室温封闭2 h,加入用5%BSA稀释400倍的FOXO3、SOHLH1一抗,4 ℃过夜。TBST清洗,加入荧光二抗,室温1 h,TBST清洗,DAPI染色,封片。荧光显微镜下观察FOXO3、SOHLH1蛋白在HEK293T细胞中的表达情况。
1.5 双荧光素酶报告基因实验检测FOXO3、SOHLH1对Bmp15启动子活性的影响37 ℃、5% CO2条件下,在24孔培养皿中培养HEK293T细胞。当细胞生长至约50%~70%时准备转染。将细胞设为6组,每组4个复孔,每孔接种1.5×105个HEK293T细胞。第一组转染pGL3.0-Basic载体100 ng,第二组转染Bmp15-pGL3.0质粒100 ng,第三组转染Bmp15-pGL3.0和Sohlh1-pcDNA3.0各100 ng,第四组转染Bmp15-pGL3.0、Sohlh1-pcDNA3.0和Foxo3-pcDNA3.0质粒各100 ng,第五组转染Bmp15- pGL3.0和Sohlh1-pcDNA3.0质粒各100 ng,Foxo3- pcDNA3.0质粒200 ng,第六组转染Bmp15-pGL3.0和Sohlh1-pcDNA3.0质粒各100 ng,Foxo3-pcDNA3.0质粒300 ng。各组均加入TK质粒80 ng。转染后48 h,弃除培养液,1×PBS清洗细胞。按照Promega双荧光素酶报告基因检测试剂盒说明书,分别检测萤火虫荧光值和海肾荧光值。启动子活性用相对活性值(萤火虫荧光值与海肾荧光值的比值)表示。
1.6 染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)实验在GenBank数据库中查找小鼠Bmp15基因组DNA序列,确定转录起始点上游2 000 bp序列,在Bmp15基因启动子中查找SOHLH1的结合位点(CANNTG)和FOXO3的结合位点(TGTAAACA),根据结合位点位置设计ChIP-PCR引物(表 1)。
| Primer | Sequence | Product length(bp) | Binding site |
| FOXO3 Bmp15a | F:5’ -GAGAACTGATGGGATTCCTCTGG-3’ | 250 | CACCTG(80 bp,-170 bp) |
| R:5’ -TAAACGAGCATGGTAAGGGCG-3’ | |||
| FOXO3 Bmp15b | F:5’ -CCTCATTACCATGTCTTGTTTCC-3’ | 230 | CAACTG(-220 bp,-450 bp) |
| R:5’ -AATCCCATCAGTTCTCAGCAC-3’ | |||
| FOXO3 Bmp15c | F: 5’ -TTCCAGCAGCAGTTGGTTCTC-3’ | 185 | CACATG(-560 bp,-745 bp) |
| R: 5’ -TTCCAGCAGCAGTTGGTTCTC-3’ | |||
| FOXO3 Bmp15d | F: 5’ -AAGAAGAGTCCCTGCCAGTAG-3’ | 210 | CAACTG(-1 200 bp,-1 410 bp) |
| R: 5’ -GGGGAGACCTACTCAGCCTTTC-3’ | |||
| SOHLH1 Bmp15a | F: 5’ -GGCAACATTATCATGCAAGAAGC-3’ | 200 | TGTAAACA(-665 bp,-674 bp) |
| R: 5’ -TGCTGGAACCTGCACTCTATGAA-3’ | |||
| SOHLH1 Bmp15b | F: 5’ -TCTCGGTAGATCAGACTACAACT-3’ | 200 | TGTAAACA(-470 bp,-546 bp) |
| R: 5’ -GGGTTTACATATGAGCAAAGTATA-3’ | |||
| SOHLH1 Bmp15c | F: 5’ -ATGGGTTTCATTGTGCTATCTCC-3’ | 185 | TGTAAACA(-395 bp,-442 bp) |
| R: 5’ -AAACAAGACATGGTAATGAGGGA-3’ | |||
| SOHLH1 Bmp15d | F: 5’ -CAGGGACTCACAGAAGCCAGAAG-3’ | 210 | TGTAAACA(-75 bp,-84 bp) |
| R: 5’ -ACGTAAAGAAGATCAATGGTGGG-3’ | |||
| SOHLH1 Bmp15e | F: 5’ -ACTGTTGATGGACATTTGTGACT-3’ | 200 | TGTAAACA(120 bp,183 bp) |
| R: 5’ -TGCTTCACAAGGAAAACTATGAT-3’ |
超声粉碎C57BL/6小鼠卵巢,使细胞中的DNA破碎成200~2 000 bp小片段。按照EZ-ChIP试剂盒说明进行实验,将SOHLH1、FOXO3特异性抗体免疫沉淀产物作为ChIP实验组,将小鼠IgG抗体免疫沉淀产物作为ChIP实验阴性对照,PCR后通过琼脂糖凝胶电泳检测所得DNA产物中是否含有FOXO3和转录因子SOHLH1的结合位点。
1.7 统计学分析细胞转染和双荧光素酶活性检测各重复3次,应用GraphPad Prism 5软件对所得数据进行分析,采用t检验,P < 0.000 5为差异有极其显著的统计学意义。
2 结果 2.1 Foxo3-pcDNA3.0表达质粒、Bmp15-pGLBasic重组质粒的构建将构建好的重组质粒酶切鉴定后送测序,酶切电泳结果(图 1)与BLAST结果提示2种质粒构建成功。
|
| A, results of electrophoresis after digestion of Bmp15-pGL3.0 plasmid; B, results of electrophoresis after digestion of Foxo3-pcDNA3.0 plasmid. 图 1 质粒构建结果 Fig.1 Plasmid construction results |
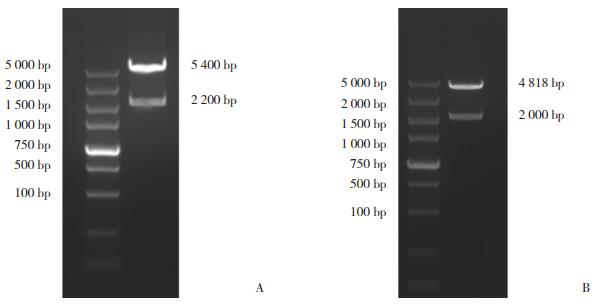
2.2 Sohlh1-pcDNA3.0质粒在HEK293T细胞中的表达情况
将Sohlh1-pcDNA3.0质粒和Foxo3-pcDNA3.0过表达质粒转染入HEK293T细胞中,24、48 h后分别观察SOHLH1、FOXO3蛋白表达情况。结果发现,SOHLH1和FOXO3均可在HEK293T细胞中表达,且在细胞核、质中均有分布(图 2)。HEK193T细胞中含有内源性FOXO3蛋白,但含量极低,与过表达质粒相比,免疫荧光观察不到(图 2)。
|
| 图 2 细胞免疫荧光结果 Fig.2 Cell immunofluorescence results |
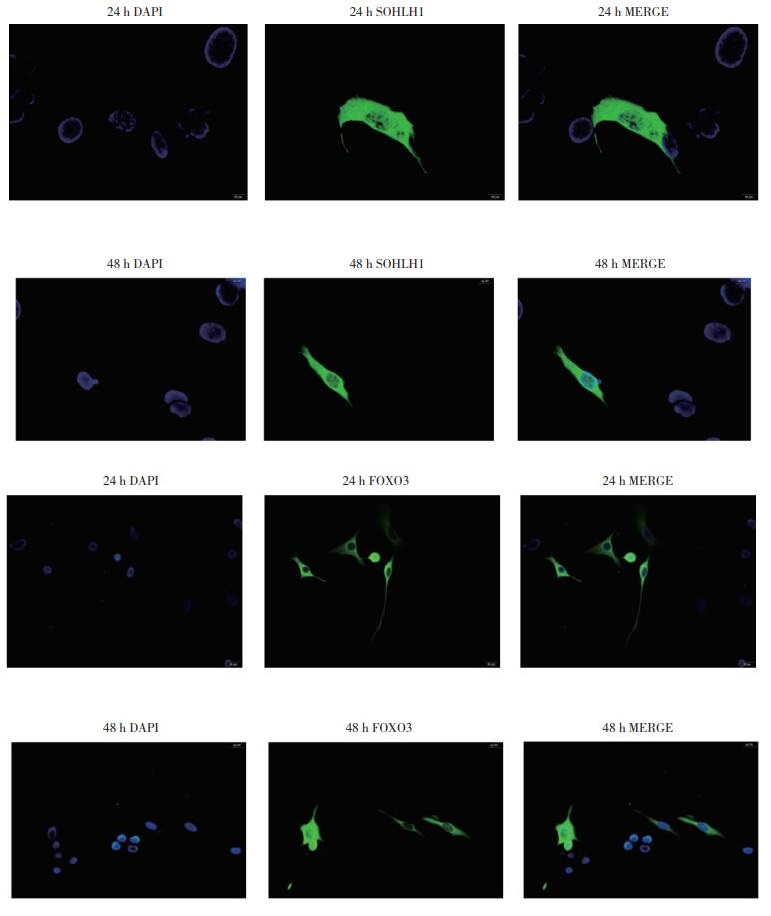
2.3 FOXO3抑制了SOHLH1对Bmp15的转录激活作用
双荧光素酶报告基因实验结果(图 3)显示,SOHLH1可以上调Bmp15基因启动子区的转录活性,FOXO3抑制了转录因子SOHLH1对Bmp15启动子区的转录激活作用,且FOXO3表达水平越高,抑制作用越强。HEK293T细胞系含有内源性FOXO3,但通过免疫荧光实验结果发现,内源性FOXO3表达微弱。
|
| * P < 0.000 1. TK, pRL-TK plasmid. 图 3 双荧光素酶报告基因实验结果 Fig.3 Results of double luciferase reporter experiments |
2.4 ChIP实验证实FOXO3、SOHLH1与小鼠卵巢中Bmp15基因启动子区结合
ChIP结果显示,SOHLH1蛋白能与Bmp15启动子(-170 bp,80 bp),(-450 bp,-220 bp),(-745 bp,-560 bp),(-1 410 bp,-1 200 bp)区间结合。FOXO3能与Bmp15启动子(120 bp,183 bp),(-84 bp,-75 bp),(-442 bp,-395 bp),(-546 bp,-470 bp),(-674 bp,-665 bp)区间结合(图 4E~4I)。

|
| A to D,SOHLH1 binding to the(80 bp,-170 bp),(-220 bp,-450 bp),(-560 bp,-745 bp),(-1 200 bp,-1 410 bp) regions of the Bmp15 promoter;E to I,FOXO3 binding to the(120 bp,183 bp),(-75 bp,-84 bp),(-395 bp,-442 bp),(-470 bp,-546bp),(-665 bp,-674 bp) regions of the Bmp15 promoter. 图 4 ChIP实验结果 Fig.4 ChIP results |
2.5 FOXO3蛋白和转录因子SOHLH1在Bmp15启动子区结合位点的分析
SOHLH1和FOXO3在Bmp15启动子上有多个结合位点,并且Bmp15启动子上相邻的SOHLH1和FOXO3结合位点距离很近且有部分重合,相距最大距离约100 bp,在Bmp15启动子(-400 bp,-405 bp)和(-544 bp,-546 bp)区域,SOHLH1和FOXO3的结合位点重合(图 5)。
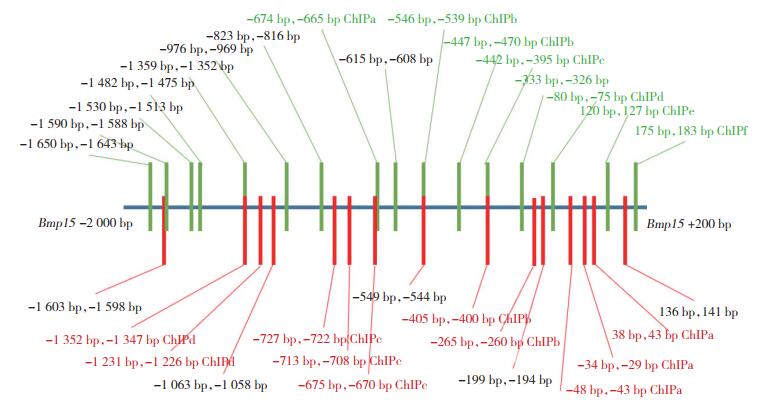
|
| FOXO3 and SOHLH1 binding to the Bmp15 promoter. The horizontal line represents the(-2 000 bp to 200 bp) region of Bmp15 promoter. The red vertical lines show the FOXO3 binding sites in the Bmp15 promoter, and the bases written in red represent the ChIP binding regions. The green vertical lines represent SOHLH1 binding sites in the Bmp15 promoter, and the bases written in green represent the ChIP binding region. The fluorescent vector constructed in the dual-luciferase reporter assay was the(-2 000 bp to 200 bp) region of the Bmp15 promoter. 图 5 FOXO3和转录因子SOHLH1在Bmp15启动子区的结合位点分析 Fig.5 Analysis of the binding sites of FOXO3 and the transcription factor SOHLH1 in the promoter regions of genes Bmp15 |
3 讨论
卵泡发育依赖于卵母细胞和颗粒细胞之间的信息传递[7],卵母细胞内受体酪氨酸激酶(receptor tyrosine kinase,KIT)/磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/丝氨酸/苏氨酸激酶(serine/threonine kinase,Akt)信号通路在原始卵泡活化阶段发挥重要作用,颗粒细胞分泌受体酪氨酸激酶配体(KIT ligand,KITL)与卵母细胞表面KIT结合后激活卵母细胞内下游信号因子PI3K,PI3K活化后使得二磷酸肌酶磷酸化为三磷酸肌酶,进而激活Akt,活化后的Akt磷酸化FOXO3,磷酸化的FOXO3出核后,原始卵泡活化[8-9]。当原始卵泡活化发育为初级卵泡后,卵母细胞内的转化生长因子β(transforming growth factor-β,TGF-β)/SMAD信号通路开始调控卵泡的发育。BMP15属于TGF-β家族,在初级卵泡阶段的卵母细胞中表达,BMP15和GDF9以旁分泌的形式从卵母细胞分泌至卵母细胞与颗粒细胞的间隙,与颗粒细胞上的BMP受体结合,磷酸化并激活颗粒细胞内的SMADs蛋白,SMAD1、SMAD5、SMAD8蛋白作为通路中的信号因子,活化后磷酸化效应因子SMAD4,后者进入颗粒细胞核,调控SMAD靶基因的转录,促进颗粒细胞的增长与分化[10-13]。
SOHLH1是生殖细胞特异性转录因子,表达于原始卵泡到初级卵泡阶段,对原始卵泡的活化有重要作用[14-15]。当Sohlh1敲除后,卵母细胞中KIT/PI3K/ Akt信号通路中信号因子发生显著变化,原始卵泡无法活化[16]。本研究证实SOHLH1和FOXO3均可与Bmp15启动子区结合,SOHLH1可以上调Bmp15基因启动子区的转录活性,且FOXO3可抑制SOHLH1对Bmp15启动子区的转录激活作用,且该抑制作用随FOXO3表达量增加而逐渐增强。因此,推测FOXO3可能通过竞争性结合Bmp15的转录激活位点影响SOHLH1对Bmp15的转录调控。
由于SOHLH1与FOXO3都能与Bmp15启动子结合,因此推测在卵泡组装过程中,FOXO3入核并结合在Bmp15启动子上,占据了SOHLH1的结合位点,并抑制其转录,使Bmp15在原始卵泡阶段不能表达,当原始卵泡活化为初级卵泡后,FOXO3磷酸化从卵母细胞核中移出,释放了Bmp15启动子上SOHLH1的结合位点,使SOHLH1能够转录激活Bmp15,Bmp15在初级卵泡的卵母细胞中得以表达,随后BMP15从卵母细胞旁分泌至颗粒细胞表面,继续参与SMAD通路,完成卵母细胞对颗粒细胞的调控;也有另外的可能就是SOHLH1与FOXO3同时结合在Bmp15启动子上,FOXO3影响了SOHLH1对Bmp15的转录,或者FOXO3直接与SOHLH1结合并影响了SOHLH1对Bmp15的转录,具体通过何种途径造成FOXO3阻碍了SOHLH1对Bmp15的转录激活,其深入机制还有待进一步研究验证。
| [1] |
JASMI VK, SAMADI F, EIMANI H, et al. Follicle development in grafted mouse ovaries after vitrification processes under static magnetic field[J]. Cryo Letters, 2017, 38(3): 166-177. |
| [2] |
EZZATI MM, BAKER MD, SAATCIOGLU HD, et al. Regulation of FOXO3 subcellular localization by Kit ligand in the neonatal mouse ovary[J]. J Assist Reprod Genet, 2015, 32(12): 1741-1747. DOI:10.1007/s10815-015-0589-9 |
| [3] |
SALOMON AK, LEON K, CAMPBELL MM, et al. Folliculogenic factors in photoregressed ovaries:differences in mRNA expression in early compared to late follicle development[J]. Gen Comp Endocrinol, 2018, 260: 90-99. DOI:10.1016/j.ygcen.2018.01.003 |
| [4] |
TRIPURANI SK, COOK RW, ELDIN KW, et al. BMP-specific SMADs function as novel repressors of PDGFA and modulate its expression in ovarian granulosa cells and tumors[J]. Oncogene, 2013, 32(33): 3877-3885. DOI:10.1038/onc.2012.392 |
| [5] |
PANGAS SA. Bone morphogenetic protein signaling transcription factor(SMAD)function in granulosa cells[J]. Mol Cell Endocrinol, 2012, 356(1/2): 40-47. DOI:10.1016/j.mce.2011.06.021 |
| [6] |
BRUNET A, BONNI A, ZIGMOND MJ, et al. Akt promotes cell survival by phosphorylating and inhibiting a Forkhead transcription factor[J]. Cell, 1999, 96(6): 857-868. DOI:10.1016/s0092-8674(00)80595-4 |
| [7] |
ZAMORA-GUTIÉRREZ D, GUZMÁN A, HERNÁNDEZ-CORONADO CG, et al. Co-ordinated expression of the VEGF system components in granulosa cells to develop a proangiogenic autocrine milieu during ovarian follicle development[J]. Mol Reprod Dev, 2019, 86(2): 156-165. DOI:10.1002/mrd.23089 |
| [8] |
SAATCIOGLU HD, CUEVAS I, CASTRILLON DH. Control of oocyte reawakening by kit[J]. PLoS Genet, 2016, 12(8): e1006215. DOI:10.1371/journal.pgen.1006215 |
| [9] |
PELOSI E, OMARI S, MICHEL M, et al. Constitutively active Foxo3 in oocytes preserves ovarian reserve in mice[J]. Nat Commun, 2013, 4: 1843. DOI:10.1038/ncomms2861 |
| [10] |
OTSUKA F, SHIMASAKI S. A negative feedback system between oocyte bone morphogenetic protein 15 and granulosa cell kit ligand:its role in regulating granulosa cell mitosis[J]. Proc Natl Acad Sci USA, 2002, 99(12): 8060-8065. DOI:10.1073/pnas.122066899 |
| [11] |
REN Y, SUZUKI H, JAGARLAMUDI K, et al. Lhx8 regulates primordial follicle activation and postnatal folliculogenesis[J]. BMC Biol, 2015, 13: 39. DOI:10.1186/s12915-015-0151-3 |
| [12] |
丁祥云. Bmp4/Smad信号通路在小鼠原始卵泡发育中的作用及作用机制[D].济南: 山东大学, 2013. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y2331040
|
| [13] |
LAN ZJ, GU PL, XU XP, et al. GCNF-dependent repression of BMP-15 and GDF-9 mediates gamete regulation of female fertility[J]. EMBO J, 2003, 22(16): 4070-4081. DOI:10.1093/emboj/cdg405 |
| [14] |
BARRIOS F, FILIPPONI D, CAMPOLO F, et al. SOHLH1 and SOHLH2 control Kit expression during postnatal male germ cell development[J]. J Cell Sci, 2012, 125(Pt 6): 1455-1464. DOI:10.1242/jcs.092593 |
| [15] |
LI Y, QI WJ, LIU GQ, et al. Sohlh1 is required for synaptonemal complex formation by transcriptionally regulating meiotic genes during spermatogenesis in mice[J]. Mol Reprod Dev, 2019, 86(3): 252-264. DOI:10.1002/mrd.23100 |
| [16] |
LIU GQ, LI Y, DU B, et al. Primordial follicle activation is affected by the absence of Sohlh1 in mice[J]. Mol Reprod Dev, 2019, 86(1): 20-31. DOI:10.1002/mrd.23078 |
 2020, Vol. 49
2020, Vol. 49