文章信息
- 月小飞, 梅花, 宋丹, 张钰恒, 新春
- YUE Xiaofei, MEI Hua, SONG Dan, ZHANG Yuheng, XIN Chun
- 高氧诱导支气管肺发育不良模型新生大鼠肺组织中miR-21-5p的表达
- miR-21-5p expression in the lung tissue of neonatal rat with hyperoxia-induced bronchopulmonary dysplasia
- 中国医科大学学报, 2020, 49(7): 624-627, 635
- Journal of China Medical University, 2020, 49(7): 624-627, 635
-
文章历史
- 收稿日期:2019-04-15
- 网络出版时间:2020-06-24 9:14
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿呼吸系统常见并发症之一[1]。随着现代医疗技术水平的不断进步,新生儿重症监护病房的广泛建立,极低、超低出生体质量早产儿的存活率显著提高,致使BPD的发生率呈逐年上升趋势[2-3]。BPD患儿肺功能受损严重,生后吸氧时间长,离氧耐受性差,且呼吸系统疾病发生率及再次住院率均高于非BPD患者,严重威胁早产儿存活率及远期生活质量[4-5]。目前,BPD的发病机制尚不明确。微小RNA(microRNA,miRNA)是一种普遍存在于真核细胞中,由21~25个核苷酸组成的非编码RNA[6]。研究[7]发现,miRNA-21-5p(miR-21-5p)参与了BPD的发病过程,但它在BPD肺组织中的表达情况及调节机制仍不明确。本研究拟通过90%浓度的氧气暴露诱导建立新生SD大鼠BPD模型,并探讨miR-21-5p在BPD大鼠肺组织中的表达情况。
1 材料与方法 1.1 实验动物与模型建立新生2 h龄清洁级SD大鼠(内蒙古医科大学实验动物中心)60只,雌雄不限。按随机数字表法分为高氧组和对照组,每组30只。将高氧组大鼠置于自制饲养箱中(温度22~30 ℃,湿度65%~75%),箱内氧浓度维持在90%,放置适量钠石灰吸附箱内CO2。对照组大鼠置于箱内氧浓度维持在21%的饲养箱内,其余实验条件同高氧组。2组新生SD大鼠均由母鼠喂养,每隔24 h高氧组与对照组交换哺乳母鼠,每天定时开箱0.5 h,以更换垫料并添加足够饲料及水。
1.2 标本采集与处理分别于生后第1、4、7天从2组各随机取出10只大鼠,腹腔注射10%水合氯醛后处死,立即打开胸腔,暴露肺组织并取出双侧肺脏,用冰冻生理盐水反复冲洗。大鼠的右肺组织用于石蜡包埋、制备切片行HE染色,左肺组织置于EP管中,经液氮冷冻处理后,置于-80 ℃冰箱中冻存备用。
1.3 组织形态学观察2组各随机抽取4张HE染色的肺组织切片(厚4 μm),置于光学显微镜(×100倍)下观察,每张切片随机取5个视野,从呼吸性细支气管的中心部位至最近的纤维隔或胸膜做垂直连线,即辐射状肺泡计数(radical alveolar counts,RAC),计算RAC的平均值,作为肺泡化程度的指标。计数RAC的同时,采用专业图像分析软件Image-Pro Plus 6.0测量肺泡直径和肺泡腔切面面积。
1.4 实时荧光定量PCR检测2组肺组织中miR-21-5p的表达情况2组各取50 mg冻存的大鼠左肺组织,用TRIzol(美国Invitrogen公司)法提取总RNA。根据从miRBase查到的miR-21-5p序列(UAGCUUAUCAGACUGAUG UUGA),设计特异性引物,上游引物序列为5’ -CTCA ACTGGTGTCGTGGA-3’,下游引物序列为5’ -TCGGC AGGCAACAGC-3’。以U6作为内参基因,上游引物序列为5’ -CTCGCTTCGGCAGCACA-3’,下游引物序列为5’ -AACGCTTCACGAATTTGCGT-3’。合成的逆转录引物序列为CTCAACTGGTGTCGTGGAGT CGGCAATTCAGTTGAGCGACAGCCCATCGA。miR- 21-5p逆转录体系用逆转录试剂盒Superscript Ⅲ(美国Invitrogen公司)进行逆转录,以200 ng总RNA为模板,建立反应体系1,包含RNA 200 ng(10 μL),Oligo-dT 1 μL,Random 1 μL,混匀,65 ℃ 5 min后置于冰上。取12 μL反应体系1加入dNTP 1 μL、0.1 mol/ L DTT 2 μL、5×Buffer 4 μL及逆转录酶1 μL混匀,离心。置于42 ℃水浴60 min后,85 ℃、10 min灭活逆转录酶。实时荧光定量PCR反应采用SYBR QPCR Mix试剂盒,反应体系包含cDNA 2 μL、PCR mix 10 μL、上游引物1 μL、下游引物1 μL、ddH2O 6 μL。预变性95 ℃5 min,变性95 ℃10 s,退火58 ℃20 s,40个循环,延伸72℃ 20 s。得出循环阈值(cycle threshold,Ct),采用2-ΔΔCt法进行相对定量。ΔΔCt=ΔCtmiR-21-5p- ΔCtU6。
1.5 统计学分析2组RAC、肺泡直径、肺泡面积及miR-21-5P表达量采用x±s表示,同一时间点2组各指标比较采用t检验,同一组中各时间点指标比较采用F检验,2组间差异的比较采用LSD检验。P < 0.05为差异有统计学意义。
2 结果 2.1 组织形态学变化生后第1天,2组大鼠均肺泡结构清晰,肺泡间质无明显渗出与水肿,肺泡腔内未见明显渗出物;生后第4天,高氧组大鼠肺组织中肺泡结构尚清晰,但肺泡间质可见渗出与水肿,肺泡腔内可见少量炎性渗出物;生后第7天,随着高氧暴露时间的延长,高氧组大鼠出现肺组织结构紊乱,肺泡壁断裂破坏,部分融合成肺大泡,肺泡间质明显水肿、增宽;而对照组大鼠生后第4、7天,肺组织与生后第1天比较无明显变化。见图 1。
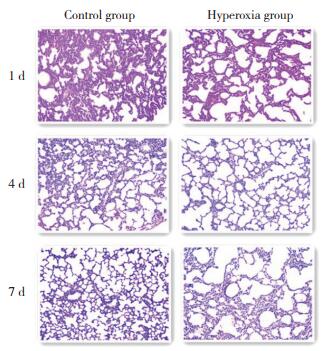
|
| 图 1 2组大鼠肺组织形态HE ×100 Fig.1 Morphology of the lung tissue in two groups of rats HE ×100 |
2.2 肺泡直径、肺泡腔切面面积及RAC
与生后第1天比较,生后第4、7天高氧组大鼠肺泡直径、肺泡腔切面面积明显增大,RAC逐渐减少;对照组大鼠生后第4、7天肺泡结构逐渐清晰,肺泡数量增多,肺泡直径逐渐变短,肺泡腔切面面积逐渐变小,RAC逐渐增多,差异均有统计学意义(P < 0.05)。见表 1~3。
| Group | 1 d | 4 d | 7 d | F | P |
| Hyperoxia | 52.60±0.98 | 58.40±1.061) | 69.50±1.721),2) | 487.261 | < 0.001 |
| Control | 52.30±1.06 | 49.70±1.221) | 47.50±1.311),2) | 39.969 | < 0.001 |
| t | 1.532 | 16.975 | 32.274 | ||
| P | 0.143 | < 0.001 | < 0.001 | ||
| 1)compared with the same group on the 1st day after birth,P < 0.05;2)compared with the same group on the 4th day after birth,P < 0.05. | |||||
| Group | 1 d | 4 d | 7 d | F | P |
| Hyperoxia | 2 345.60±119.21 | 2 983.00±152.681) | 4 782.00±178.001),2) | 692.042 | < 0.001 |
| Control | 2 432.00±140.44 | 2 121.00±112.681) | 1 993.00±99.611),2) | 36.114 | < 0.001 |
| t | 1.483 | 14.365 | 43.239 | ||
| P | 0.155 | < 0.001 | < 0.001 | ||
| 1)compared with the same group on the 1st day after birth,P < 0.05;2)compared with the same group on the 4th day after birth,P < 0.05. | |||||
| Group | 1 d | 4 d | 7 d | F | P |
| Control | 3.27±0.10 | 5.43±0.111) | 6.51±0.241),2) | 1 028.312 | < 0.001 |
| Hyperoxia | 3.32±0.07 | 2.92±0.101) | 2.47±0.111),2) | 1 346.829 | < 0.001 |
| t | 1.033 | 10.712 | 12.448 | ||
| P | 0.315 | < 0.001 | < 0.001 | ||
| 1)compared with the same group on the 1st day after birth,P < 0.05;2)compared with the same group on the 4th day after birth,P < 0.05. | |||||
2.3 miR-21-5P的表达
实时荧光定量PCR检测2组大鼠肺组织中miR- 21-5p的表达量,结果显示,随着时间的推移,高氧组大鼠肺组织内miR-21-5p的表达水平呈下降趋势,而对照组大鼠肺组织内miR-21-5p的表达水平呈上升趋势,差异有统计学意义(P < 0.05)。见表 4。
| Group | 1 d | 4 d | 7 d | F | P |
| Hyperoxia | 1.00±0.20 | 0.79±0.231) | 0.61±0.291),2) | 487.295 | < 0.001 |
| Control | 1.00±0.17 | 1.89±0.181) | 2.56±0.241),2) | 300.501 | < 0.001 |
| t | 1.202 | 3.267 | 11.588 | ||
| P | 0.245 | 0.004 | < 0.001 | ||
| 1)compared with the same group on the 1st day after birth,P < 0.05;2)compared with the same group on the 4th day after birth,P < 0.05. | |||||
3 讨论
BPD是影响早产儿死亡率及预后的主要疾病之一[1]。2000年美国国家卫生研究院制定了“新型”BPD的诊断标准[8],即任何新生儿如需氧支持超过28 d便可诊断,以肺泡和肺血管不成熟为主要表现,主要病理学特征为肺泡发育减缓,数量减少,融合成大肺泡,但肺纤维化程度较“经典”BPD轻。本研究中,新生2 h的SD大鼠持续暴露于90%高浓度氧气后,出现肺泡发育异常,且随着高氧暴露时间的延长,新生大鼠出现肺泡壁断裂破坏,结构简单化,肺泡间质明显水肿、增宽,间质内大量炎性细胞浸润,毛细血管数目减少。高氧诱导的新生大鼠BPD模型与“新型”BPD患儿肺部的病理改变一致[9]。本研究结果显示,高氧组大鼠RAC随着生后时间的推移,出现符合BPD患儿肺泡数量逐渐减少,融合成大肺泡的病理过程。
miRNA是重要的细胞内转录后调控因子,在细胞生长、发育和凋亡中发挥重要作用[10-11]。miRNA通过与mRNA的编码序列不完全互补结合或与其3’端非编码区结合,使目标mRNA的翻译过程受抑制并导致该mRNA分子降解,从而阻断目标基因的翻译过程,并完成转录后基因的调控[12]。miRNA具有开放阅读框架,但不具有编码蛋白质的功能,成熟miRNA的发夹结构在不同物种间具有高度保守性,其表达兼备严格的时空性与组织特异性[13]。BHASKARNA等[14]研究发现,大鼠BPD模型中miRNA的表达具有差异,其中miR-21的表达上调显著。VAPORIDI等[15]的研究也表明,在高通气相关肺损伤中,表达上调2倍以上的miRNAs有65个,其中,miR-21的表达上调尤为明显,且给予抗miR- 21后,肺组织的顺应性增加。本研究利用实时荧光定量PCR检测高氧组和对照组大鼠肺组织中miR- 21-5p的相对表达量,结果显示,随着时间的推移,高氧组大鼠肺组织内miR-21-5p的相对表达量呈下降趋势,而对照组则呈上升趋势;且2组大鼠miR- 21-5p的相对表达量与RAC呈正相关,与肺泡直径和肺泡腔切面面积呈负相关,提示对照组miR-21- 5p的相对表达量随着生后正常肺组织肺泡化过程逐渐增多;持续吸入高浓度氧气后,大鼠肺组织内miR-21-5p的相对表达量逐渐减少。表明miR-21-5p的相对表达量与肺组织肺泡化存在一定的相关性,高氧暴露条件下,肺组织中miR-21-5p的表达减少,并可能通过某种通路的调节引起肺组织发育不良。从miR-21-5p与其靶基因的作用网络图中发现,miR- 21-5p通过调控血管内皮生长因子信号通路、依赖环磷鸟苷蛋白激酶信号通路、氧化磷酸化、细胞凋亡等参与多种生命活动。覃松等[16]研究发现,在持续吸入高浓度氧气(> 90%)诱导的高氧性急性肺损伤动物模型中,miR-21-5p通过抑制磷酸酶和张力蛋白同源(phosphatase and tensin homolog,PTEN)基因的表达完成对大鼠肺组织的保护作用。目前的研究[17]认为miR-21-5p是抗凋亡因子,并通过作用于靶基因PTEN,抑制磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI-3K/ PKB)通路,完成抗凋亡机制。QIU等[18]研究发现,miR-21-5p通过作用于PI3-K/Akt和ERK通路上的靶蛋白maspin,完成对葡萄糖诱导的人视网膜微血管内皮细胞增殖和血管生成的调控作用。本研究中,虽然已发现在高氧诱导的BPD大鼠肺组织中miR- 21-5p的表达减少,但miR-21-5p在大鼠BPD发生过程中的具体作用和机制有待进一步探讨。
| [1] |
早产儿支气管肺发育不良调查协作组. 早产儿支气管肺发育不良发生率及高危因素的多中心回顾调查分析[J]. 中华儿科杂志, 2011, 49(9): 655-662. DOI:10.3760/cma.j.issn.0578-1310.2011.09.004 |
| [2] |
JO HS, CHO KH, CHO SI, et al. Recent changes in the incidence of bronchopulmonary dysplasia among very-low-birth-weight infants in Korea[J]. J Korean Med Sci, 2015, 30(Suppl 1): S81-S87. DOI:10.3346/jkms.2015.30.S1.S81 |
| [3] |
KALIKKOT TR, GUAMAN MC, SHIVANNA B. Bronchopulmonary dysplasia:a review of pathogenesis and pathophysiology[J]. Respir Med, 2017, 132: 170-177. DOI:10.1016/j.rmed.2017.10.014 |
| [4] |
RONKAINEN E, PERHOMAA M, MATTILA L, et al. Structural pulmonary abnormalities still evident in schoolchildren with new bronchopulmonary dysplasia[J]. Neonatology, 2018, 113(2): 122-130. DOI:10.1159/000481356 |
| [5] |
HASCOËT JM, PICAUD JC, LIGI I, et al. Review shows that using surfactant a number of times or as a vehicle for budesonide may reduce the risk of bronchopulmonary dysplasia[J]. Acta Paediatr, 2018, 107(7): 1140-1144. DOI:10.1111/apa.14171 |
| [6] |
LI XP, WU XF. MiR-21-5p promotes the progression of non-small-cell lung cancer by regulating the expression of SMAD7[J]. Oncotargets Ther, 2018, 11: 8445-8454. DOI:10.2147/ott.s172393 |
| [7] |
钟颖. Omega-3多不饱和脂肪酸在高氧诱导新生大鼠肺高压中的作用及机制研究[D].杭州: 浙江大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10335-1018207858.htm
|
| [8] |
JOBE AH, BANCALARI E. Bronchopulmonary dysplasia[J]. Am J Respir Crit Care Med, 2001, 163(7): 1723-1729. DOI:10.1164/ajrccm.163.7.2011060 |
| [9] |
张志梅.转化生长因子-β1在60%氧致新生鼠支气管肺发育不良模型中的作用研究[D].太原: 山西医科大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10114-2010157774.htm
|
| [10] |
PATTARAYAN D, THIMMULAPPA RK, RAVIKUMAR V, et al. Diagnostic potential of extracellular MicroRNA in respiratory diseases[J]. Clin Rev Allergy Immunol, 2018, 54(3): 480-492. DOI:10.1007/s12016-016-8589-9 |
| [11] |
裴祎, 张晓晶, 郑珂, 等. miR-212抑制骨肉瘤细胞恶性生物学行为的实验研究[J]. 中国医科大学学报, 2018, 47(10): 924-928. DOI:10.12007/j.issn.0258-4646.2018.10.014 |
| [12] |
IWASAKI YW, SIOMI H. MiRNA regulatory ecosystem in early development[J]. Mol Cell, 2014, 56(5): 615-616. DOI:10.1016/j.molcel.2014.11.010 |
| [13] |
EBRAHIMI A, SADRODDINY E. MicroRNAs in lung diseases:recent findings and their pathophysiological implications[J]. Pulm Pharmacol Ther, 2015, 34: 55-63. DOI:10.1016/j.pupt.2015.08.007 |
| [14] |
BHASKARAN M, XI D, WANG Y, et al. Identification of microRNAs changed in the neonatal lungs in response to hyperoxia exposure[J]. Physiol Genomics, 2012, 44(20): 970-980. DOI:10.1152/physiolgenomics.00145.2011 |
| [15] |
VAPORIDI K, VERGADI E, KANIARIS E, et al. Pulmonary microRNA profiling in a mouse model of ventilator-induced lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 303(3): L199-L207. DOI:10.1152/ajplung.00370.2011 |
| [16] |
覃松, 陈淼, 戢慧, 等. 微小RNA-21-5p拮抗Ⅱ型肺泡上皮细胞凋亡的分子机制[J]. 中华危重病急救医学, 2015, 27(7): 574-578. DOI:10.3760/cma.j.issn.2095-4352.2015.07.007 |
| [17] |
LI JW, WEI L, HAN ZJ, et al. Mesenchymal stromal cells-derived exosomes alleviate ischemia/reperfusion injury in mouse lung by transporting anti-apoptotic miR-21-5p[J]. Eur J Pharmacol, 2019, 852: 68-76. DOI:10.1016/j.ejphar.2019.01.022 |
| [18] |
QIU F, TONG HJ, WANG YW, et al. Inhibition of miR-21-5p suppresses high glucose-induced proliferation and angiogenesis of human retinal microvascular endothelial cells by the regulation of AKT and ERK pathways via maspin[J]. Biosci Biotechnol Biochem, 2018, 82(8): 1366-1376. DOI:10.1080/09168451.2018.1459179 |
 2020, Vol. 49
2020, Vol. 49