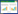文章信息
- 周发忱, 舒鑫, 周欣
- ZHOU Fachen, SHU Xin, ZHOU Xin
- 长链非编码RNA lnc-ZNF37A-2对肺癌细胞迁移和侵袭能力的影响
- Effects of long non-coding RNA lnc-ZNF37A-2 on invasion and migration abilities of lung cancer cells
- 中国医科大学学报, 2020, 49(7): 619-623
- Journal of China Medical University, 2020, 49(7): 619-623
-
文章历史
- 收稿日期:2020-04-18
- 网络出版时间:2020-06-24 9:13
2. 大连医科大学基础医学院组织胚胎学教研室, 辽宁 大连 116044
2. Department of Human Anatomy and Histoembryology, College of Basic Medical Sciences, Dalian Medical University, Dalian 116044, China
肺癌具有高发病率和高死亡率,严重影响人类的生命健康。中国的肺癌发病率高于全球,新发病例约占全球肺癌新发病例的37%[1]。近年来肺癌的诊断和治疗方法均有突破,但肺癌患者预后差仍是目前面临的严峻问题,统计表明,只有约7%的肺癌患者生存期超过5年[2-3]。肺癌细胞的恶性增殖和迁移是肺癌患者死亡的主要原因。因此,对肺癌发生、发展以及转移的机制进行探讨,对改善肺癌患者预后、延长生存期具有重要意义。
长链非编码RNA(long non-coding RNA,lncRNA)是一类存在于真核生物基因组中转录本长度大于200 nt的RNA分子,定位于细胞核或细胞质,但大多数不翻译成蛋白质[4]。有研究[5-6]表明,lncRNA在多种疾病的发生、发展过程中均异常表达,其调控的基因表达可发生在转录或转录后水平,在细胞凋亡、周期、增殖、迁移和化学抗性中担任重要角色。近年来lncRNA对肿瘤进展的调控作用受到广泛关注,其既能作为原癌基因促进肿瘤的发生发展,也能在肿瘤进展过程中起到抑制作用,发挥抑癌基因的功能[7-8]。然而,肺癌中lncRNA的详细分子机制尚不明确,需要进行深入研究。
lnc-ZNF37A-2是2014年发现的一种新的lncRNA[9],在易于发生淋巴结转移的肝癌细胞(HCCLYM-H2)中高表达,与定位相邻的可预测肺癌复发的H2AFY2基因共表达。但其在肺癌中的作用和机制目前仍不清楚。本研究通过生物信息学分析,采用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,分析lnc-ZNF37A-2(AL133271.1)在不同分期肺癌组织中的表达差异和临床意义,并通过细胞实验初步探讨lnc-ZNF37A-2对肺癌细胞A549迁移和侵袭能力的影响。
1 材料与方法 1.1 材料 1.1.1 细胞系肺癌细胞株A549、H1299购自中国科学院上海细胞库。
1.1.2 主要试剂RPMI 1640培养基和10%胎牛血清购自美国Hyclone公司;TRIzol试剂、PrimeScript逆转录试剂盒、SYBR PCR Master Mix购自日本TaKaRa公司;siRNA-lnc-ZNF37A-2、阴性对照siRNA和转染试剂Lipofectamine 2000购自美国Invitrogen公司;Transwell小室购自美国CORNING公司。
1.2 方法 1.2.1 细胞培养将细胞培养于37 ℃、5%CO2的常规细胞培养箱,使用含10%胎牛血清、100 mg/L青霉素/链霉素的RPMI 1640培养基培养。待细胞贴壁且占满培养皿底面积的80%~90%后传代。
1.2.2 实时定量PCR(real-time quantitative PCR,qRT-PCR)将细胞用PBS清洗3遍,TRIzol试剂提取细胞总RNA,逆转录反应体系根据说明书配置,合成cDNA后,将cDNA稀释10倍,进行实时PCR,以2-ΔΔCt法定量分析,使用人GAPDH为内参,RNA free H2O为阴性对照,实验重复3次。GAPDH引物:上游5’-GCACCGTCAAGGCTGAGAAC-3’,下游5’-TGGTGAAGACGCCAGTGGA-3’;lnc-ZNF37A-2引物:上游5’-TTGCCCTGGTGTGCTGCTTTG-3’,下游5’-AGTCCATCCTCATCCTCTCCCATG-3’。
1.2.3 细胞转染将细胞接种到6孔板中,培养24 h后密度达到70%,转染。设立lnc-ZNF37A-2干扰组(si-lnc-ZNF37A-2组)、阴性转染组(NC组)、空白对照组。将Lipofectamine 2000与si-lnc-ZNF37A-2或si-NC混合(终浓度为100 nmol/L)构建转染体系,将混合液加入6孔板中,37 ℃培养4 h,更换RPMI 1640完全培养基培养24 h,即可进行后续实验。lnc-ZNF37A siRNA:顺义,5’-AGUGAUAAGUGAAAUGGUGCA- 3’,反义,5’-CACCAUUUCACUUAUCACUUU-3’。
1.2.4 划痕实验检测细胞迁移能力采用伤口愈合测定法评估细胞的迁移能力。细胞以6×105/孔的密度铺6孔板。当细胞生长到100%汇合时,使用200 μL移液管吸头划伤伤口。用PBS将培养板洗涤3次,以除去细胞碎片,然后将细胞培养于不含胎牛血清的不完全RPMI 1640培养基中,37 ℃继续培养。光学显微镜下拍摄初始伤口和培养48 h后恢复区域。计算伤口愈合面积,每个实验重复3次。
1.2.5 Transwell侵袭实验检测细胞侵袭能力每个Transwell小室(孔径为8 μm)的上室加入1 : 4体积比的基质胶与无血清培养基混合液100 μL,待基质胶凝固后进行实验,评估细胞的侵袭能力。待细胞长到适宜密度后无血清处理4 h;收集饥饿处理过的细胞,上室接种细胞5×104/孔,加入无血清培养基200 μL,下室加入700 μL完全培养基,37 ℃培养48 h;取出小室,PBS清洗3次,4%多聚甲醛室温固定30 min;PBS清洗3次,晾干后加入600 μL 0.2%的结晶紫溶液,室温染色30 min,用棉签小心擦掉上室细胞,在正置光学显微镜下随机选择5个视野以计数细胞数量。每个实验重复3次。
1.2.6 生物信息学分析访问GEPIA(http://gepia.cancer-pku.cn)主页,进入单基因分析中的Stage Plots页面,能够可视化分析不同分期的lnc-ZNF37A-2表达量。访问starBase v3.0(http://starBase.sysu.edu.cn)主页,进入Pan-Cancer页面,分析lnc-ZNF37A-2表达量与肺癌患者总生存期的关系。利用在线数据库CoLncRNA(http://www.bio-bigdata.com/Co-LncRNA/)中肺癌数据集(GSE34329),查找与lnc-ZNF37A-2共表达的mRNA,并绘制共表达调控网络,之后将预测得到的共表达基因在CEGsFuncs菜单中进行GO和KEGG基因功能富集分析。利用starBase v3.0网站预测lnc-ZNF37A-2与ANAI1、FOXC2和TWIST1表达的相关性。
1.3 统计学分析采用GraphPad Prism 7.0软件处理数据,不同病理分期表达差异的比较采用F检验;生存曲线比较采用log-rank(Mantel-Cox)检验;2组间比较采用配对样本t检验;相关性分析采用Pearson线性相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 TCGA分析lnc-ZNF37A-2在肺癌组织中高表达利用TCGA数据库分析485例不同肺癌分期患者的组织样本中lnc-ZNF37A-2表达的差异(图 1),结果发现,lnc-ZNF37A-2在Ⅰ期患者中表达较低,在Ⅳ期患者中表达最高,提示lnc-ZNF37A-2在晚期肺癌组织中高表达,可能发挥癌基因的作用。
|
| 图 1 lnc-ZNF37A-2在不同病理分期的肺癌患者中的表达 Fig.1 The expression of lnc-ZNF37A-2 for different pathological stages in lung cancer patients |
2.2 lnc-ZNF37A-2表达与肺癌患者生存期的关系
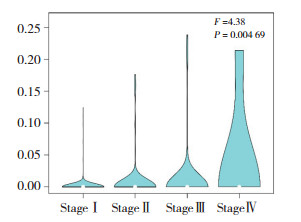
应用log-rank检验分析lnc-ZNF37A-2表达水平与肺癌患者总生存期的关系(图 2),结果发现,lncZNF37A-2表达对肺癌患者总生存期可能有影响,lnc-ZNF37A-2高表达的部分肺癌患者总生存期缩短(P =0.3)。
|
| 图 2 lnc-ZNF37A-2表达与肺癌患者预后的相关性 Fig.2 Relationship between the expression of lnc-ZNF37A-2 and the prognosis of lung cancer patients |
2.3 lnc-ZNF37A-2共表达的mRNA网络构建与基因富集分析
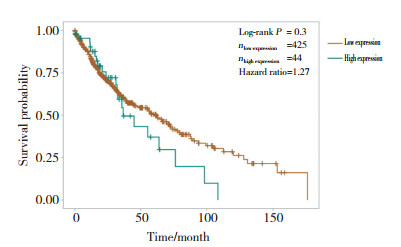
为了探究lnc-ZNF37A-2影响患者预后的原因,通过Co-LncRNA网站预测与lnc-ZNF37A-2相关的mRNA,共发现107个基因与lnc-ZNF37A-2共表达(图 3A)。对共表达的基因的生物过程(GO:BP)、细胞组分(GO:CC)、分子功能(GO:MF)进行功能富集分析(图 3B)。结果发现,共表达基因与几个过程有关,如碳酸氢盐运输、细胞基质黏附、小分子代谢过程、胞内环磷酸腺苷应答、细胞周期蛋白依赖性蛋白丝氨酸/苏氨酸激酶活性的调控。细胞外基质受体相互作用、转化生长因子β信号通路和氧化磷酸化调节的信号通路是富集的主要通路。提示lncZNF37A-2在肺癌细胞侵袭、迁移活性的调控中发挥重要作用。
|
| A,the mRNAs network co-expressed with lnc-ZNF37A-2(green triangle indicates lnc-ZNF37A-2,and yellow circle indicates mRNAs);B,significantly enriched GO terms were analyzed for co-expression mRNAs of lnc-ZNF37A-2;C,significantly enriched pathway terms were analyzed for co-expression mRNAs of lnc-ZNF37A-2. 图 3 lnc-ZNF37A-2共表达的mRNA网络与基因富集分析 Fig.3 The network of co-expressed mRNAs with lnc-ZNF37A-2 and gene enrichment analysis |
2.4 抑制肺癌细胞中lnc-ZNF37A-2表达后细胞侵袭和迁移能力减弱
验证siRNA对细胞中lnc-ZNF37A-2表达的干扰效率,通过实时PCR检测A549、H1229细胞中转染siRNA-lnc-ZNF37A-2后lnc-ZNF37A-2的表达,结果发现,与空白对照组和NC组比较,转染siRNA-lncZNF37A-2的A549和H1229细胞中lnc-ZNF37A-2表达明显降低(图 4A),差异有统计学意义(P < 0.001),说明该siRNA可沉默肺癌细胞中lnc-ZNF37A-2的表达。
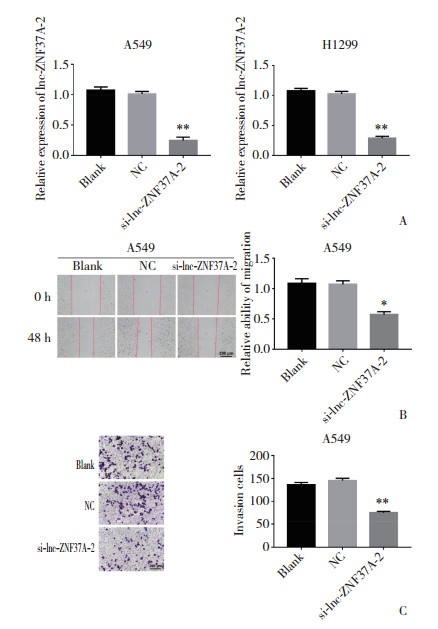
|
| A,relative expression of lnc-ZNF37A-2 in A549 and H1299 lung cancer cells transfected with applied lnc-ZNF37A-2 siRNA,the negative control(NC)siRNA or blank group;B,wound healing assay showed the influence of lnc-ZNF37A-2 silencing on migration ability of A549 cells in comparison with NC;C,the invasion capability of A549 transfected with lnc-ZNF37A-2 compared to NC were found using Transwell assays. *P < 0.001;**P < 0.000 1. 图 4 沉默lnc-ZNF37A-2的表达抑制肺癌细胞的侵袭和迁移能力 Fig.4 Invasion and migration capability was inhibited after silencing lnc-ZNF37A-2 expression in lung cancer cells |
由于A549细胞中siRNA-lnc-ZNF37A-2沉默效率高,因此使用A549细胞株进行后续实验。通过划痕实验检测细胞迁移水平的改变,结果发现,A549细胞转染siRNA-lnc-ZNF37A-2使其沉默后,细胞迁移能力明显降低(图 4B),差异有统计学意义(P < 0.001)。通过Transwell侵袭实验检测抑制肺癌细胞中lnc-ZNF37A-2表达后细胞侵袭能力的改变,结果表明,A549细胞中沉默lnc-ZNF37A-2后,与NC组比较,siRNA-lnc-ZNF37A-2组细胞的侵袭能力明显降低(图 4C)(P < 0.001)。提示lnc-ZNF37A-2在肺癌细胞侵袭、迁移的调控中发挥重要作用。
3 讨论肺癌是发病率和死亡率很高的恶性肿瘤,主要原因为早期诊断难度较大,确诊时多为中晚期并已经发生远处转移,患者错过了最佳手术时机,而且治疗后易局部复发。但肺癌侵袭和转移的相关机制尚未完全明确,临床研究推测与趋化因子刺激、基质成分降解和上皮-间质转化等有关[10-12]。因此,早期准确评价肿瘤侵袭和转移的情况对有效治疗和改善预后至关重要。
lncRNA起初被认为是基因组转录的“噪音”,随着高通量测序技术的发展,大量具有生物学功能的lncRNA进入人们的视野。近来研究表明,lncRNA通过表观遗传学修饰、转录和转录后水平以及可变剪接调控细胞周期、分化、凋亡等发挥生物学作用,如HOTAIR、AK126698、HOTTIP和TUG1等lncRNA明显影响肺癌细胞增殖、迁移、凋亡、化疗药物敏感性等不同生物学功能[6, 13-14]。以往研究[9, 15]发现,在易发生淋巴结转移的肝癌细胞H2中,lncZNF37A-2(RP11-672F9.1)的表达量显著增加,与lnc-ZNF37A-2共表达的邻近基因H2AFY2与肺癌复发相关。本研究发现,与Ⅰ~Ⅲ期肺癌患者相比,lncZNF37A-2在Ⅳ期肺癌患者中表达量上调,提示lncZNF37A-2与肺癌的进展相关;且lnc-ZNF37A-2高表达的患者总生存期较短,提示其有望成为预测肺癌预后的指标。然后,通过富集分析与lnc-ZNF37A-2共表达的mRNA,推测lnc-ZNF37A-2与细胞黏附以及细胞外基质受体相互作用相关,可能影响肺癌侵袭、转移。通过体外细胞实验探讨lnc-ZNF37A-2对肺癌细胞A549侵袭、迁移的作用,结果发现,抑制肺癌细胞中lnc-ZNF37A-2表达,肺癌细胞侵袭和迁移能力显著降低,表明lnc-ZNF37A-2可能通过促进细胞的侵袭和迁移参与肺癌的发展。
本研究仍有以下不足,首先是缺少机制证据说明这些结果直接相关;其次,lnc-ZNF37A-2对肺癌细胞增殖和药物敏感性有何影响及可能的信号转导机制仍需进一步研究。
综上所述,本研究利用大数据挖掘结合细胞实验发现lnc-ZNF37A-2在晚期肺癌组织中高表达,且与患者不良预后相关;沉默lnc-ZNF37A-2表达会减弱肺癌细胞的侵袭和迁移能力,此过程可能是通过调控肿瘤微环境中的细胞黏附和细胞外基质受体相互作用实现的。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [3] |
SEKIHARA K, AOKAGE K, OKI T, et al. Long-term survival after complete resection of non-small-cell lung cancer in patients with interstitial lung disease[J]. Interact Cardiovasc Thorac Surg, 2018, 26(4): 638-643. DOI:10.1093/icvts/ivx400 |
| [4] |
KHALIL AM, GUTTMAN M, HUARTE M, et al. Many human large intergenic noncoding RNAs associate with chromatin-modifying complexes and affect gene expression[J]. Proc Natl Acad Sci U S A, 2009, 106(28): 11667-11672. DOI:10.1073/pnas.0904715106 |
| [5] |
LI K, SUN D, GOU Q, et al. Long non-coding RNA linc00460 promotes epithelial-mesenchymal transition and cell migration in lung cancer cells[J]. Cancer Lett, 2018, 420: 80-90. DOI:10.1016/j.canlet.2018.01.060 |
| [6] |
CHAN JJ, TAY Y. Noncoding RNA:RNA regulatory networks in cancer[J]. Int J Mol Sci, 2018, 19(5): E1310. DOI:10.3390/ijms19051310 |
| [7] |
LIU Z, CHEN Z, FAN R, et al. Over-expressed long noncoding RNA HOXA11-AS promotes cell cycle progression and metastasis in gastric cancer[J]. Mol Cancer, 2017, 16(1): 82. DOI:10.1186/s12943-017-0651-6 |
| [8] |
XIAO ZD, HAN L, LEE H, et al. Energy stress-induced lncRNA FILNC1 represses c-Myc-mediated energy metabolism and inhibits renal tumor development[J]. Nat Commun, 2017, 8(1): 783. DOI:10.1038/s41467-017-00902-z |
| [9] |
FANG TT, SUN XJ, CHEN J, et al. Long non-coding RNAs are differentially expressed in hepatocellular carcinoma cell lines with differing metastatic potential[J]. Asian Pac J Cancer Prev, 2014, 15(23): 10513-10524. DOI:10.7314/apjcp.2014.15.23.10513 |
| [10] |
高晓函, 温洁, 马龙, 等. 非小细胞肺癌脑转移的治疗进展[J]. 中国医药科学, 2019, 9(16): 51-55. DOI:10.3969/j.issn.2095-0616.2019.16.012 |
| [11] |
段新如, 汪修平, 王爱民. 血清肿瘤标志物检测在非小细胞肺癌侵袭和转移中的意义[J]. 中国肿瘤临床与康复, 2020, 27(3): 335-338. DOI:10.13455/j.cnki.cjcor.2020.03.21 |
| [12] |
祝丽晶, 李芹芹, 刘强, 等. 血清基质金属蛋白酶-9水平在非小细胞肺癌侵袭和转移中意义[J]. 中华实用诊断与治疗杂志, 2017, 31(2): 165-166. DOI:10.13507/j.issn.1674-3474.2017.02.018 |
| [13] |
樊黎明, 胡志东. LncRNA在非小细胞肺癌中的研究进展[J]. 中国肺癌杂志, 2016, 19(2): 108-112. DOI:10.3779/j.issn.1009-3419.2016.02.10 |
| [14] |
杨莉, 孙耕耘, 秦一雨, 等. LncRNA-HOTTIP促进肺癌发生发展的作用及机制研究[J]. 安徽医科大学学报, 2019, 54(1): 21-27. DOI:10.19405/j.cnki.issn1000-1492.2019.01.005 |
| [15] |
SPORN JC, KUSTATSCHER G, HOTHORN T, et al. Histone macroH2A isoforms predict the risk of lung cancer recurrence[J]. Oncogene, 2009, 28(38): 3423-3428. DOI:10.1038/onc.2009.26 |
 2020, Vol. 49
2020, Vol. 49