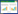文章信息
- 陈仕毅, 付玉平, 冯晓晶, 刘少奎
- CHEN Shiyi, FU Yuping, FENG Xiaojing, LIU Shaokui
- 阿托伐他汀对急性心肌梗死大鼠Ang-1及其受体Tie2 mRNA表达的影响
- Effect of atorvastatin treatment on mRNA expression levels of Ang-1 and its receptor Tie2 in rats with acute myocardial infarction
- 中国医科大学学报, 2020, 49(7): 606-609, 614
- Journal of China Medical University, 2020, 49(7): 606-609, 614
-
文章历史
- 收稿日期:2020-01-06
- 网络出版时间:2020-06-24 9:07
2. 中国医科大学附属第一医院骨科, 沈阳 110001;
3. 北部战区总医院和平院区骨科, 沈阳 110042
2. Department of Orthopaedics, The First Hospital, China Medical University, Shenyang 110001, China;
3. Department of Surgery, Heping Hospital, Northern Theater General Hospital, Shenyang 110042, China
血管新生在急性心肌梗死(acute myocardial infarction,AMI)发病及治疗过程中起关键性作用。在众多的促血管生成、发展及成熟因素中,最重要的是促血管生成素(angiopoietin,Ang)及其受体(Ang/Tie2)系统。Ang-1为内皮细胞特异生长因子,与Tie2受体结合,在血管新生、调控血管的完整性、维持其稳定性过程中发挥作用[1]。研究[2]发现,阿托伐他汀保护心血管的功能与其调脂作用无关,其是否对微血管新生具有潜在的药物作用机制研究相对较少。本研究通过建立大鼠AMI模型,观察阿托伐他汀药物治疗对AMI大鼠心肌组织Ang-1及其受体Tie2 mRNA表达水平的影响,探讨阿托伐他汀药物在AMI血管生成过程中的作用及机制。
1 材料与方法 1.1 实验动物分组及模型建立 1.1.1 动物分组6~8周龄雄性SD大鼠80只,体质量200~250 g,购自大连医科大学实验动物中心。在室温20~25 ℃的动物房中饲养3 d后,将大鼠随机分3组:正常(CG)组20只、单纯心肌梗死(AG)组30只、心肌梗死联合阿托伐他汀(AAG)组30只。
1.1.2 建立AMI模型使用氯胺酮与速眠新药物麻醉AG与AAG组大鼠;将大鼠仰卧固定于操作台上,使用大鼠灌胃直针(65 mm)进行气管插管,深约40~50 mm,动物呼吸机设置参数为频率60次/min,潮气量30 mL,呼吸比率1 : 1;于胸骨左缘心脏搏动最强点上一肋间(即第4、5肋间)做一斜行长约1 cm切口,打开胸腔并钝性分离开心包,于左心耳下方冠状动脉(以下简称冠脉)走行处,距离肺动脉根部3 mm结扎,深度≥ 1 mm,结扎后可见左心室心肌苍白变薄,观察大鼠生命体征变化,关闭胸腔并保持胸腔负压状态,冲洗消毒后缝合;AG组在术后3 d开始给予阿托伐他汀[10 mg/(kg·d)]灌胃,AG组及CG组以同等剂量生理盐水灌胃,最终获得CG组20只,AG组24只,AAG组25只,在灌胃后0 d、14 d和28 d,分别取梗死部位心肌组织。
1.2 主要试剂及仪器阿托伐他汀钙(美国辉瑞制药有限公司),PCR扩增试剂盒(上海生工生物工程有限公司),DNA Marker(上海生工生物工程有限公司),UNIQ-10柱式总RNA抽提试剂盒(上海生工生物工程有限公司),M-MuLV第一链cDNA合成试剂盒(上海生工生物工程有限公司),引物合成(上海生工生物工程有限公司),高速微型离心机(DGW99)型(深圳市点晶科学仪器有限公司),紫外分光光度计(上海美析仪器有限公司),DY-300型低压电泳仪(汕头市医用设备厂有限公司),电热恒温水浴箱(上海跃进医疗器械厂),动物呼吸机ALC-V8(上海奥尔科特生物科技有限公司)。
1.3 实时PCR检测Ang-1及其受体Tie2 mRNA的表达分别于灌胃14 d和28 d处死大鼠,取AG组及CG组及AAG组大鼠的心肌组织,依据RT-PCR试剂说明书,按步骤分别检测Ang-1及其受体Tie2 mRNA的表达量。
1.3.1 提取RNA称取不少于30 mg的心肌组织,将研磨后的心肌组织置于离心管中加入RLT Solution震荡混匀,离心并吸取上清液加入无水乙醇后混匀,使用吸附柱及DEPC-treated ddH2O获得RNA溶液。
1.3.2 RNA纯度的测定使用DEPC处理水将提取的RNA稀释,使用紫外分光光度计测定A260值及A280值。用DEPC-Treated ddH2O作为空白对照。
1.3.3 RNA反转录将提取的RNA加入Oligo(dT)及RNase-free ddH20后混匀并离心,65 ℃温浴5 min,冰浴30 s,离心。分别加入反应物Reaction Buffer 4 μL、RNase Inhibitor 1 μL、dNTP Mix 2 μL、M-MuLV RT 1 μL,混匀后离心。在PCR仪上进行cDNA合成(42 ℃),终止反应(70 ℃)。
1.3.4 实时PCRcDNA产物加入上游Primer、下游Primer、Taq DNA Polymerase等试剂,通过变性、退火、延伸等步骤进行扩增,Tie2、Ang-1、β-actin退火温度分别为57 ℃、55 ℃、58 ℃。
1.3.5 PCR产物检测PCR产物用1%琼脂糖凝胶溶液进行电泳,在紫外观测仪上观察电泳结果,采用凝胶成像系统拍照并分析条带。
1.4 病理学检查2周处死大鼠,取左心室冠状面梗死区中部切片,置于4 %的多聚甲醛溶液中固定10 h石蜡包埋待用。制5μm厚切片,随机取3张切片进行观察,切片HE染色(苏木精和伊红染色法)。
1.5 统计学分析采用SPSS 17.0统计学软件进行数据处理,数据以x±s表示。组间均数比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 AMI模型大鼠心肌细胞的病理改变光镜下,正常大鼠心肌细胞排列有序紧密,无明显炎症细胞浸润;冠脉结扎术后大鼠心肌细胞排列紊乱、稀疏,有中性粒细胞浸润,见图 1。
|
| A,myocardial tissue of CG group;B,myocardial tissue of AG group. 图 1 AMI模型大鼠心肌细胞的病理变化HE染色×400 Fig.1 Pathological changes in myocardial cells of AMI rats HE staining×400 |
2.2 阿托伐他汀影响AMI大鼠Ang-1及其受体Tie2 mRNA的表达
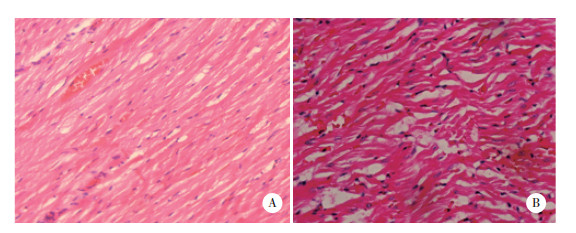
阿托伐他汀作用AMI大鼠14 d时,AAG组及AG组Tie2 mRNA的表达高于CG组,AAG组明显高于AG组,差异有统计学意义(P < 0.05)(见图 2,表 1、2);Ang-1 mRNA在AAG组、AG组及CG组的表达,组间比较差异无统计学意义(P > 0.05,见图 2,表 1、2)。
|
| 1,normal group;2,AAG group;3,AG group. 图 2 阿托伐他汀对AMI大鼠Ang-1及Tie2 mRNA的表达影响(药物作用14 d) Fig.2 Effect of atorvastatin on mRNA expression of Ang-1 and Tie2 in AMI rats(14 d after drug action) |
| Group | Tie2 gene expression | |
| 14 d | 28 d | |
| CG | 0.385±0.312 | 0.387±0.351 |
| AG | 0.507±0.1221) | 0.358±0.035 |
| AAG | 0.739±0.3821) | 0.389±0.045 |
| 1)P < 0.05 compared with the CG group. | ||
| Group | Tie2 gene expression | |
| 14 d | 28 d | |
| CG | 0.289±0.051 | 0.276±0.020 |
| AG | 0.308±0.0361) | 0.286±0.015 |
| AAG | 0.311±0.0371) | 0.321±0.030 |
| 1)P < 0.05 compared with the CG group. | ||
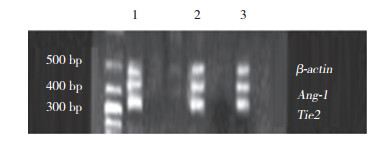
阿托伐他汀作用AMI大鼠28 d时,Tie2 mRNA的表达在AAG组及AG组、CG组中,组间表达无明显差异(P > 0.05);Ang-1 mRNA的表达在AAG组及AG组及CG组,组间表达无统计学差异。见图 3,表 1、2。
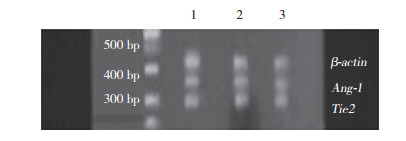
|
| 1,normal group;2,AAG group;3,AG group 图 3 阿托伐他汀对AMI大鼠Ang-1及Tie2的基因表达影响(药物作用28 d) Fig.3 Effect of atorvastatin on gene expression of Ang-1 and Tie2 in AMI rats(28 d after drug action) |
3 讨论
在缺血性冠脉疾病中,形成冠状动脉侧支循环主要有3种途径,即主干血管的延伸生长,毛细血管网络的形成和侧支动脉的产生[3]。他汀类药物目前被广泛应用于防治心脑血管疾病。研究[4]发现他汀类药物除降脂作用外,还可以促进缺血组织中的血管再生成。通过增加冠状动脉的侧支循环来治疗AMI,但其具体机制尚不明确。
Ang/Tie2系统是调控血管新生的途径[5-8],其中Ang-1/Tie2途径是维持血管完整性的重要因子,同时在新生血管形成、发展及成熟的过程中起重要作用[9]。JONES等[10]认为Ang-1与Tie2受体结合,能够促进Tie2受体磷酸化,维持血管完整性并调节血管功能。YIN等[11]研究证实Ang-1通过PI3信号传导通路激活Tie2,改善心肌老化。KIM[12]提出Ang-1通过抑制高脂血症诱发的冠状动脉内皮细胞的凋亡,维持内皮细胞稳定性。陈仕林等[13]的研究证明,用Ang-1基因干预治疗的AMI心肌周围毛细血管密度显著高于正常对照组。VASA等[14]的研究发现他汀类药物能促进内皮祖细胞动员、迁移以及分化,促进梗死区域血管再生。有研究[15-17]发现,他汀类药物可通过PI3K/Akt信号传导途径促进血管新生。
本研究基于他汀类药物在血管新生方面的作用,研究其在AMI血管新生过程的作用及其机制。结果显示,14 d时Tie2 mRNA表达,AMI组与正常组相比,差异有统计学意义,AAG组与AG组Tie2 mRNA差异有统计学意义,说明在AMI区域Tie2的表达升高,且Tie2在AAG组中表达明显升高。14 d及28 d时Ang-1的表达正常组与AG组相比,AAG组与AG组相比,差异均无统计学意义。研究[18]发现,建立AMI模型后,在非梗死区心肌组织中Tie2 mRNA表达没有变化,而在梗死区心肌组织中表达明显升高,Ang-1 mRNA的表达水平在梗死区与非梗死区均无变化,本研究结果与其一致。研究中发现正常组与AG组Ang-1 mRNA表达没有差异,但AG组均数均比正常组大,说明Ang-1 mRNA表达还是相对上调的,分析原因可能是与研究选取时间及样本量有关。在14 d时AAG组Tie2 mRNA表达较AG组升高,在28 d时Tie2的表达与正常组无差异,说明阿托伐他汀可能只具有在早期通过上调Tie2 mRNA促进血管再生作用。Tie2 mRNA表达是上调能够激活了内源性血管生成机制,Ang-1在内皮细胞表达促进血管新生、成熟和稳定[19],但与本研究结果Tie2 mRNA表达升高,Ang-1 mRNA的表达无变化矛盾。进一步推测可能是阿托伐他汀药物通过上调Tie2 mRNA表达促进血管新生。
综上所述,本研究基于他汀类药物在血管新生方面的作用,研究其在AMI血管新生过程的作用及机制。Ang-1及Tie2的表达水平与AMI血管新生间呈一定的相关性。由此推测,阿托伐他汀钙可能通过上调Tie2 mRNA表达共同促进血管新生,Ang-1是他汀类药物促血管新生的重要介导因素,这可能为阿托伐他汀在促进新生血管,治疗缺血性心脏病的临床应用提供了理论依据。
| [1] |
FISHER J, DOUGLAS JJ, LINDER A, et al. Elevated plasma angiopoietin-2 levels are associated with fluid overload, organ dysfunction, and mortality in human septic shock[J]. Crit Care Med, 2016, 44(11): 2018-2027. DOI:10.1097/CCM.0000000000001853 |
| [2] |
王惠, 覃数, 何泉, 等. 辛伐他汀促进模型大鼠心肌梗死后局部血管新生[J]. 基础医学与临床, 2010, 30(10): 1066-1071. DOI:10.16352/j.issn.1001-6325.2010.10.010 |
| [3] |
李伟, WINSTONNS, EUGENEKS. 血管生成素-1对猪慢性缺血心肌中功能性新生血管增生的促进作用[J]. 复旦学报(医学版), 2018, 45(3): 347-353. DOI:10.3969/j.issn.1672-8467.2018.03.010 |
| [4] |
WONG AL, HAROON ZA, WERNER S, et al. Tie2 expression and phosphorylation in angiogenic and quiescent adult tissues[J]. Circ Res, 1997, 81(4): 567-574. |
| [5] |
MANNHEIM D, HERRMANN J, BONETTI PO, et al. Simvastatin preserves diastolic function in experimental hypercholesterolemia independently of its lipid lowering effect[J]. Atherosclerosis, 2011, 216(2): 283-291. DOI:10.1016/j.atherosclerosis.2011.02.036 |
| [6] |
AUGUSTIN HG, KOH GY. Organotypic vasculature:from descriptive heterogeneity to functional pathophysiology[J]. Science, 2017, 357(6353): 2379. DOI:10.1126/science.aal2379 |
| [7] |
SONG SH, KIM KL, LEE KA, et al. Tie1 regulates the Tie2 agonistic role of angiopoietin-2 in human lymphatic endothelial cells[J]. Biochem Biophys Res Commun, 2012, 419(2): 281-286. DOI:10.1016/j.bbrc.2012.02.009 |
| [8] |
DAVIS S, ALDRICH TH, JONES PF, et al. Isolation of angiopoietin-1, a ligand for the TIE2 receptor, by secretion-trap expression cloning[J]. Cell, 1996, 87(7): 1161-1169. DOI:10.1016/S0092-8674(00)81812-7 |
| [9] |
KORPELAINEN EI, KÄRKKÄINEN M, GUNJI YJ, et al. Endothelial receptor tyrosine kinases activate the STAT signaling pathway:mutant Tie-2 causing venous malformations signals a distinct STAT activation response[J]. Oncogene, 1999, 18(1): 1-8. DOI:10.1038/sj.onc.1202288 |
| [10] |
JONES N, DUMONT DJ. The Tek/Tie2 receptor signals through a novel Dok-related docking protein, Dok-R[J]. Oncogene, 1998, 17(9): 1097-1108. DOI:10.1038/sj.onc.1202115 |
| [11] |
YIN DL, LI CF, KAO RL, et al. Angiopoietin-1 inhibits doxorubicininduced human umbilical vein endothelial cell death by modulating fas expression and via the PI3K/Akt pathway[J]. Endothelium, 2004, 11(5/6): 247-252. DOI:10.1080/10623320490904115 |
| [12] |
KIM I. The angiopoietin-Tie2 system in coronary artery endothelium prevents oxidized low-density lipoprotein-induced apoptosis[J]. Cardiovasc Res, 2001, 49(4): 872-881. DOI:10.1016/s0008-6363(00)00295-9 |
| [13] |
陈仕林, 刘玉清, 朱成楚, 等. 转染Angiopoietin-1基因对急性心梗后左室功能的影响[J]. 中国分子心脏病学杂志, 2005, 5(2): 457-462, 513. DOI:10.16563/j.cnki.1671-6272.2005.02.003 |
| [14] |
VASA M, FICHTLSCHERER S, ADLER K, et al. Increase in circulating endothelial progenitor cells by statin therapy in patients with stable coronary artery disease[J]. Circulation, 2001, 103(24): 2885-2890. DOI:10.1161/hc2401.092816 |
| [15] |
ASSMUS B, URBICH C, AICHER A, et al. HMG-CoA reductase inhibitors reduce senescence and increase proliferation of endothelial progenitor cells via regulation of cell cycle regulatory genes[J]. Circ Res, 2003, 92(9): 1049-1055. DOI:10.1161/01.res.0000070067.64040.7c |
| [16] |
刘少奎, 杨桂美, 王筱梅, 等. 阿托伐他汀对兔循环内皮祖细胞数和心肌血管新生的影响[J]. 药学服务与研究, 2010, 10(2): 115-119. DOI:10.3969/j.issn.1671-2838.2010.02.007 |
| [17] |
DIMMELER S, AICHER A, VASA M, et al. HMG-CoA reductase inhibitors(statins)increase endothelial progenitor cells via the PI 3-kinase/Akt pathway[J]. J Clin Invest, 2001, 108(3): 391-397. DOI:10.1172/jci200113152 |
| [18] |
CHEN JL, CUI X, ZACHAREK A, et al. Increasing Ang-1/Tie2 expression by simvastatin treatment induces vascular stabilization and neuroblast migration after stroke[J]. J Cell Mol Med, 2009, 13(7): 1348-1357. DOI:10.1111/j.1582-4934.2008.00380.x |
| [19] |
KORHONEN EA, LAMPINEN A, GIRI H, et al. Tie1 controls angiopoietin function in vascular remodeling and inflammation[J]. J Clin Investig, 2016, 126(9): 3495-3510. DOI:10.1172/JCI84923 |
 2020, Vol. 49
2020, Vol. 49