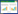文章信息
- 王一喆, 金悦, 王晓楠, 包博文, 程阳, 车晓芳, 胡雪君
- WANG Yizhe, JIN Yue, WANG Xiaonan, BAO Bowen, CHENG Yang, CHE Xiaofang, HU Xuejun
- 利用TCGA数据分析果糖二磷酸醛缩酶A对肺癌预后的预测效果
- Prognostic predictive effect of fructose-diphosphate aldolase A on lung cancer based on TCGA database analysis
- 中国医科大学学报, 2020, 49(7): 586-592
- Journal of China Medical University, 2020, 49(7): 586-592
-
文章历史
- 收稿日期:2019-05-09
- 网络出版时间:2020-06-24 10:17
2. 中国医科大学附属第一医院肿瘤内科, 辽宁省抗肿瘤药物与生物治疗重点实验室, 沈阳 110001
2. Department of Medical Oncology, The First Hospital, China Medical University, Shenyang 110001, China
恶性肿瘤已经成为仅次于心脑血管疾病的全球第二大死因,每年因恶性肿瘤死亡人数接近九千万,十年间肿瘤死亡人数增加了17.8%[1]。我国国家癌症中心最新发布的资料[2]显示居民因恶性肿瘤死亡人数占全部死亡的23.91%,且近十年来恶性肿瘤的死亡率持续上升,成为严重威胁我国人群健康的主要公共卫生问题之一。肺癌位居我国恶性肿瘤致死原因首位,早期症状不明显,多数患者确诊时已为晚期,错过了最佳的治疗时机。因此,寻找能够指导肺癌诊断和治疗的特异性生物标志物,特别是与肺癌患者总生存期相关的潜在靶点是肺癌治疗领域亟待解决的问题。
有氧糖酵解(Warburg效应)是肿瘤最主要的代谢改变之一[3]。最初认为糖酵解的主要作用是为肿瘤细胞提供能量来源,但越来越多研究[4-6]证实,与正常细胞相比,肿瘤产能模式发生改变,糖酵解的关键酶亦可作为信号分子参与调节重要的肿瘤相关信号通路,改变肿瘤细胞的增殖和侵袭能力[7]。现已明确作为诊断或治疗靶点的糖酵解相关酶包括葡萄糖转运体1(glucose transporter 1,GLUT1)[8]、乳酸脱氢酶(lactate dehydrogenase,LDH)[9]和丙酮酸激酶(pyruvate kinase,PK)[10]等。果糖二磷酸醛缩酶A(fructose-bisphosphate aldolase A,ALDOA)也是糖酵解中关键的限速酶之一,负责催化果糖-1,6-二磷酸酯可逆性转化为甘油醛-3-磷酸和磷酸二羟丙酮。既往研究表明,ALDOA在结肠癌[11]和胰腺癌[12]中高表达且与不良预后相关,但在骨肉瘤中ALDOA的表达与患者总生存期呈负相关[13],提示ALDOA虽然与肿瘤发展密切相关,但在不同肿瘤中可能发挥不同的作用。因此ALDOA对肿瘤的影响还需在更多的癌种中进行更深入研究。现有研究[14]显示,外源性补充大剂量ALDOA可以使肺癌细胞的增殖和迁移能力增加,提示ALDOA可能促进肿瘤的生长和转移。然而,关于ALDOA的表达是否影响肺癌预后、是否可以作为预后预测的生物标志物等问题尚无结论。
本研究通过癌症基因组图谱(the cancer genome atlas,TCGA)公共数据集和Kaplan-Meier Plotter在线数据库的大样本研究,探讨ALDOA在肺癌中的表达与临床病理学参数和预后的相关性,预测ALDOA可能参与调控的肿瘤相关生物通路,为ALDOA成为肺癌的生物标志物和治疗靶点提供依据。
1 材料与方法 1.1 资料来源和数据整理本研究数据来源于TCGA数据库(https//tega-data. nci.nih.gov/tcg/)中截止至2016年1月28日的肺癌样本信息,即名称为“TCGA-LUAD”的肺腺癌组织样本数据和名称为“TCGA-LUSC”的肺鳞癌组织样本数据,包括临床相关病理学参数和肿瘤组织样本的转录组测序结果(RNAseqGene)。根据临床样本信息的数据完整性以及与测序样本的匹配程度进行筛选,共329例(114例肺腺癌样本和215例肺鳞癌样本)纳入本研究。以所有肺癌患者的ALDOA表达中位值为临界值,分为ALDOA高表达组和ALDOA低表达组。利用Kaplan-Meier Plotter在线数据库(http//kmplot.com/analysis/index.php?p=service&cancer=lung)的肺癌数据集验证ALDOA(200966_x_at)对不同病理类型肺癌患者生存的影响。
1.2 方法采用基因富集分析(gene set enrichment analysis,GSEA),以所有肺癌患者的ALDOA表达中位值为临界值,将RNAseqGene数据中肺腺癌肿瘤组织样本分为ALDOA高表达组和ALDOA低表达组。从MsigDB数据库中下载肿瘤研究中常用的h.all.v6.2.symbols. gmt基因集作为参照基因集。采用GSEA 3.0版本预测ALDOA的表达水平在肺腺癌中参与的通路。GSEA软件设置按照默认参数,随机组合次数为1 000次。
1.3 统计学分析采用SPSS 16.0软件进行统计学分析和作图。采用χ2检验进行组间比较,生存分析采用KaplanMeier计算生存率,log-rank检验法进行统计学检验。P < 0.05为差异有统计学意义。GSEA中,为筛选出最有可能产生有意义的科学假设,减少假阳性风险,FDR < 0.25的基因集作为显著富集基因集。
2 结果 2.1 ALDOA基因的表达水平与肺癌患者临床病理参数的关系本研究共纳入肺癌患者329例,女126例,男203例;年龄38~86岁,年龄中位数68岁。T分期,T1期82例,T2期197例,T3期33例,T4期17例;N分期,N0期210例,N1期75例,N2期38例,N3期6例;M分期,M0期319例,M1期10例。根据TCGA数据库中肺癌样本的临床预后数据,高表达组165例,低表达组164例。ALDOA与临床病理学参数相关性的结果显示,ALDOA的表达水平与病理分型显著相关(P = 0.010),肺腺癌中ALDOA低表达比例明显高于肺鳞癌;然而,ALDOA表达与性别、年龄、T分期、N分期、M分期无显著相关性(均P > 0.05),见表 1。这些结果提示ALDOA表达在不同肺癌亚型之间差异显著,它对肺腺癌和肺鳞癌预后的影响及与2种亚型临床病理学参数的关系可能不同。
| Characteristics | n | ALDOA expression | χ2 | P | |
| Low | High | ||||
| Gender | 1.972 | 0.160 | |||
| Female | 126 | 69(54.8) | 57(45.2) | ||
| Male | 203 | 95(46.8) | 108(53.2) | ||
| Age(year) | 0.367 | 0.545 | |||
| ≤ 67 | 163 | 84(51.5) | 79(48.5) | ||
| > 67 | 166 | 80(48.2) | 86(51.8) | ||
| T stage | 0.807 | 0.369 | |||
| T1-T2 | 279 | 142(50.9) | 137(49.1) | ||
| T3-T4 | 50 | 22(44.0) | 28(56.0) | ||
| Lymphatic metastasis | 2.821 | 0.093 | |||
| No | 210 | 112(53.3) | 98(46.7) | ||
| Yes | 119 | 52(43.7) | 67(56.3) | ||
| Distant metastasis | 0.400 | 0.527 | |||
| No | 319 | 160(50.2) | 159(49.8) | ||
| Yes | 10 | 4(40.0) | 6(60.0) | ||
| Pathological classification | 6.703 | 0.010 | |||
| Adenocarcinoma | 114 | 68(59.6) | 46(40.4) | ||
| Squamous carcinoma | 215 | 96(44.7) | 119(55.3) | ||
2.2 ALDOA的表达与肺癌患者预后的相关性
利用Kaplan-Meier生存分析和log-rank检验探讨ALDOA表达对肺癌患者总生存的影响,结果如图 1所示,ALODA高表达肺癌患者的总生存期明显短于低表达患者(图 1A,P = 0.001)。由于ALDOA表达在肺腺癌和肺鳞癌2种亚型中具有统计学差异,因此又进一步在各亚型(肺腺癌和肺鳞癌)患者中分析了ALDOA表达与预后的关系。结果显示,ALDOA高表达的肺腺癌患者生存期明显缩短(图 1B,P = 0.001),而ALDOA表达对肺鳞癌患者预后无明显影响(图 1C,P = 0.135)。这些结果提示ALDOA高表达的肺癌患者(尤其是肺腺癌患者)预后差,对肺癌整体患者预后的影响可能主要来自肺腺癌患者。利用Kaplan-Meier Plotter在线数据库中扩大样本量进行验证,其结论与TCGA数据一致(图 2,肺癌P = 9.4e-12,肺腺癌P = 4.5e-11,肺鳞癌P = 0.307 2)。以上结果均提示ALDOA高表达是肺癌、特别是肺腺癌的预后不良因素。

|
| A,lung carcinoma;B,lung adenocarcinoma;C,lung squamous carcinoma. 图 1 TCGA数据库中ALDOA表达的生存分析 Fig.1 Survival analysis of ALDOA expression in TCGA database |
|
| A,lung carcinoma;B,lung adenocarcinoma;C,lung squamous carcinoma. 图 2 Kaplan-Meier Plotter数据库中ALDOA表达的生存分析 Fig.2 Survival analysis of ALDOA expression in Kaplan-Meier Plotter database |
2.3 不同肺癌亚型中ALDOA表达与临床病理参数的关系
在肺腺癌和肺鳞癌两种亚型中,分别采用χ2检验分析ALDOA与各临床病理学参数的相关性。结果如表 2所示,ALDOA表达水平与114例肺腺癌的T分期(P = 0.026)和N分期(淋巴结转移数目,P = 0.026)具有显著相关性,而与性别(P = 0.543)、年龄(P = 0.703)以及远处转移(P = 0.177)无显著相关。在T分期中,ALDOA高表达在T3~T4期中的比例更高,提示ALDOA与肺腺癌的浸润深度呈正相关。在N分期中,ALODA高表达在发生淋巴结转移组中比例更高。然而,在215例肺鳞癌患者中ALDOA的表达水平与各临床病理学参数均无关(表 3)。这些结果提示,ALDOA可能促进肺腺癌的增殖和转移;在肺腺癌中ALDOA可作为患者预后预测的生物标志物,来指导诊断和治疗。
| Characteristics | n | ALDOA expression | χ2 | P | |
| Low | High | ||||
| Gender | 0.369 | 0.543 | |||
| Female | 68 | 39(57.4) | 29(42.6) | ||
| Male | 46 | 29(63.0) | 17(37.0) | ||
| Age(year) | 0.146 | 0.703 | |||
| ≤ 67 | 57 | 35(61.4) | 22(38.6) | ||
| > 67 | 57 | 33(57.9) | 24(42.1) | ||
| T stage | 4.970 | 0.026 | |||
| T1-T2 | 99 | 63(63.6) | 36(36.4) | ||
| T3-T4 | 15 | 5(33.3) | 10(66.7) | ||
| Lymphatic metastasis | 4.951 | 0.026 | |||
| No | 71 | 48(67.6) | 23(32.4) | ||
| Yes | 43 | 20(46.5) | 23(53.5) | ||
| Distant metastasis | 1.822 | 0.177 | |||
| No | 108 | 66(61.1) | 42(38.9) | ||
| Yes | 6 | 2(33.3) | 4(66.7) | ||
| Characteristics | n | ALDOA expression | χ2 | P | |
| Low | High | ||||
| Gender | 1.401 | 0.237 | |||
| Female | 58 | 30(51.7) | 28(48.3) | ||
| Male | 157 | 67(42.7) | 90(57.3) | ||
| Age(year) | 0.356 | 0.551 | |||
| ≤ 67 | 109 | 47(43.1) | 62(56.9) | ||
| > 67 | 106 | 50(47.2) | 56(52.8) | ||
| T stage | 0.202 | 0.653 | |||
| T1-T2 | 180 | 80(44.4) | 100(55.6) | ||
| T3-T4 | 35 | 17(48.6) | 18(51.4) | ||
| Lymphatic metastasis | 0.136 | 0.712 | |||
| No | 139 | 64(46.0) | 75(54.0) | ||
| Yes | 76 | 33(43.4) | 43(56.6) | ||
| Distant metastasis | 0.039 | 0.843 | |||
| No | 211 | 95(45.0) | 116(55.0) | ||
| Yes | 4 | 2(50.0) | 2(50.0) | ||
2.4 ALDOA在肺腺癌中的相关功能基因富集分析
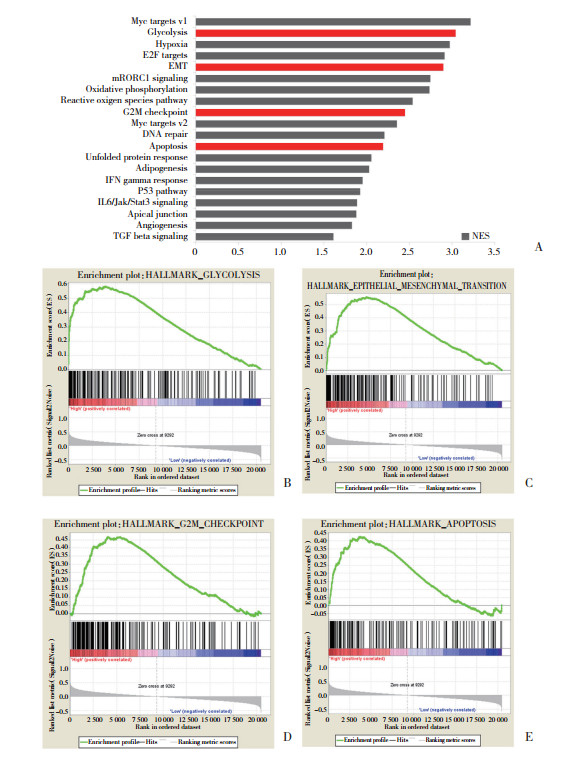
为进一步为深入了解ALDOA如何促进肺腺癌的增殖和转移,利用GSEA分析探讨ALDOA可能的相关信号通路,并在富集结果中选择FDR < 0.25的基因集作为显著富集基因集以减少多重假设导致的假阳性结果。结果显示,在ALDOA高表达的肺腺癌患者样本中共富集出39条通路,取显著富集通路中校正后富集分数(normalized enrichment score,NES)前20的相关通路进行展示(图 3A)。其中,ALDOA除与糖酵解(图 3B)等代谢相关通路密切相关外,还与上皮-间质转化(epithelial-mesenchymal transition,EMT,图 3C)、G2M检查点(图 3D)、凋亡(图 3E)等肿瘤增殖及转移通路相关。这些结果提示ALDOA可能通过调节糖代谢以及细胞周期、凋亡、EMT等通路共同促进了肺癌的增殖及转移。
|
| A,NES top 20 pathways;B,glycolysis pathway;C,epithelial-mesenchymal transition pathway;D,G2M checkpoint pathway;E,apoptosis pathway. 图 3 ALDOA高表达患者肿瘤组织中显著富集通路 Fig.3 Enriched pathways in tumor tissues of patients with high ALDOA expression |
3 讨论
通过在线数据集分析发现,肿瘤组织ALDOA高表达的肺癌患者(尤其是肺腺癌患者)预后更差,并且ALDOA高表达的患者更趋于晚期的肿瘤浸润深度和更多的淋巴结转移数目。既往研究提示,ALDOA在胃癌[15]、肝癌、胰腺癌[16]等多种肿瘤中高表达,不仅可作为肿瘤患者预后标志物[11],还可作为肿瘤获得高转移能力[12]、产生药物抵抗[17]的预测指标。在肺癌中,冯小鹏等[18]通过比较肺癌患者和非肺癌患者胸腔积液中ALDOA的表达,发现ALDOA的表达在恶性胸水中更高,且腺癌组明显高于鳞癌组和小细胞肺癌组。本结果进一步补充了ALDOA在肺癌肿瘤组织中的表达与患者预后的关系。其中,在腺癌中ALDOA的表达与患者的不良预后显著相关(P = 0.001),且ALDOA高表达的患者更容易发生淋巴结转移,而在鳞癌中并无此种相关性。这些结果提示在腺癌中ALDOA更可能参与肿瘤细胞的转移,从而影响预后。然而,根据DU等[19]报道,与肺鳞癌患者的癌旁组织比较,ALDOA在肺鳞癌肿瘤组织中明显高表达,且与更多的淋巴结转移数目和不良预后相关,这与既往研究和本结果有差异。究其原因认为:(1)该研究并未提及ALDOA在肺腺癌中的作用,无法根据同样的实验条件比较和判断在何种病理类型中ALDOA起到的作用更显著;(2)该研究中的样本较小,并且仅为肺鳞癌患者样本;(3)本研究数据基于转录组测序结果进行分析,而该研究中仅检测了患者组织中的蛋白表达水平,其RNA水平与患者预后的相关性未知。因此,在进一步的研究中尚需扩大样本量,且从多个维度确认ALODA与肺癌患者病理学参数及预后的关系。
肿瘤细胞发生转移,首先需要发生远处器官的物理易位,然而更重要的是,癌细胞在远端部位发展成转移性病变的能力[20]。肿瘤代谢的重编程为肿瘤细胞争取到了在新环境生存的有利条件。高度恶性或者发生转移的肿瘤细胞中糖酵解能力更强,提示了肿瘤代谢条件的改变与其增殖和侵袭迁移的能力存在潜在相关性。增加ALDOA的表达可加快肿瘤细胞糖酵解的过程,降低ALDOA的表达使ATP产生减少,降低细胞膜完整性[21]。除了调控糖酵解和能量代谢,ALODA也可以通过多种途径参与肿瘤的发生和发展。在低氧环境下,ALDOA可以通过调节低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)介导肿瘤细胞发生EMT,从而增强了肿瘤细胞的迁移能力[12, 22]。在肺癌中,ALDOA过表达促进乳酸释放,阻断脯氨酰羟化酶(prolyl hydroxylase,PHD)活性,并进一步增加HIF-1α稳定性[23],同时促进HIF-1α的下游靶标基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)显著上调;应用MMP-9抑制剂可以抑制ALDOA过表达上调的肺癌细胞迁移能力。本研究GSEA结果也富集到EMT通路呈正相关,与以往研究结果一致。本研究发现在该通路中主要包括层黏连蛋白2(laminin subunit gamma 2,LAMC2)、转化生长因子β1(transforming growth factor β1,TGF-β1)、整合素(integrin subunit alpha,ITGA)5、ITGA2、ITGB1等分子,因此推测ALDOA可能通过这些分子诱导肺腺癌细胞发生EMT,从而获得迁移能力。另外,利用GSEA在ALDOA高表达患者中富集出ALDOA与RAS蛋白激活剂样2(RAS protein activator Like 2,RASAL2)、DNA聚合酶α2(DNA polymerase alpha 2,POLA2)、细胞分裂周期20(cell division cycle 20,CDC20)等细胞增殖相关分子,及凋亡抑制因子(baculoviral IAP repeat containing 3,BIRC3)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)4、GPX1、超氧化物歧化酶1(superoxide dismutase 1,SOD1)等抗凋亡相关因子密切相关,提示ALDOA可能通过这些分子调控细胞周期和凋亡,从而促进肿瘤细胞快速增殖。因此拟在今后的研究中利用肺癌细胞模型及动物模型验证本研究的分析结果,以明确ALDOA促进肺腺癌增殖和转移的确切机制。
综上所述,本研究通过对TCGA数据库及Kaplan-Meier-Plotter在线数据库中的结果进行分析,明确了ALDOA对肺癌(尤其是肺腺癌)患者预后的指导意义,并通过GSEA推测ALDOA可能通过参与调控糖酵解、细胞周期、细胞凋亡等相关通路促进肿瘤的生长和迁移。深入了解ALDOA在肺癌中发挥的重要机制可为转移性肺癌治疗提供新的治疗靶点。
| [1] |
GBD CAUSES OF DEATH COLLABORATORS. Global, regional, and national age-sex specific mortality for 264 causes of death, 1980-2016:a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet, 2017, 390(10100): 1151-1210. DOI:10.1016/S0140-6736(17)32152-9 |
| [2] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [3] |
GATENBY RA, GILLIES RJ. Why do cancers have high aerobic glycolysis?[J]. Nat Rev Cancer, 2004, 4(11): 891-899. DOI:10.1038/nrc1478 |
| [4] |
HUANG F, NI M, CHALISHAZAR MD, et al. Inosine monophosphate dehydrogenase dependence in a subset of small cell lung cancers[J]. Cell Metab, 2018, 28(3): 369-382. DOI:10.1016/j.cmet.2018.06.005 |
| [5] |
CHOUDHARY KS, ROHATGI N, HALLDORSSON S, et al. EGFR signal-network reconstruction demonstrates metabolic crosstalk in EMT[J]. PLoS Comput Biol, 2016, 12(6): e1004924. DOI:10.1371/journal.pcbi.1004924 |
| [6] |
XIA SY, LIN RT, JIN LT, et al. Prevention of dietary-fat-fueled ketogenesis attenuates BRAF V600E tumor growth[J]. Cell Metab, 2017, 25(2): 358-373. DOI:10.1016/j.cmet.2016.12.010 |
| [7] |
齐丽莎, 孙保存. 肿瘤细胞适应营养缺乏环境的机制及相关研究进展[J]. 中国肿瘤临床, 2015, 42(9): 478-481. DOI:10.3969/j.issn.1000-8179.20141663 |
| [8] |
GOODWIN J, NEUGENT ML, LEE SY, et al. The distinct metabolic phenotype of lung squamous cell carcinoma defines selective vulnerability to glycolytic inhibition[J]. Nat Commun, 2017, 8: 15503. DOI:10.1038/ncomms15503 |
| [9] |
ZHANG XX, GUO MF, FAN JS, et al. Prognostic significance of serum LDH in small cell lung cancer:a systematic review with metaanalysis[J]. Cancer Biomark, 2016, 16(3): 415-423. DOI:10.3233/CBM-160580 |
| [10] |
RZECHONEK A, KAMINSKA A, MAMCZUR P, et al. Limited clinical significance of dimeric form of pyruvate kinase as a diagnostic and prognostic biomarker in non-small cell lung cancer[J]. Adv Exp Med Biol, 2017, 955: 51-57. DOI:10.1007/5584_2016_92 |
| [11] |
DAI L, PAN GD, LIU XJ, et al. High expression of ALDOA and DDX5 are associated with poor prognosis in human colorectal cancer[J]. Cancer Manag Res, 2018, 10: 1799-1806. DOI:10.2147/CMAR.S157925 |
| [12] |
JI SR, ZHANG B, LIU J, et al. ALDOA functions as an oncogene in the highly metastatic pancreatic cancer[J]. Cancer Lett, 2016, 374(1): 127-135. DOI:10.1016/j.canlet.2016.01.054 |
| [13] |
CHEN X, YANG TT, ZHOU Y, et al. Proteomic profiling of osteosarcoma cells identifies ALDOA and SULT1A3 as negative survival markers of human osteosarcoma[J]. Mol Carcinog, 2014, 53(2): 138-144. DOI:10.1002/mc.21957 |
| [14] |
冯小鹏, 孙珍贵, 汪向海. 恶性胸水中醛缩酶A的水平及其对人肺腺癌细胞增殖、迁移与侵袭能力的影响[J]. 中国病理生理杂志, 2013, 29(9): 1662-1667. DOI:10.3969/j.issn.1000-4718.2013.09.022 |
| [15] |
LONG F, CAI X, LUO W, et al. Role of aldolase A in osteosarcoma progression and metastasis:in vitro and in vivo evidence[J]. Oncol Rep, 2014, 32(5): 2031-2037. DOI:10.3892/or.2014.3473 |
| [16] |
迟鑫明, 胡军, 张丽媛, 等. 应用组织芯片技术检测果糖二磷酸醛缩酶在肝癌与胰腺癌组织中的表达[J]. 中国组织化学与细胞化学杂志, 2014, 23(6): 506-510. DOI:10.3870/zgzzhx.2014.06.006 |
| [17] |
KAWAI K, UEMURA M, MUNAKATA K, et al. Fructosebisphosphate aldolase A is a key regulator of hypoxic adaptation in colorectal cancer cells and involved in treatment resistance and poor prognosis[J]. Int J Oncol, 2017, 50(2): 525-534. DOI:10.3892/ijo.2016.3814 |
| [18] |
冯小鹏, 何松彬, 邓莺. 醛缩酶A在恶性胸腔积液中的表达水平及与癌胚抗原、乳酸脱氢酶的相关性[J]. 中国呼吸与危重监护杂志, 2014, 13(1): 70-73. DOI:10.7507/1671-6205.2014015 |
| [19] |
DU S, GUAN Z, HAO L, et al. Fructose-bisphosphate aldolase A is a potential metastasis-associated marker of lung squamous cell carcinoma and promotes lung cell tumorigenesis and migration[J]. PLoS One, 2014, 9(1): e855804. DOI:10.1371/journal.pone.0085804 |
| [20] |
CHAFFER CL, WEINBERG RA. A perspective on cancer cell metastasis[J]. Science, 2011, 331(6024): 1559-1564. DOI:10.1126/science.1203543 |
| [21] |
GRANDJEAN G, DE JONG PR, JAMES B, et al. Definition of a novel feed-forward mechanism for glycolysis-HIF1α signaling in hypoxic tumors highlights aldolase A as a therapeutic target[J]. Cancer Res, 2016, 76(14): 4259-4269. DOI:10.1158/0008-5472.CAN-16-0401 |
| [22] |
JIANG ZH, WANG XH, LI J, et al. Aldolase A as a prognostic factor and mediator of progression via inducing epithelial-mesenchymal transition in gastric cancer[J]. J Cell Mol Med, 2018, 22(9): 4377-4386. DOI:10.1111/jcmm.13732 |
| [23] |
CHANG YC, CHAN YC, CHANG WM, et al. Feedback regulation of ALDOA activates the HIF-1alpha/MMP9 axis to promote lung cancer progression[J]. Cancer Lett, 2017, 403: 28-36. DOI:10.1016/j.canlet.2017.06.001 |
 2020, Vol. 49
2020, Vol. 49