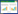文章信息
- 李宇恒, 邓诚思, 关爱伟, 宋晓宇, 冯艳玲, 关奕, 曹流
- LI Yuheng, DENG Chengsi, GUAN Aiwei, SONG Xiaoyu, FENG Yanling, GUAN Yi, CAO Liu
- 利用CRISPR/Cas9技术建立PTEN敲除的人子宫内膜腺癌细胞模型及其功能研究
- CRISPR/Cas9-based PTEN knockout in human endometrial adenocarcinoma cells
- 中国医科大学学报, 2020, 49(7): 582-585
- Journal of China Medical University, 2020, 49(7): 582-585
-
文章历史
- 收稿日期:2019-10-11
- 网络出版时间:2020-06-24 10:19
张力蛋白同源的第10号染色体缺失的磷酸酶(phosphatase and tensin homology deleted on chromosome ten,PTEN)是一个具有双重特异性磷酸酶活性的抑癌基因。PTEN通过调控过磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,Pl3K)/蛋白激酶B(protein kinase B,PKB)和丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的平衡,参与细胞凋亡、细胞周期阻滞、细胞迁移等信号通路,发挥其抑癌功能[1]。PTEN表达的缺失可见于多种肿瘤,可能与癌症的进展和转移有关[2]。
常间回文重复序列丛集/常间回文重复序列丛集关联蛋白9(clustered regulatory interspaced short palindromic repeat/Cas9,CRISPR/Cas9)系统是一种在小向导RNA(small guide RNA,sgRNA)的指导下在基因组水平上对目的基因DNA序列进行改造的定点编辑技术,可实现目的基因的完全敲除。自目标设计始,基因修饰可在1~2周内完成,修饰的克隆细胞株可在2~3周内获得[3]。CRISPR/Cas9因其高效率和高精度得到了广泛的关注。本研究拟利用CRISPR/Cas9系统建立PTEN基因靶向敲除细胞株,探讨PTEN对子宫内膜癌细胞生物学功能的影响。
1 材料与方法 1.1 细胞培养和主要试剂 1.1.1 细胞培养用含10%胎牛血清(中国Clark公司)、1%青霉素和链霉素(中国GENVIEW公司)的DMEM培养基(德国BI公司),在37 ℃、5%CO2培养箱内培养人子宫内膜腺癌细胞株KLE(美国ATCC公司),细胞呈贴壁生长。
1.1.2 主要试剂DL2000 DNA Marker(日本TaKaRa公司),BBSⅠ酶(美国Sigma公司),T4 DNA连接酶(美国Sigma公司),DH5α感受态E.coli(日本TaKaRa公司),PrimeSTAR GXL DNA Polymeres PCR试剂盒(日本TaKaRa公司),Promega DNA纯化试剂盒(美国CST公司),质粒提取试剂盒(中国TIANGEN公司),Biobest转染试剂(美国CST公司),PTEN、LC3、P62抗体(美国CST公司),CCK-8(美国Bimake公司)。
1.2 puro-cas9-PTEN-sgRNA质粒构建 1.2.1 sgRNA的设计与合成根据sgRNA设计网站(http//tools.genome-engineering.org),对PTEN基因1个外显子序列进行分析,筛选出评分较高的sgRNA序列(靶点序列sgRNA1,5’-caccgTTGAGAGTTGAG CCGCTGTG-3’;sgRNA2,5’-caccgTCATGGCTGCAG CTTCCGAG-3’),由生工生物工程(上海)股份有限公司合成。
1.2.2 sgRNA的磷酸化与退火磷酸化体系包含100 µmol/L Oligo-gRNA-F 1 µL,100 µmol/L Oligo-gRNA-R 1 µL,10×kinase buffer A 1 µL,100 mmol/L ATP 0.5 µL,T4 PNK 0.5 µL,ddH2O 6 µL,共10 µL体系,置于37 ℃30 min。退火条件95 ℃5 min,75 ℃5 min,55 ℃5 min,35 ℃5 min。获得双链gRNA。
1.2.3 sgRNA载体构建将双链gRNA与BBSⅠ酶切纯化后的载体混合(质量比1 ︰ 3)连接。T4 DNA连接酶16 ℃连接16 h。取连接产物,DH5α感受态E.coli转化,用氨苄抗性筛选阳性克隆,挑取单克隆后摇菌,取菌液送生工生物测序,确定质粒构建成功。
1.3 构建PTEN稳定敲除的人子宫内膜癌细胞株 1.3.1 人子宫内膜癌细胞KLE的转染以及加药筛选接种KLE细胞至6 cm培养皿中,37 ℃培养24 h后,按照说明书用Biobest转染试剂共转染puro-cas9- PTEN-sgRNA1和puro-cas9-PTEN-sgRNA2。4~6 h后换为10%细胞培养液培养,72 h后传代并将培液换成带有嘌呤霉素(1 µg/mL)的10%DMEM培养基筛选,5 d后,细胞稀释接种于96孔板中,筛选单克隆继续扩大培养。
1.3.2 PTEN稳定敲除细胞株的鉴定(1)根据美国国家生物技术信息中心数据库PTEN基因组的序列以及sgRNA切点的位置设计引物(F,CTGGAGCGG GGGGGAGAAGC;R,TCAGACTTTTGTAATTTGTG),由生工生物工程(上海)股份有限公司合成。(2)提取单克隆细胞株的DNA,以DNA为模板,利用合成的引物进行PCR,PCR反应体系包括DNA 200 ng,5×PrimeSTAR buffer 10 µL,dNTP(2.5 mmol/L)4 µL,Primer-F(10 µmol/L)1 µL,Primer-R(10 µmol/L)1 µL,PrimeSTAR GXL DNA polymeres 0.5 µL,加ddH2O至50 µL。PCR反应条件如下,98 ℃ 5min;98 ℃ 20 s,56 ℃ 20 s,72 ℃ 60 s,35个循环;72 ℃ 7 min;4 ℃ 10 min。(3)通过酚氯仿–异戊醇/乙醇沉淀方法纯化获得的目的基因,取40 µL PCR产物,加入160 µL 1×TE buffer(pH8.0)混匀后,加入酚氯仿–异戊醇200 µL,剧烈震荡,离心(14 000 r/min)20 min,取上清,加入20 µL 3 mol/L醋酸钠、400 µL无水乙醇混匀后,离心(14 000 r/min)15 min,弃上清,加500 µL 70%乙醇混匀,离心(14 000 r/min)15 min,弃上清,加18 µL ddH2O溶解纯化产物。(4)取纯化产物加2 µL NEB2 buffer退火(75 ℃5min,55 ℃5 min,35 ℃5 min,20 ℃5 min),退火产物加0.5 µL T7E1,于37 ℃酶切1 h,用2%琼脂糖凝胶电泳分离观察酶切情况。
1.4 Western blotting将经筛选获得的细胞系扩大培养后,收集对照野生型子宫内膜腺癌细胞和PTEN敲除的KO细胞,用RIPA细胞裂解缓冲液提取总蛋白,BCA蛋白试剂盒定量。行SDS-PAGE电泳并将蛋白转移到PVDF膜上,5%脱脂牛奶室温封闭1 h,4 ℃摇床孵育PTEN、tubulin、P62、LC3抗体过夜,PBST缓冲液洗膜3次(10 min/次),二抗室温孵育1 h,PBST缓冲液洗膜3次(10 min/次),显影检测。
1.5 CCK-8细胞活性检测于48孔培养板中接种细胞悬液(50 000/孔),培养24 h后,每孔加入20 µL CCK-8溶液。培养箱内孵育2 h,酶标仪测定450 nm的吸光度值。
1.6 统计学分析采用SPSS 16.0软件进行统计学分析。计量资料用x±s表示,采用双侧t检验进行比较。P < 0.05为差异有统计学意义。
2 结果 2.1 sgRNA设计结果在NCBI数据库获取人源PTEN的cDNA,根据实验目的选择目标外显子,通过网站(http//tools. genome-engineering.org)设计并预测sgRNA效率,并初步选择出得分最高的sgRNA。见图 1。
|
| 图 1 PTEN基因sgRNA设计示意 Fig.1 Design of PTEN gene sgRNA |
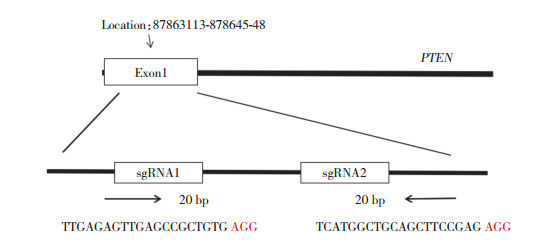
2.2 T7E1酶切实验结果
T7E1酶切实验结果表明,CRISPR/Cas9系统对KLE细胞基因组中的PTEN切割成功。见图 2。
|
| 1,wild type;2,PTEN-KO. 图 2 T7E1酶切实验结果 Fig.2 Results of T7E1 enzyme digestion |
2.3 等位基因敲除后蛋白表达情况
Western blotting结果显示,进行基因敲除的细胞系PTEN蛋白表达量明显降低,进一步证明了基因敲除成功。见图 3。

|
| 1,wild type;2,PTEN-KO. 图 3 PTEN敲除后细胞内PTEN和自噬相关因子检测 Fig.3 Detection of intracellular PTEN and autophagy related factors after PTEN knockout |
2.4 自噬相关因子LC3、P62蛋白的表达水平
Western blotting结果显示,PTEN敲除后,细胞内自噬相关因子P62的表达增加,LC3Ⅰ型向Ⅱ型的转化减少,提示细胞自噬受到抑制。见图 3。
2.5 CCK-8细胞活性检测CCK-8细胞活性检测结果显示,PTEN敲除的子宫内膜腺癌细胞活性高于对照组野生型子宫内膜腺癌细胞,PTEN敲除的细胞增殖明显加快,差异有统计学意义(P < 0.05)。见图 4。
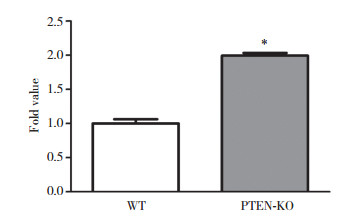
|
| *P < 0.000 1 vs WT. WT,wild type 图 4 CCK-8细胞活性检测结果 Fig.4 Results of CCK-8 |
3 讨论
本研究利用CRISPR/Cas9技术成功构建了PTEN敲除的人子宫内膜腺癌细胞模型。CRISPR/ Cas9基因编辑系统作为第三代基因编辑技术,促进基因组中特定位点的靶向DNA发生双链断裂后,通过非同源性末端接合或同源介导修复方式刺激基因组重新编辑,实现单个基因、位点的特异性突变,从而使特定基因完全丧失生物学功能[4-5]。与锌指蛋白、转录激活因子样效应因子核酸酶技术相比,CRISPR/Cas9的优势在于易操作、效率高、周期短、工作量小、成本低[6-9]。但CRISPR/Cas9技术也存在一定限制,即Cas9通过sgRNA上的20-nt引导序列定位于特定的基因组位点,在靶标上具有作用范围,同时也具有潜在的脱靶突变[10-11]。本研究设计并选取了多个sgRNA序列,经过验证最终确定了最佳sgRNA序列。此外,由于CRISPR/Cas9质粒需要表达的Cas9蛋白较其他载体大,且具有一定的细胞毒性[12],对转染及后续的筛选和单克隆培养造成了一定的困难,导致实验周期长于预期。
PTEN是人类癌症中最常见的突变抑癌基因之一,在乳腺癌、前列腺癌、子宫内膜癌、胶质母细胞瘤等多种人类癌症中均可见突变[13]。细胞自噬是一种重要的细胞学功能,在正常的生理过程中起着“管家”的作用,细胞通过自噬行为清除受损的细胞器和错误折叠的蛋白质,从而参与生长和衰老的调控。自噬调节的缺陷在许多疾病中起重要作用,包括癌症、神经退行性疾病、病原体感染和代谢性疾病。本研究发现,在人子宫内膜腺癌细胞中敲除PTEN明显抑制了细胞自噬,并介导了人子宫内膜腺癌细胞增殖加快。
综上所述,本研究发现,PTEN的敲除使子宫内膜腺癌细胞自噬受到抑制,导致癌细胞增殖加快。因此,探讨PTEN缺失导致的细胞自噬异常,对于子宫内膜癌的研究与治疗具有重要的意义。
| [1] |
孙健玮, 郑立民. 抑癌基因PTEN的研究进展[J]. 中国当代医药, 2019, 26(13): 19-22. |
| [2] |
ZHAO YS, ZHENG RY, LI J, et al. Loss of phosphatase and tensin homolog expression correlates with clinicopathological features of non-small cell lung cancer patients and its impact on survival:a systematic review and meta-analysis[J]. Thorac Cancer, 2017, 8(3): 203-213. DOI:10.1111/1759-7714.12425 |
| [3] |
RAN FA, HSU PD, WRIGHT J, et al. Genome engineering using the CRISPR-Cas9 system[J]. Nat Protoc, 2013, 8(11): 2281-2308. DOI:10.1038/nprot.2013.143 |
| [4] |
杨帆, 李寅. 新一代基因组编辑系统CRISPR/Cpf1[J]. 生物工程学报, 2017, 33(3): 361-371. DOI:10.13345/j.cjb.170029 |
| [5] |
GIBSON GJ, YANG MZ. What rheumatologists need to know about CRISPR/Cas9[J]. Nat Rev Rheumatol, 2017, 13(4): 205-216. DOI:10.1038/nrrheum.2017.6 |
| [6] |
REYON D, TSAI SQ, KHAYTER C, et al. FLASH assembly of TALENs for high-throughput genome editing[J]. Nat Biotechnol, 2012, 30(5): 460-465. DOI:10.1038/nbt.2170 |
| [7] |
SANJANA NE, CONG L, ZHOU Y, et al. A transcription activatorlike effector toolbox for genome engineering[J]. Nat Protoc, 2012, 7(1): 171-192. DOI:10.1038/nprot.2011.431 |
| [8] |
LI X, GAO M, CHOI JM, et al. Clustered, regularly interspaced short palindromic repeats (CRISPR)/Cas9-coupled affinity purification/mass spectrometry analysis revealed a novel role of neurofibromin in mTOR signaling[J]. Mol Cell Proteomics, 2017, 16(4): 594-607. DOI:10.1074/mcp.M116.064543 |
| [9] |
CANVER MC, BAUER DE, DASS A, et al. Characterization of genomic deletion efficiency mediated by clustered regularly interspaced short palindromic repeats (CRISPR)/Cas9 nuclease system in mammalian cells[J]. J Biol Chem, 2017, 292(6): 2556. DOI:10.1074/jbc.A114.564625 |
| [10] |
CONG L, RAN FA, COX D, et al. Multiplex genome engineering using CRISPR/cas systems[J]. Science, 2013, 339(6121): 819-823. DOI:10.1126/science.1231143 |
| [11] |
HSU PD, SCOTT DA, WEINSTEIN JA, et al. DNA targeting specificity of RNA-guided Cas9 nucleases[J]. Nat Biotechnol, 2013, 31(9): 827-832. DOI:10.1038/nbt.2647 |
| [12] |
MORGENS DW, WAINBERG M, BOYLE EA, et al. Genomescale measurement of off-target activity using Cas9 toxicity in highthroughput screens[J]. Nat Commun, 2017, 8: 15178. DOI:10.1038/ncomms15178 |
| [13] |
CHANG H, CAI ZY, ROBERTS TM. The mechanisms underlying PTEN loss in human tumors suggest potential therapeutic opportunities[J]. Biomolecules, 2019, 9(11): E713. DOI:10.3390/biom9110713 |
 2020, Vol. 49
2020, Vol. 49