文章信息
- 王淑妹, 赵丽, 熊鹰, 张晓维, 梁国新, 耿文清
- WANG Shumei, ZHAO Li, XIONG Ying, ZHANG Xiaowei, LIANG Guoxin, GENG Wenqing
- TRAB结构域包含蛋白2B在人类免疫缺陷病毒复制中的作用
- Role of TRAB domain-containing protein 2B in human immunodeficiency virus replication
- 中国医科大学学报, 2020, 49(7): 577-581
- Journal of China Medical University, 2020, 49(7): 577-581
-
文章历史
- 收稿日期:2019-11-26
- 网络出版时间:2020-06-24 16:16
人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染可诱导宿主固有免疫应答并进一步产生适应性免疫应答,宿主免疫系统长期、持续以及过度的活化进而造成的免疫系统崩溃是引起获得性免疫缺陷综合征(acquired immunodeficiencysyndrome,AIDS)的主要原因。宿主病毒限制性因子作为固有免疫系统的重要成员,是人体针对病毒病原体入侵的第一道防线[1-4]。目前已报道的HIV-1限制因子主要包括三结构域5α(tripartite motif 5α,TRIM5α)、SAM和HD结构域包含蛋白1(sterile alpha motif and histidine-aspartic acid domain containing protein 1,SAMHD1)、骨髓基质抗原-2(bone marrow stromal antigen 2,BST-2)、黏液病毒抗性蛋白2(myxovirus resistance protein 2,MX2)和脂蛋白B mRNA催化多肽3G(apolipoprotein B mRNA-editing enzyme catalytic polypeptide-like 3G,APOBEC3G)等[5],均能在病毒复制周期的不同阶段通过不同机制不同程度地抑制病毒复制。随着越来越多的限制因子被发现,识别和明确这些限制因子的抗病毒机制有助于开发其作为HIV治疗靶点的潜力[6]。细胞膜金属蛋白酶TRAB结构域包含蛋白2B(TRAB domain-containing protein 2B,TRABD2B)属于细胞膜金属蛋白酶家族[7],该家族成员主要包括TRABD2A和TRABD2B。最新研究[8]表明,TRABD2A在HIV-1感染中能够发挥抗病毒功能,通过降解宿主细胞膜上的病毒结构蛋白Gag进而抑制HIV-1复制,而TRABD2A和TRABD2B同源基因在脊椎动物中高度保守[9],提示TRABD2B可能同样具有抗病毒功能。本研究旨在探讨TRABD2B对HIV复制的影响。
1 材料与方法 1.1 材料 1.1.1 试剂胎牛血清、100 U/mL青霉素和100 mg/mL链霉素(美国Gibco公司);Lipofectamine 3000试剂、TRIzol试剂和siRNA(美国Invitrogen公司);jetPRIME转染试剂盒(法国PolyPlus公司);荧光素酶活性检测试剂盒(美国Promega公司);HIV-1 p24抗原检测试剂盒(美国ABL公司);逆转录试剂盒和TB GreenTM Premix Ex TaqTMⅡ(日本TaKaRa公司);人CD4+ T细胞负选试剂盒和人单核细胞阳性分选试剂盒(美国Stemcell公司);重组人粒细胞-巨噬细胞集落刺激因子GM-CSF(美国R & D公司);pHIV-1NL4-3、pHIV-1NL4-3-Luc、pHIV-2st和pHIVmac239病毒质粒均由本实验室保存,pTRABD2B-GFP、pMock和pVSV-G表达质粒均购自上海和元生物技术公司。
1.1.2 仪器Tecan Spark酶标仪(瑞士Tecan公司);高速离心机和普通PCR仪(德国Eppendorf公司);QuantStudioTM 3实时定量PCR仪(美国ABI公司);Evos FL Auto倒置荧光显微镜和CO2培养箱(美国Thermo Fisher Scientific公司)。
1.2 研究对象招募中国医科大学附属第一医院健康志愿者3例,年龄23~30岁,其中,男1例,女2例,近1个月来无细菌或病毒性感染,每例采集全血100 mL。
1.3 研究方法 1.3.1 原代细胞的分离和培养采用Ficoll-Hypaque密度梯度离心法分离人外周血单个核细胞(PBMCs),试剂盒分选CD4+T细胞和CD14单核细胞。用50 ng/mL GM-CSF诱导培养单核细胞7 d以获得人单核细胞来源的巨噬细胞(monocyte derived macrophages,MDM)。
1.3.2 细胞系培养人宫颈癌细胞系TZM-bl和人胚肾293T细胞系于DMEM完全培养基(美国HyClone公司)中培养,内含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素,置于37 ℃、含5% CO2的培养箱中培养。
1.3.3 HIV-1假病毒包装实验采用jetPRIME转染试剂盒,在人胚肾293T细胞中共转pHIV-1NL4-3-Luc和pVSV-G表达质粒。48 h后收集细胞培养上清,0.45 μm滤器过滤,ELISA法检测HIV-1 p24抗原,分装后置于-80 ℃保存。
1.3.4 ELISA法检测HIV-1 p24抗原收集细胞培养上清,采用HIV-1 p24抗原检测试剂盒检测p24抗原。按试剂说明书稀释标准品,并稀释样品至适宜浓度。反应板中各孔均加入裂解液25 μL,于每孔中加入已稀释的标准品、样品、阳性和阴性对照各100 μL,封板,37 ℃孵育1 h;wash buffer洗板,重复5次,最后1次拍净孔内残余的液体;除空白孔外,所有孔中均加入酶标二抗100 μL,封板,37 ℃孵育30 min;wash buffer洗板,重复5次,最后1次拍干孔内残余的液体;所有孔中加入显色液A和显色液B各50 μL,封板,37 ℃孵育30 min;所有孔中加入50 μL终止液,设置酶标仪波长为450 nm进行检测。
1.3.5 小干扰RNA(small intefering RNA,siRNA)干扰实验实验组分为阴性对照组(siCtrl)和siRNA干扰组(siTRABD2B-1、siTRABD2B-2)。采用Lipofectamine 3000转染293T细胞,6 h后细胞换液,继续培养24 h后感染p24为10 ng的HIV-1NL4-3-Luc(VSVG)假病毒,24 h后检测293T细胞内的荧光素酶活性。
1.3.6 Total RNA提取及实时PCR分析采用TRIzol试剂从细胞中提取总RNA,将1μg纯化的RNA用DNase I(Invitrogen公司)在室温下处理15 min去除DNA并逆转录为cDNA。PCR反应体系:TB GreenTM Premix Ex TaqTM Ⅱ 12.5 μL,上、下游引物各0.8 μL,ddH2O 8.9 μL,模板2 μL。PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火和延伸30 s,共40个循环;用2-ΔΔCt方法计算目的基因相对表达量。所用引物序列如下:TRABD2B上游引物序列5’-AACTCCTTCCTGTGGACGATT-3’,下游引物序列5’-TCCGGGATGAATGCCCAGAC-3’;GAPDH上游引物序列5’-AATGACCCCTTCATTGAC-3’,下游引物序列5’-TCCACGACGTACTCAGCGC-3’。
1.3.7 293T细胞中TRABD2B过表达实验采用jetPRIME转染试剂转染293T细胞,在293T细胞中共转人pTRABD2B-GFP表达质粒、pMock对照质粒和pHIV-1NL4-3、pHIV-2st和pHIVmac239病毒质粒,或共转不同种属pTRABD2B-GFP表达质粒、pMock对照质粒和pHIV-1NL4-3病毒质粒,不同种属pTRABD2B-GFP主要包括人、猕猴属、鸡、斑马鱼、鼠和非洲蟾蜍属。转染6 h后细胞换液,48 h后收集上清感染TZM-bl细胞,24 h后裂解细胞取上清并加入荧光素酶底物,酶标仪检测荧光素酶活性。
1.4 统计学分析采用SPSS 20.0和GraphPad Prism 7.0软件进行统计学分析。计量资料采用x±s表示,组间比较采用Student’t检验。多组进行比较时,采用单因素方差分析(one-way ANOVA),P < 0.05为差异有统计学意义。
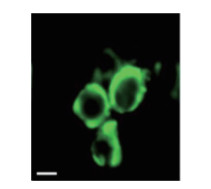
2 结果 2.1 TRABD2B在细胞中的表达和定位实时PCR结果显示,293T细胞中TRABD2B mRNA表达水平高于CD4+ T细胞、单核细胞和MDM细胞,差异有统计学意义[CD4+ T细胞(0.09±0.07),单核细胞(0.10±0.07),MDM(0.27±0.04),293T细胞(5.38±1.05),均P < 0.001]。人pTRABD2B-GFP表达质粒转染293T细胞并通过荧光显微镜观察TRABD2B在293T细胞中的定位,结果显示,TRABD2B主要分布于293T细胞的胞膜。见图 1。
|
| 图 1 TRABD2B在细胞中的定位×100 Fig.1 Localization of TRABD2B in cells ×100 |
2.2 内源性TRABD2B对HIV-1NL4-3复制的影响
siRNA下调293T细胞中内源性TRABD2B的表达并感染p24为10 ng的HIV-1NL4-3-Luc(VSVG)假病毒,检测胞内荧光素酶活性。实时PCR法验证敲减效率。siTRABD2B组293T细胞中TRABD2B mRNA表达水平与对照组siCtrl相比,差异有统计学意义[siTRABD2B-1组(0.28±0.07),siTRABD2B-2组(0.38±0.09),siCtrl组(1.00±0.34),均P < 0.001]。siTRABD2B组细胞中的荧光素酶活性与对照组siCtrl相比,差异有统计学意义[siTRABD2B-1(38 963.700± 20 000.00),siTRABD2B-2(34 236.83±5181.48),siCtrl组(1 629.84±543.72),均P < 0.05],提示敲减293T细胞中的TRABD2B可导致病毒复制增加,即内源性TRABD2B能够抑制HIV-1NL4-3复制。
2.3 人TRABD2B对HIV-1NL4-3、HIV-2st和SIVmac239复制的影响在293T细胞中将人pTRABD2B-GFP/pMock表达质粒和pHIV-1NL4-3/pHIV-2st/pHIVmac239病毒质粒按不同比例共转染,48 h后收集细胞培养上清感染TZMbl细胞,以相对荧光单位(relative luminescence units,RLU)表示TZM-bl细胞的荧光检测值。结果显示,与Mock对照组相比,转染不同比例TRABD2B后各组TZM-bl细胞中的荧光素酶活性下降,差异均有统计学意义(均P < 0.05),提示人TRABD2B可不同程度地抑制HIV-1NL4-3、HIV-2st和SIVmac239的复制。见表 1。
| Group | HIV-1NL4-3 | HIV-2st | SIVmac239 | ||||||||
| 0.5 μg | 1.0 μg | 2.0 μg | 0.5 μg | 1.0 μg | 2.0 μg | 0.5 μg | 1.0 μg | 2.0 μg | |||
| Mock | 17 031 376.00±4 041 451.90 | 19 821 375.00±5 539 731.90 | 9 498 029.00±721 092.40 | 78 348.67±11 895.52 | 78 015.33±4 593.84 | 65 982.01±11 532.56 | 901 142.33±78 601.31 | 923 038.67±145 716.62 | 733 063.67±141 891.98 | ||
| TRABD2B | 532 449.67±202 072.591) | 372 779.67±164 520.421) | 121 163.33±32 145.501) | 8 915.00±429.571) | 4 915.00±1 275.752) | 3 295.33±1 200.041) | 71 468.00±21 517.432) | 45 134.67±16 072.751) | 17 801.33±5 131.602) | ||
| 1)P < 0.05;2)P < 0.01 vs mock group. | |||||||||||
2.4 不同种属TRABD2B对HIV-1NL4-3复制的影响
在293T细胞中共转不同种属pTRABD2B/pMock表达质粒和pHIV-1NL4-3病毒质粒。结果显示,与Mock对照组相比,转染不同种属TRABD2B组荧光素酶活性均降低,差异有统计学意义(均P < 0.001),且来源于人的TRABD2B组荧光素酶活性降低最明显。见表 2。
| Group | HIV-1NL4-3 |
| Mock | 97 146.33±6 290.50 |
| Human | 1 548.00±450.301) |
| Macaca | 4 356.33±2 275.581) |
| Chicken-201 | 3 714.00±1 160.701) |
| Chicken-202 | 6 024.01±2 320.301) |
| Zebrafish | 5 224.00±2 589.711) |
| Mouse | 5 625.33±2 339.931) |
| Xenopus | 21 268.00±9 808.201) |
| P < 0.001 vs mock group. | |
3 讨论
HIV-1是引起AIDS的主要病原体。目前对HIV/ AIDS的治疗主要是高效抗逆转录病毒疗法,由于长期治疗产生的药物毒性及耐药性,仍然不能彻底治愈AIDS[10]。因此,了解病毒与宿主相互作用的机制,寻找抑制病毒复制的宿主限制因子,将其作为治疗靶点对抗病毒治疗尤为重要。TRABD2B作为金属蛋白酶,主要分布于人体肾脏、心脏和脂肪组织等,研究[11]发现在多种癌症组织中,TRABD2B的表达水平发生了改变。此外,TRABD2B还通过Wnt信号转导通路调节器官发生和胚胎发育。由于TRABD2A在HIV感染中能够发挥抗病毒功能,而TRABD2B作为TRABD2A的家族同源物是否具有抗病毒功能尚不清楚。
本研究首先对TRABD2B在人原代细胞及细胞系中的表达进行了检测。结果显示,TRABD2B主要表达于293T细胞,且荧光显微镜观察到TRABD2B主要定位于293T细胞的胞膜。使用siRNA下调293T细胞中TRABD2B mRNA表达并感染HIV-1NL4-3-Luc(VSVG)假病毒,结果显示下调293T细胞中TRABD2B的表达可导致胞内荧光素酶活性增加,推测TRABD2B可能具有抗病毒功能。在293T细胞中共转人pTRABD2B/ pMock和pHIV-1NL4-3、pHIV-2st及pHIVmac239,结果显示TRABD2B组荧光素酶表达下降,表明HIV-1NL4-3、HIV-2 st和SIVmac239复制减少,进一步提示TRABD2B能够在HIV-1NL4-3、HIV-2st和SIVmac239感染中发挥抗病毒功能。以上结果证实了对TRABD2B作为抗病毒因子的推测,TRABD2B作为金属蛋白酶家族的成员,同TRABD2A一样,能够抑制HIV复制,为治疗HIV/ AIDS开辟了新途径。
HIV的宿主为人类和灵长类动物,灵长类动物是人类重大疾病研究的首选实验动物,其研究成果更容易实现临床转化。HIV最初由黑猩猩或乌白眉传染给人类,慢病毒跨物种传播表明病毒在宿主中的复制必须适应宿主中的物种特异性限制因子。已有研究[12-15]表明TRIM家族的蛋白通过物种依赖的方式抑制病毒复制。由于正向选择,宿主限制因子在HIV感染的天然宿主中抗病毒作用较弱,但在跨物种传播中可发挥强大的抑制作用[16],而TRABD2B在人类、猿猴和鼠等多个物种表达,其在脊椎动物中具有较高的物种同源性,提示不同种属TRABD2B在进化过程中其抗病毒功能可能保留了共性。本研究结果显示,不同种属的TRABD2B均可以抑制HIV-1NL4-3复制,由于人类对病毒传播、发病机制研究的许多进展可归功于动物模型的使用,构建HIV/AIDS灵长类动物模型是科学家们追求的目标,故不同种属TRABD2B在HIV-1感染中抗病毒功能的保守性为动物模型的构建提供了可能性。
综上所述,本研究首次探讨了人TRABD2B作为一种抗病毒因子能够显著抑制HIV-1、HIV-2和SIV的复制,同时发现不同种属的TRABD2B对HIV-1复制也有不同程度的抑制作用,为抗病毒治疗新靶点的开发积累了资料。作为金属蛋白酶,TRABD2B功能特性及发挥抗病毒作用的机制目前尚未阐明,有待进一步研究。
| [1] |
BLANCO-MELO D, VENKATESH S, BIENIASZ PD. Intrinsic cellular defenses against human immunodeficiency viruses[J]. Immunity, 2012, 37(3): 399-411. DOI:10.1016/j.immuni.2012.08.013 |
| [2] |
SIMON V, BLOCH N, LANDAU NR. Intrinsic host restrictions to HIV-1 and mechanisms of viral escape[J]. Nat Immunol, 2015, 16(6): 546-553. DOI:10.1038/ni.3156 |
| [3] |
ABDEL-MOHSEN M, RAPOSO RA, DENG XT, et al. Expression profile of host restriction factors in HIV-1 elite controllers[J]. Retrovirology, 2013, 10(1): 106. DOI:10.1186/1742-4690-10-106 |
| [4] |
ZAUNDERS J, VAN BOCKEL D. Innate and adaptive immunity in long-term non-progression in HIV disease[J]. Front Immunol, 2013, 4: 95. DOI:10.3389/fimmu.2013.00095 |
| [5] |
HARRIS RS, HULTQUIST JF, EVANS DT. The restriction factors of human immunodeficiency virus[J]. J Biol Chem, 2012, 287(49): 40875-40883. DOI:10.1074/jbc.R112.416925 |
| [6] |
GHIMIRE D, RAI M, GAUR R. Novel host restriction factors implicated in HIV-1 replication[J]. J Gen Virol, 2018, 99(4): 435-446. DOI:10.1099/jgv.0.001026 |
| [7] |
ZHANG XJ, MACDONALD BT, GAO HL, et al. Characterization of tiki, a new family of wnt-specific metalloproteases[J]. J Biol Chem, 2016, 291(5): 2435-2443. DOI:10.1074/jbc.M115.677807 |
| [8] |
LIANG GX, ZHAO L, QIAO Y, et al. Membrane metalloprotease TRABD2A restricts HIV-1 progeny production in resting CD4+ T cells by degrading viral Gag polyprotein[J]. Nat Immunol, 2019, 20(6): 711-723. DOI:10.1038/s41590-019-0385-2 |
| [9] |
REIS AH, MACDONALD BT, FEISTEL K, et al. Expression and evolution of the Tiki1 and Tiki2 genes in vertebrates[J]. Int J Dev Biol, 2014, 58(5): 355-362. DOI:10.1387/ijdb.140106ja |
| [10] |
HO YC, SHAN L, HOSMANE N, et al. Replication-competent noninduced proviruses in the latent reservoir increase barrier to HIV-1 cure[J]. Cell, 2013, 155(3): 540-551. DOI:10.1016/j.cell.2013.09.020 |
| [11] |
ZHANG XJ, ABREU JG, YOKOTA C, et al. Tiki1 is required for head formation via Wnt cleavage-oxidation and inactivation[J]. Cell, 2012, 149(7): 1565-1577. DOI:10.1016/j.cell.2012.04.039 |
| [12] |
GOFF SP. Retrovirus restriction factors[J]. Mol Cell, 2004, 16(6): 849-859. DOI:10.1016/j.molcel.2004.12.001 |
| [13] |
LUBAN J. Cyclophilin A, TRIM5, and resistance to human immunodeficiency virus type 1 infection[J]. J Virol, 2007, 81(3): 1054-1061. DOI:10.1128/JVI.01519-06 |
| [14] |
NISOLE S, STOYE JP, SAÏB A. TRIM family proteins:retroviral restriction and antiviral defence[J]. Nat Rev Microbiol, 2005, 3(10): 799-808. DOI:10.1038/nrmicro1248 |
| [15] |
SONG B, JAVANBAKHT H, PERRON M, et al. Retrovirus restriction by TRIM5α variants from old world and new world Primates[J]. J Virol, 2005, 79(7): 3930-3937. DOI:10.1128/JVI.79.7.3930-3937.2005 |
| [16] |
COREN LV, TRIVETT MT, JAIN S, et al. Potent restriction of HIV-1 and SIVmac239 replication by African green monkey TRIM5α[J]. Retrovirology, 2015, 12(1): 11. DOI:10.1186/s12977-015-0137-9 |
 2020, Vol. 49
2020, Vol. 49