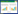文章信息
- 康乐, 陶雅军, 张媛媛, 陈英杰, 方明
- KANG Le, TAO Yajun, ZHANG Yuanyuan, CHEN Yingjie, FANG Ming
- microRNA-34a靶向ZEB1抑制三阴性乳腺癌细胞血管生成拟态
- microRNA-34a inhibits vasculogenic mimicry in triple-negative breast cancer cells by targeting ZEB1
- 中国医科大学学报, 2020, 49(5): 424-428
- Journal of China Medical University, 2020, 49(5): 424-428
-
文章历史
- 收稿日期:2019-09-11
- 网络出版时间:2020-05-07 9:53
2. 大连医科大学附属第一医院肾内科, 辽宁 大连 116011
2. Department of Nephropathy, The First Affiliated Hospital of Dalian Medical University, Dalian 116011, China
乳腺癌是威胁全球女性生命最主要的癌症之一。三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种具有特殊分子表型的乳腺癌亚型,其恶性度高且易发生转移,缺乏有效的治疗手段,患者预后差[1]。因而,亟需探索针对TNBC的更有效的治疗方法。
血管生成拟态(vasculogenic mimicry,VM)是近年来提出的一种全新的肿瘤微循环模式。不同于经典的内皮细胞依赖的肿瘤微血管结构,VM是高侵袭性肿瘤细胞为了满足自身的血供,通过自身变形和细胞外基质重塑而形成的一种类似血管样的通道[2]。研究[3]显示,TNBC中VM形成明显高于其他乳腺癌类型,其与TNBC的高侵袭性和转移性密切相关,也是导致抗血管生成药物疗效不佳的重要原因之一。因而,探索抑制VM的方法,将为TNBC的治疗提供新的思路。
microRNA-34a(miR-34a)是具有抑癌作用的微小RNA(microRNA,miRNA)之一,参与对细胞增殖、凋亡、衰老等多种生命活动的调控。近来研究[4]显示,TNBC患者肿瘤组织中miR-34a表达水平极低,且miR-34a的低水平表达预示患者预后较差。本课题组前期研究[5]显示,miR-34a过表达能够抑制乳腺癌细胞的侵袭和迁移活动,但其是否参与TNBC细胞VM形成的调控目前尚无报道。本研究以TNBC细胞MDA-MB-231为研究对象,通过体外三维培养模型,采用基因过表达、Western blotting等方法探讨miR-34a在TNBC细胞VM形成中的作用和机制。
1 材料与方法 1.1 材料人乳腺癌细胞株MDA-MB-231和人胚肾细胞株HEK293T(中国科学院上海生命科学研究院细胞资源中心),胎牛血清(美国Gibco公司),RPMI 1640培养基、MEM培养基、胰蛋白酶(美国Hyclone公司),Matrigel胶(美国BD公司),磷酸盐缓冲液(北京索来宝生物科技有限公司),Taqman® MicroRNA Reverse Transcription试剂盒(美国Applied Biosystems公司),RNA PCR试剂盒(大连宝生物工程有限公司),U6引物、miR-34a引物(美国Life Technologies公司),Trizol、转染试剂Lipofectamine 2000(美国Invitrogen公司),血管内皮细胞钙黏蛋白(vascular endothelial cadherin,VE-cadherin)抗体(美国Santa Cruz Biotechnology公司),基质金属蛋白酶-2(matrix metalloprotease 2,MMP-2)抗体、基质金属蛋白酶-9(matrix metalloprotease 9,MMP-9)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国Cell Signaling Technology公司),E-cadherin抗体、Vimentin抗体(英国Abcam公司),miR-34a模拟物及其阴性对照(negative control,NC)、si-ZEB1及si-NC片段(上海吉玛制药技术有限公司)。
1.2 实验方法 1.2.1 实时定量PCR用Trizol提取并测量细胞总RNA。使用Taqman法检测miR-34a的内源性表达,以U6作为内参,测量Ct值。以2-ΔΔCt表示miR-34a的相对表达量。
1.2.2 细胞分组及转染将MDA-MB-231细胞分为NC组、miR-34a组、si-NC组和si-ZEB1组。其中NC组转染miRNA无义序列,si-NC组转染siRNA无义序列,miR-34a组转染miR-34a模拟物,si-ZEB1组转染ZEB1 siRNA。取对数生长期的细胞,胰酶消化后700 g离心5 min,收集细胞,调整密度接种至6孔板。以Lipofectamine 2000为转染试剂,转染过程按照Lipofectamine 2000说明书进行。
1.2.3 细胞的三维培养将预冷的Matrigel胶以50 μL/孔加至96孔板,小心摇动,使之均匀分布避免产生气泡。将包被好的96孔板37 ℃孵箱内1 h固化。细胞转染48 h后消化重悬,以2×104/孔种于Matrigel胶上,置于37 ℃孵箱内培养24 h后,倒置显微镜下观察、拍照、计数结点数,取每个视野均值,实验重复3次。
1.2.4 Western blotting法检测蛋白表达水平细胞转染48 h后,提取各组细胞总蛋白,SDS/PAGE电泳,湿法转移法将蛋白转移到PVDF膜上。5%脱脂奶粉室温封闭1 h,TBST洗涤3次。一抗VE-cadherin(1:500)、MMP-2(1:1 000)、MMP-9(1:1 000)、E-cadherin(1:1 000)、Vimentin(1:1 000)4 ℃孵育过夜,HRP标记二抗(1:10 000)室温孵育1 h,孵育结束后TBST洗涤3次,每次间隔10 min。ECL发光显色,以GAPDH(1:1 000)为内参,检测蛋白表达水平。
1.2.5 双荧光素酶报告基因分析将包含野生型miR-34a结合位点的ZEB1-wt- 3’非翻译区(untranslated region,UTR)及包含突变后miR-34a结合位点的ZEB1-mut- 3’UTR分别克隆入荧光素酶报告基因载体中构建质粒。将miR-34a模拟物或其NC与野生型或突变型报告基因质粒分别共转染入HEK293T细胞中。孵育48 h后,应用荧光素酶检测试剂盒检测荧光酶活性。
1.3 统计学分析采用SPSS 19.0软件进行统计分析,结果以x±s表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 miR-34a过表达效果miR-34a模拟物转染MDA-MB-231细胞48 h后,采用实时定量PCR检测miR-34a的表达水平,结果显示,与NC相比,转染miR-34a模拟物后,miR-34a表达水平上调(57.67 ± 8.74)倍(P < 0.05)。
2.2 过表达miR-34a对MDA-MB-231细胞VM形成的影响MDA-MB-231细胞能够在三维培养条件下形成大小不等的网络样管腔结构。过表达miR-34a的MDA-MB-231细胞在Matrigel胶上形成的总节点数显著减少(P < 0.05),提示miR-34a能够显著降低MDA-MB-231细胞的VM形成能力。见图 1。
|
| A, miR-34a overexpression suppressed V M formation in MDA-MB-231 cells(X 200); B, statistical analysis. * P< 0.05 vs NC group. 图 1 miR-34a过表达对MDA-MB-231细胞VM形成能力的影响 Fig.1 Effect of miR-34a overexpression on VM formation of MDA-MB-231 cells |
2.3 过表达miR-34a对VM形成相关分子标志物表达的影响
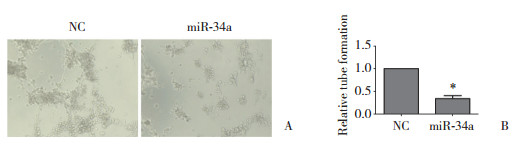
采用Western blotting检测2组细胞VM形成相关分子标志物的表达水平。结果显示,与对照组相比,过表达miR-34a的MDA-MB-231细胞中,VM形成标志物VE-cadherin、MMP-2及MMP-9的表达水平显著降低(P < 0.05),提示过表达miR-34a能够降低VM形成相关分子标志物的表达水平。见图 2。
|
| A, miR-34a overexpression decreased the expression of V M markers; B, statistical analysis. * P < 0.05 vs NC group. 图 2 miR-34a过表达对VM形成相关分子标志物表达的影响 Fig.2 Effect of miR-34a overexpression on VM markers |
2.4 miR-34a靶向结合ZEB1
应用miRanda (http://www.microrna.org/microrna/home.do)预测发现,miR-34a与ZEB1之间存在结合位点(图 3A)。双荧光素酶报告基因分析结果(图 3B)显示,ZEB1-wt-3’ UTR + miR-34a模拟物组荧光素酶活性较ZEB1-wt-3’ UTR + NC组显著下降(P < 0.05),而ZEB1-mut-3’ UTR + miR-34a模拟物组荧光素酶活性与ZEB1-mut-3’UTR + NC组相比无明显变化,证实miR-34a靶向抑制ZEB1表达。

|
| A, 3 '-UTR wild-type (wt) and mutated (mut) reporter constructs of ZEB1; B, statistical analysis of luciferase reporter assay. * P < 0.05 Vs NC group. 图 3 miR-34a靶向抑制ZEB1 Fig.3 miR-34a directly targets ZEB1 |
2.5 沉默ZEB1对MDA-MB-231细胞VM形成的影响
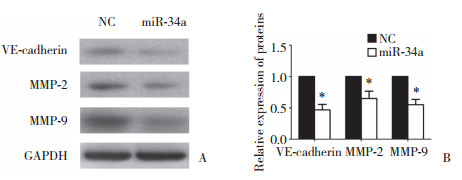
si-ZEB1转染MDA-MB-231细胞后,采用三维培养观察VM形成变化。结果显示,与对照组相比,si-ZEB1组细胞VM形成显著下降(P < 0.05),提示ZEB1是参与MDA-MB-231细胞VM形成的重要调控因子。见图 4。

|
| A, ZEB1 sileneing suppressed VM formation in MDA-MB-231 cells(x 200); B, statistical analysis. * P< 0.05 vs si-NC group. 图 4 沉默ZEB1对MDA-MB-231细胞VM形成的影响 Fig.4 Effect of ZEB1 silencing on VM formation of MDA-MB-231 cells |
2.6 沉默ZEB1对MDA-MB-231细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)过程的影响
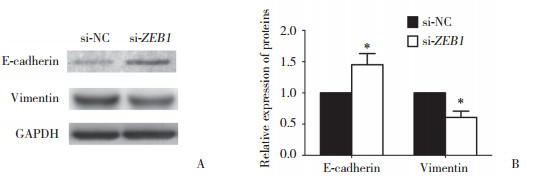
采用Western blotting检测各组细胞EMT相关因子E-cadherin和Vimentin表达的变化。结果显示,沉默ZEB1后,E-cadherin表达显著增加,而Vimentin表达显著下降(P < 0.05),提示沉默ZEB1可抑制MDA-MB-231细胞的EMT进程。见图 5。
|
| A, effecet of ZEB1 silencing on expression of EMT-associated key factors; B, statistical analysis.*P < 0.05 vs si-NC group. 图 5 沉默ZEB1对MDA-MB-231细胞EMT过程的影响 Fig.5 Effect of ZEB1 silencing on EMT in MDA-MB-231 cells |
3 讨论
TNBC是临床上最具侵袭性的乳腺癌亚型之一。尽管TNBC的诊断和治疗已有较大进展,但由于该病易复发和转移,患者预后极差。VM是高侵袭性肿瘤细胞相互连接而形成的一种血管样通道。它能够为肿瘤细胞提供营养支持,使其获得更具侵袭性的表型,并能将肿瘤细胞带入微循环,从而转移到其他器官[6]。多项研究证实,VM形成是促进TNBC肿瘤细胞侵袭和迁移的重要因素。
miRNA是一类长约18×103~22×103的非编码小RNA,它们能够诱导靶mRNA降解或抑制靶mRNA翻译,在转录后水平调控基因表达。一部分miRNA具有癌基因或抑癌基因的功能,与肿瘤的发生、发展和转移密切相关。近年来研究发现,miRNA与肿瘤VM形成的调控密切关联。LI等[7]报道miR-141能够通过抑制EphA2的表达抑制胶质瘤的VM形成,WAN等[8]报道miR-124能够通过靶向AmotL1在头颈部肿瘤中抑制VM形成。miR-34a是一种能够抑制肿瘤新生血管形成的miRNA[9],但其是否参与肿瘤细胞VM形成尚无研究报道。本研究以TNBC细胞MDA-MB-231为研究对象,通过体外实验首次发现,过表达miR-34a能够显著抑制MDA-MB-231细胞的VM形成,提示miR-34a可能为抑制TNBC细胞VM形成的重要因子。
越来越多的证据表明,EMT过程可以通过促进细胞的可塑性、重塑细胞外基质等机制促进VM形成,在恶性肿瘤的转移和VM形成中起到关键性作用[10]。ZEB1是参与EMT调控的关键因子。临床研究[11]发现,ZEB1高表达可作为预示TNBC患者低生存率的独立预后因子。近期研究发现,ZEB1参与肿瘤细胞的VM形成。LIU等[12]的结肠直肠癌研究结果显示,VM阳性的样本中ZEB1表达上调且与EMT特征相关。敲低ZEB1能够减少VM形成,恢复肿瘤细胞的上皮表型,并抑制肿瘤的侵袭和迁移。本研究在TNBC细胞MDA-MB-231中观察到,沉默ZEB1能够显著减少VM形成,同时抑制肿瘤细胞的EMT过程,提示EMT调控关键因子ZEB1可作为抑制TNBC细胞VM形成的重要靶点。生物信息学分析显示,ZEB1是miR-34a的靶基因,且双荧光素酶报告基因分析结果显示,miR-34a能够靶向抑制ZEB1的表达。因此推测,miR-34a抑制TNBC细胞VM形成的机制可能与其靶向抑制ZEB1,抑制肿瘤细胞EMT过程有关。
综上所述,本研究首次发现miR-34a能够抑制TNBC细胞的VM形成,其机制可能与靶向ZEB1抑制EMT过程有关。本研究将为TNBC中抑制VM的治疗策略提供新的实验依据。
| [1] |
REDIG AJ, MCALLISTER SS. Breast cancer as a systemic disease:a view of metastasis[J]. J Intern Med, 2013, 274(2): 113-126. DOI:10.1111/joim.12084 |
| [2] |
SEFTOR RE, HESS AR, SEFTOR EA, et al. Tumor cell vasculogenic mimicry:from controversy to therapeutic promise[J]. Am J Pathol, 2012, 181(4): 1115-1125. DOI:10.1016/j.ajpath.2012.07.013 |
| [3] |
ZHANG DF, SUN BC, ZHAO XL, et al. Twist1 expression induced by sunitinib accelerates tumor cell vasculogenic mimicry by increasing the population of CD133+ cells in triple-negative breast cancer[J]. Mol Cancer, 2014, 13: 207. DOI:10.1186/1476-4598-13-207 |
| [4] |
ADAMS BD, WALI VB, CHENG CJ, et al. miR-34a silences c-SRC to attenuate tumor growth in triple-negative breast cancer[J]. Cancer Res, 2016, 76(4): 927-939. DOI:10.1158/0008-5472.CAN-15-2321 |
| [5] |
KANG L, MAO J, TAO YJ, et al. MicroRNA-34a suppresses the breast cancer stem cell-like characteristics by downregulating Notch1 pathway[J]. Cancer Sci, 2015, 106(6): 700-708. DOI:10.1111/cas.12656 |
| [6] |
KIRSCHMANN DA, SEFTOR EA, HARDY KM, et al. Molecular pathways:vasculogenic mimicry in tumor cells:diagnostic and therapeutic implications[J]. Clin Cancer Res, 2012, 18(10): 2726-2732. DOI:10.1158/1078-0432.CCR-11-3237 |
| [7] |
LI GX, HUANG M, CAI YQ, et al. miR-141 inhibits glioma vasculogenic mimicry by controlling EphA2 expression[J]. Mol Med Rep, 2018, 18(2): 1395-1404. DOI:10.3892/mmr.2018.9108 |
| [8] |
WAN HY, LI QQ, ZHANG Y, et al. MiR-124 represses vasculogenic mimicry and cell motility by targeting amotL1 in cervical cancer cells[J]. Cancer Lett, 2014, 355(1): 148-158. DOI:10.1016/j.canlet.2014.09.005 |
| [9] |
YU G, YAO WM, XIAO W, et al. MicroRNA-34a functions as an antimetastatic microRNA and suppresses angiogenesis in bladder cancer by directly targeting CD44[J]. J Exp Clin Cancer Res, 2014, 33: 779. DOI:10.1186/s13046-014-0115-4 |
| [10] |
ZHANG JG, ZHANG DD, LIU Y, et al. RhoC/ROCK2 promotes vasculogenic mimicry formation primarily through ERK/MMPs in hepatocellular carcinoma[J]. Biochim Biophys Acta Mol Basis Dis, 2019, 1865(6): 1113-1125. DOI:10.1016/j.bbadis.2018.12.007 |
| [11] |
JANG MH, KIM HJ, KIM EJ, et al. Expression of epithelialmesenchymal transition-related markers in triple-negative breast cancer:ZEB1 as a potential biomarker for poor clinical outcome[J]. Hum Pathol, 2015, 46(9): 1267-1274. DOI:10.1016/j.humpath.2015.05.010 |
| [12] |
LIU ZY, SUN BC, QI LS, et al. Zinc finger E-box binding homeobox 1 promotes vasculogenic mimicry in colorectal cancer through induction of epithelial-to-mesenchymal transition[J]. Cancer Sci, 2012, 103(4): 813-820. DOI:10.1111/j.1349-7006.2011.02199.x |
 2020, Vol. 49
2020, Vol. 49