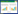文章信息
- 钟文萱, 李娟, 戴姝艳
- ZHONG Wenxuan, LI Juan, DAI Shuyan
- 子宫内膜异位症患者异位内膜组织中血管紧张素受体的表达及其临床意义
- Clinical significance of angiotensin receptor expression in ectopic endometrium in patients with endometriosis
- 中国医科大学学报, 2020, 49(5): 419-423
- Journal of China Medical University, 2020, 49(5): 419-423
-
文章历史
- 收稿日期:2019-05-13
- 网络出版时间:2020-05-07 9:27
子宫内膜异位症是指子宫内膜组织(腺体和间质)在子宫腔被覆内膜及子宫以外的部位出现、生长、浸润,反复出血,继而引发疼痛、不孕及结节或包块等。子宫内膜异位症是生育年龄妇女的多发病、常见病,其病变广泛、形态多样、极具侵袭性和复发性,具有性激素依赖的特点。子宫内膜异位症根据发生部位大致可分为腹膜型、卵巢型、深部浸润型和其他部位型。腹壁子宫内膜异位症多继发于剖宫产术后,发病率0.03%~0.4%[1]。腹壁子宫内膜异位症药物治疗效果不理想,目前倾向于手术治疗,但极易复发,甚至恶变[2]。研究[3]表明血管生成是子宫内膜异位种植和发展的主要机制之一。人体肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)主要负责调控水、电解质、体液平衡和血压稳定。血管紧张素Ⅱ(angiotensinⅡ,ANGⅡ)是RAAS的核心,主要通过与血管紧张素1型受体(angiotensin type 1 receptor,AT1R)和血管紧张素2型受体(angiotensin type 2 receptor,AT2R)结合发挥作用,包括调节局部血流和血管紧张性,推动血管平滑肌代谢以及生长等,与新血管形成有关。AT1R主要负责升高血压、调动部分血流乃至血管紧张性等;而AT2R用来补偿AT1R带来的血管效应[4-5]。动物实验[6-7]已经证明利用AT1R阻断剂替米沙坦可以干预炎症反应及血管生长,从而有效抑制小鼠异位内膜病灶的生长。NAKAO等[8]在体实验发现子宫内膜异位症患者的在位内膜中检测出AT1R与AT2R的表达,同时还发现子宫内膜异位囊肿中AT1R/AT2R比率显著高于正常增殖期子宫内膜。然而,至今为止针对腹壁子宫内膜异位症与血管生成因素的相关研究国内外均未见报道,本研究通过免疫组化检测腹壁异位子宫内膜组织和正常子宫内膜组织AT1R与AT2R蛋白的表达,并探讨其表达的临床意义。
1 材料与方法 1.1 临床资料及分组选取2016年5月至2018年6月我院行手术治疗后的腹壁子宫内膜异位症患者(40例)的腹壁异位内膜组织作为实验组,患者年龄30~47岁,平均(36.06±4.85)岁,体质量指数(body mass index,BMI)(20.91±4.64)kg/m2,孕次(1.43 ±1.45)次,心率(74.32±14.64)次/min,收缩压(114.7±20.9)mmHg,舒张压(76.1±11.2)mmHg。选取同期本院由于子宫颈高级别鳞状上皮内病变(high grade squamous intraepithelial lesions,HSIL)且无生育要求而行全子宫切除手术40例患者的正常子宫内膜组织作为对照组,患者年龄27~47岁,平均(38.94±6.38)岁,BMI(21.52±3.78)kg/m2,孕次(1.53±1.37)次,心率(75.64±15.32)次/min,收缩压(118.2±18.5)mmHg,舒张压(80.3±14.7)mmHg。2组年龄、BMI、孕次、心率、血压比较差异均无统计学意义(均P > 0.05)。入组标准:(1)月经规律;(2)至少3个月内无放置宫内节育器病史或激素类药物治疗史;(3)无放射治疗史及化疗史;(4)不伴有子宫内膜不典型增生;(5)无高血压、糖尿病、自身免疫性疾病以及恶性肿瘤等相关疾病;(6)选取的组织都已通过临床和病理学检查证实。
1.2 试剂AT1R兔多克隆抗体(ab124505)及AT2R兔多克隆抗体(ab19134)购自英国Abcam公司,即用型SP试剂盒及DAB显色试剂盒购自福州迈新公司。
1.3 方法石蜡切片常规脱蜡水化,微波抗原修复,H2O2封闭内源性过氧化物酶于37 ℃温箱中30 min,山羊血清37 ℃温箱中40 min,AT1R(1:300)、AT2R(1:200)4 ℃过夜,加二抗于37 ℃温箱中孵育30 min,辣根标记液于37 ℃温箱中孵育30 min,DAB显色,苏木素复染,脱水封片。用PBS代替一抗作为阴性对照。
1.4 结果判定AT1R依照细胞膜以及细胞质中出现黄色或棕色作为阳性结果,AT2R则以细胞核膜及细胞质中出现黄色或棕色作为阳性结果[8]。结果判断采用Formwitz评分方法[9],(1)a是阳性率评分:每一张切片在光镜下任选5个高倍镜视野(×400),观察视野中全部细胞,计算阳性细胞的百分率并取平均值,阳性细胞 < 5%,0分;阳性细胞5%~25%,1分;阳性细胞26%~50%,2分;阳性细胞51%~75%,3分;阳性细胞 > 75%,4分;(2)b为染色强度评分:不着色,0分;淡黄色,1分;黄色或者棕黄色,2分;褐色或是棕褐色,3分。免疫组化最终评分为a与b评分相乘所得之积。免疫组化积分:0分,阴性(-);1~3分,弱阳性(+);4~6分,阳性(++);≥7分,强阳性(+++)。
1.5 统计学分析采用SPSS 20.0软件进行统计学分析。2组AT1R及AT2R表达比较采用Mann-Whitney检验;实验组AT1R及AT2R表达与临床指标相关分析采用χ2检验或Fisher确切概率法。P < 0.05为差异有统计学意义。
2 结果 2.1 2组AT1R和AT2R表达的比较结果显示,AT1R和AT2R在2组均有不同程度的表达。AT1R表达主要在腺上皮的细胞膜及细胞质;AT2R表达在腺上皮的细胞质和间质细胞的核膜。AT1R表达实验组明显高于对照组(P < 0.05);而AT2R表达实验组明显低于对照组(P < 0.05)。见图 1、表 1。

|
| A, AT1R expression in the experiment group; B, AT1R expression in the control group; C, AT2R expression in the control group; D, AT2R expression in the experiment group 图 1 2组AT1R和AT2R表达比较HE×400 Fig.1 Expression patterns of AT1R and AT2R in the experiment and control groups HE×400 |
| Group | n | AT1R | AT2R |
| Experiment | 40 | 6.00(4.00-6.00) | 2.00(1.00-2.00) |
| Control | 40 | 2.00(1.00-2.00) | 4.00(2.50-4.00) |
| t | -6.019 | -4.537 | |
| P | < 0.001 | < 0.001 |
2.2 实验组AT1R、AT2R表达与临床指标的相关分析
结果显示,实验组患者AT1R表达水平与年龄、剖宫产次数及术后发病时间、结节数量、结节大小及浸润深度不相关(均P > 0.05),而与CA125水平相关(P < 0.05);而AT2R表达水平与年龄、剖宫产次数及术后发病时间、CA125水平、结节数量、结节大小及浸润深度均不相关(均P > 0.05),见表 2。
| Clinicopathological parameters | AT1R | P1 | AT2R | P2 | ||
| - | + | - | + | |||
| Age | 0.256 | 0.444 | ||||
| >40 years | 2 | 8 | 2 | 8 | ||
| ≤40 years | 2 | 28 | 12 | 18 | ||
| Numbers of cesarean delivery | 0.602 | 0.143 | ||||
| 1 | 4 | 27 | 14 | 17 | ||
| >1 | 2 | 7 | 1 | 8 | ||
| Time from cesarean delivery to presentation of abdominal wall ectopic | 0.804 | 0.685 | ||||
| ≤1 year | 2 | 12 | 5 | 9 | ||
| >1 year | 6 | 20 | 11 | 15 | ||
| CA125 | 0.013 | 0.482 | ||||
| Normal | 5 | 13 | 7 | 11 | ||
| Elevated | 0 | 22 | 11 | 11 | ||
| Ectopic nodule number | 0.306 | 0.580 | ||||
| Single | 5 | 25 | 14 | 16 | ||
| Multiple | 0 | 10 | 3 | 7 | ||
| Depth of invasion | 0.605 | 0.822 | ||||
| Subcutaneous fat and fascia layer | 5 | 12 | 8 | 9 | ||
| Muscle and peritoneum | 4 | 19 | 10 | 13 | ||
| Ectopic nodule diameter | 0.580 | 0.661 | ||||
| <5 cm | 6 | 28 | 18 | 16 | ||
| ≥5 cm | 2 | 4 | 2 | 4 | ||
3 讨论
腹壁子宫内膜异位症对育龄期妇女的健康产生了极大的影响。赵学英等[10]曾提出剖宫产等手术操作把子宫和腹腔内游离的内膜碎片种植到切口是导致其发病的重要原因。已有研究[11]表明子宫内膜异位病灶需要足够的血液供应才能在其异位部位存活。AngⅡ是一种重要的生物活性肽,具有调节血压稳定,促进细胞生长、分化和凋亡等作用,它的绝大部分功能是由AT1R介导的。AT1R是一种G蛋白耦联受体,在许多组织中AT1R激活会通过下游信号分子(磷脂酶C、蛋白激酶C)以及信号转导和转录激活因子发挥作用,导致细胞生长和分化反应[12]。本研究结果显示与正常子宫内膜组织比较,腹壁异位内膜组织中AT1R表达明显增高,在一定程度上也证明了血管生成对腹壁子宫内膜异位症发病的重要性。
AT1R可调控肿瘤血管的产生,AT1R联合AngⅡ高表达的原代乳腺上皮细胞表现出高侵袭性,而这种现象会被AT1R阻滞剂(氯沙坦)阻滞[13]。AT1R过表达与卵巢癌低存活率相关[14]。INOK等[15]对67例卵巢癌组织进行免疫组化实验,发现AT1R的阳性表达率达85%,AT1R的表达水平和肿瘤内微脉管密度乃至血管生成的表达强度均存在一定的正相关性;与AT1R染色阴性患者比较,体内AT1R阳性表达的患者总体生存率明显降低。DELFORCE等[16]检测30例子宫内膜癌患者体内多种RAAS相关因子的表达,结果发现子宫内膜癌组织AT1R mRNA表达水平显著高于其临近非内膜癌组织。剖宫产瘢痕处腹壁异位子宫内膜发生恶变的概率约为0.9%[17],本研究结果显示腹壁子宫内膜异位症患者AT1R表达与CA125相关(P < 0.05)。由此推测AT1R很可能与腹壁子宫内膜异位症的恶变具有一定的联系。
AT2R虽与AT1R共享一个核酸序列,但其同源性只有34%[18],对于ANGⅡ有着相似的亲和力。编码AT2R的基因位于人类X染色体上,由363氨基酸组成[19]。许多研究已证实AT2R在功能上与AT1R相互拮抗。MASAKI等[20]发现在心脏特异性启动子控制下AT2R基因过度表达的转基因小鼠对AT1R介导的加压素和变时性行为的敏感性降低。AT2R主要起到血管舒张作用,同时还发现外周AT2R激活也在一定程度上起到组织保护作用[5]。上调AT2R可以促进病变组织的伤口愈合和组织重建[21]。NAKAO等[8]研究发现子宫内膜异位囊肿病灶中,AT2R对AT1R的拮抗作用会被抑制,AT1R和AT2R mRNA的表达水平与正常子宫内膜差异不明显,但这两者之间的比率明显高于正常子宫内膜(P < 0.001)。本研究结果显示,腹壁异位内膜组织中AT2R的阳性表达比正常子宫内膜组织明显降低,而且该内膜组织中AT1R/AT2R比正常子宫内膜组织明显增高,因此证明了AT1R及AT2R相互抗衡,共同参与了腹壁子宫内膜异位症的发病过程。
综上所述,AT1R和AT2R在腹壁子宫内膜异位症患者表达存在差异;AT1R和AT2R的差异性表达在子宫内膜异位症发病过程中起重要作用。
本研究样本较小,且免疫组化方法也具有一定的局限性,仅证明了腹壁异位内膜组织中AT1R的表达明显高于正常子宫内膜组织,而AT2R表达明显低于正常子宫内膜组织,未能阐明具体的作用机制。到目前为止,针对RAAS与腹壁子宫内膜异位症发病相关的研究较少,对AT2R在RAAS中具体的作用机制还不明确,期望今后增加样本量进一步研究论证。
| [1] |
ERKAN N, HACIYANLI M, SAYHAN H. Abdominal wall endometriomas[J]. Int J Gynaecol Obstet, 2005, 89(1): 59-60. DOI:10.1016/j.ijgo.2004.11.015 |
| [2] |
GRAUR F, MOIS E, ELISEI R, et al. Malignant endometriosis of the abdominal wall[J]. Ann Ital Chir, 2017, 6: S2239253X17026895. |
| [3] |
KANG S, ZHAO J, LIU Q, et al. Vascular endothelial growth factor gene polymorphisms are associated with the risk of developing adenomyosis[J]. Environ Mol Mutagen, 2009, 50(5): 361-366. DOI:10.1002/em.20455 |
| [4] |
TOUYZ RM, SCHIFFRIN EL. Signal transduction mechanisms mediating the physiological and pathophysiological actions of angiotensinⅡin vascular smooth muscle cells[J]. Pharmacol Rev, 2000, 52(4): 639-672. |
| [5] |
SUMNERS C, DE KLOET AD, KRAUSE EG, et al. Angiotensin type 2 receptors:blood pressure regulation and end organ damage[J]. Curr Opin Pharmacol, 2015, 21: 115-121. DOI:10.1016/j.coph.2015.01.004 |
| [6] |
NENICU A, KÖRBEL C, GU Y, et al. Combined blockade of angiotensinⅡtype 1 receptor and activation of peroxisome proliferator-activated receptor-γ by telmisartan effectively inhibits vascularization and growth of murine endometriosis-like lesions[J]. Hum Reprod, 2014, 29(5): 1011-1024. DOI:10.1093/humrep/deu035 |
| [7] |
张真真, 戴姝艳. 血管紧张素Ⅱ2型受体对大鼠子宫内膜异位症血管生成的影响[J]. 中国医科大学学报, 2018, 47(9): 792-796. DOI:10.12007/j.issn.0258-4646.2018.09.006 |
| [8] |
NAKAO T, CHISHIMA F, SUGITANI M, et al. Expression of angiotensinⅡtypes 1 and 2 receptors in endometriotic lesions[J]. Gynecol Obstet Invest, 2017, 82(3): 294-302. DOI:10.1159/000447591 |
| [9] |
李灿宇, 刘欢欢, 王婷婷, 等. COX-2、VEGF和Galectin-3在卵巢子宫内膜异位症中的表达及意义[J]. 现代妇产科进展, 2018, 27(12): 914-917. DOI:10.13283/j.cnki.xdfckjz.2018.12.007 |
| [10] |
赵学英, 郎景和, 冷金花, 等. 腹壁子宫内膜异位症的临床特点及复发相关因素分析[J]. 中华妇产科杂志, 2004, 39(2): 97-100. DOI:10.3760/j.issn:0529-567X.2004.02.008 |
| [11] |
GROOTHUIS PG, NAP AW, WINTERHAGER E, et al. Vascular development in endometriosis[J]. Angiogenesis, 2005, 8(2): 147-156. DOI:10.1007/s10456-005-9005-x |
| [12] |
OLIVARES-REYES JA, SHAH BH, HERNÁNDEZ-ARANDA J, et al. Agonist-induced interactions between angiotensin AT1 and epidermal growth factor receptors[J]. Mol Pharmacol, 2005, 68(2): 356-364. DOI:10.1124/mol.104.010637 |
| [13] |
RHODES DR, ATEEQ B, CAO Q, et al. AGTR1 overexpression defines a subset of breast cancer and confers sensitivity to losartan, an AGTR1 antagonist[J]. Proc Natl Acad Sci USA, 2009, 106(25): 10284-10289. DOI:10.1073/pnas.0900351106 |
| [14] |
PARK YA, CHOI CH, DO IG, et al. Dual targeting of angiotensin receptors(AGTR1 and AGTR2) in epithelial ovarian carcinoma[J]. Gynecol Oncol, 2014, 135(1): 108-117. DOI:10.1016/j.ygyno.2014.06.031 |
| [15] |
INO K, SHIBATA K, KAJIYAMA H, et al. AngiotensinⅡtype 1 receptor expression in ovarian cancer and its correlation with tumour angiogenesis and patient survival[J]. Br J Cancer, 2006, 94(4): 552-560. DOI:10.1038/sj.bjc.6602961 |
| [16] |
DELFORCE SJ, LUMBERS ER, CORBISIER DE MEAULTSART C, et al. Expression of renin-angiotensin system(RAS) components in endometrial cancer[J]. Endocr Connect, 2017, 6(1): 9-19. DOI:10.1530/EC-16-0082 |
| [17] |
HIGASHIURA Y, KAJIHARA H, SHIGETOMI H, et al. Identification of multiple pathways involved in the malignant transformation of endometriosis(Review)[J]. Oncol Lett, 2012, 4(1): 3-9. DOI:10.3892/ol.2012.690 |
| [18] |
SIRAGY HM. AT1 and AT2 receptor in the kidney:role in health and disease[J]. Semin Nephrol, 2004, 24(2): 93-100. DOI:10.1016/j.semnephrol.2003.11.009 |
| [19] |
KOIKE G, HORIUCHI M, YAMADA T, et al. Human type 2 angiotensinⅡreceptor gene:cloned, mapped to the X chromosome, and its mRNA is expressed in the human lung[J]. Biochem Biophys Res Commun, 1994, 203(3): 1842-1850. DOI:10.1006/bbrc.1994.2402 |
| [20] |
MASAKI H, KURIHARA T, YAMAKI A, et al. Cardiac-specific overexpression of angiotensinⅡAT2 receptor causes attenuated response to AT1 receptor-mediated pressor and chronotropic effects[J]. J Clin Invest, 1998, 101(3): 527-535. DOI:10.1172/JCI1885 |
| [21] |
MORAN BM, FLATT PR, MCKILLOP AM. G protein-coupled receptors:signalling and regulation by lipid agonists for improved glucose homoeostasis[J]. Acta Diabetol, 2016, 53(2): 177-188. DOI:10.1007/s00592-015-0826-9 |
 2020, Vol. 49
2020, Vol. 49