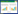文章信息
- 李玉红, 郝明媛, 焦连丽, 王爱欣, 任琦, 冯福民
- LI Yuhong, HAO Mingyuan, JIAO Lianli, WANG Aixin, REN Qi, FENG Fumin
- 基于细胞焦亡理论研究白细胞介素-1β与白细胞介素-18在抗结核药物性肝损伤中的临床意义
- Clinical significance of human interleukin-1β and -18 in anti-tuberculosis drug-induced liver injury based on the theory of pyroptosis
- 中国医科大学学报, 2020, 49(5): 396-399, 404
- Journal of China Medical University, 2020, 49(5): 396-399, 404
-
文章历史
- 收稿日期:2018-10-11
- 网络出版时间:2020-05-06 16:30
2. 呼伦贝尔市传染病医院检验科, 内蒙古 呼伦贝尔 162650
2. Department of Clinical Laboratory, Hulun Buir Infectious Disease Hospital, Hulun Buir 162650, China
标准短程化疗仍是目前抗结核治疗的最有效方法。抗结核药物性肝损伤(anti-tuberculosis drug induced liver injury,ADLI)是化疗期间最常见的不良反应,常导致治疗间断,严重者可致肝衰竭甚至死亡[1-2]。ADLI作用机制复杂,迄今尚未阐明。近来,研究者提出一个药物性肝损伤(drug induced liver injury,DILI)发病机制的重要假说,即炎症和药物暴露的相互作用[3]。
细胞焦亡(pyroptosis)学说是目前炎症反应机制研究的新热点。pyroptosis是一种促炎的程序性死亡方式,其主要依赖于炎性半胱天冬氨酸蛋白酶(cysteine-aspartic acid protease 1,Caspase-1)的活化,进而介导白细胞介素(interleukin,IL)-1 β活化、IL-18分泌,并诱发级联放大的炎症反应,最终诱导细胞炎性死亡[4]。研究[5]发现,在热应激诱导大鼠肝损伤模型中,热应激可刺激炎性体的激活,最终导致Caspase-1活化和IL-1β分泌,证明IL-1β参与了急性肝损伤过程。IL-1β和IL-18炎性细胞因子的产生被认为是pyroptosis发生的重要指标,但目前缺乏ADLI患者中的IL-1β和IL-18水平的临床研究。因此,本研究探讨IL-1β与IL-18在ADLI患者血清中的变化,以期为ADLI早期抗炎干预治疗提供临床依据。
1 材料与方法 1.1 临床资料选取2016年1月至2017年1月于唐山市第四医院接受标准短程化疗的初治肺结核患者。肺结核的诊断标准依据《肺结核的诊断和治疗指南》 [6],ADLI的诊断标准依据《国际共识会议标准》 [7],即丙氨酸转氨酶(alanine aminotransferase,ALT) > 2倍的正常值上限(upper limit of normal value,ULN),或天冬氨酸转氨酶(aspartate aminotransferase,AST)和总胆红素(total bilirubin,TBIL)联合升高,且其中之一升高 > 2×ULN。具有以下任何一项的患者不纳入本研究:(1)基线肝功能异常者;(2)患有可引起肝功能异常的其他疾病者(如病毒性肝炎、自身免疫型肝炎、酒精性肝病、脂肪肝、菌血症、充血性心力衰竭等);(3)服用其他可引起肝功能异常的药物者。符合ADLI标准的患者为病例组,对每个ADLI病例,按照年龄、性别、治疗史、药物剂量和方案匹配的原则选择1个非ADLI(non-ADLI)患者作为对照。本研究获得华北理工大学伦理委员会批准,并经患者知情同意,所采集的标本仅用于医学研究。
1.2 主要试剂和仪器ELISA试剂盒购自艾美捷科技有限公司生产,全波长多功能酶标仪购自美国Thermo公司,HITACHI 7600-020全自动生化分析仪购自日本日立公司;Heraeus高速冷冻离心机购自德国Thermo公司。
1.3 血清标本的选择ADLI组为服用抗结核药后,临床检测肝功能指标异常,且达到诊断ADLI标准的血清标本;非ADLI组为服用抗结核药,与ADLI组用药时间相匹配且未发生肝损伤的血清标本。
1.4 检测方法采集患者清晨空腹外周静脉血5 mL,4 ℃ 3 000 r/min离心分层提取血清;全自动生化分析仪检测肝功能情况;采用酶联免疫吸附法(enzyme-linked immunosorbentassay,ELISA)检测IL-1β及IL-18的水平。
1.5 统计学分析采用SPSS 20.0统计软件进行数据分析,本研究中连续变量均不符合正态性分布,用M(P25~P75)表示,采用秩和检验Mann-Whitney U试验进行分析;分类变量用例数(构成比)表示,用χ2检验进行分析;应用Spearman等级相关分析评价变量之间的相关性;受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)用来评估IL-1β的诊断价值,P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料病例组共41例ADLI患者,其中,男31例,女10例,平均年龄31(24~51)岁,年龄范围20~78岁;对照组共41例非肝损伤患者,其中,男31例,女10例,平均年龄33(24~51)岁,年龄范围19~79岁。由于匹配设计的要求,2组性别和年龄的分布无统计学差异。体质量指数(body mass index,BMI)差异有统计学意义(P < 0.01),2组在文化程度、职业、吸烟、饮酒、居住环境因素方面差异无统计学意义(P > 0.05),见表 1。
| Item | ADLI group [n(%)] | non-ADLI group [n(%)] | χ2 | P |
| Education | 4.000 | 0.135 | ||
| Primary senior | 14(34.15) | 7(17.06) | ||
| Junior | 8(19.51) | 14(34.15) | ||
| Senior | 19(46.34) | 20(48.78) | ||
| BMI(kg/m2) | 23.633 | < 0.001 | ||
| < 18.5 | 24(58.53) | 23(56.10) | ||
| 18.5- < 24 | 12(29.27) | 16(39.02) | ||
| ≥24 | 5(12.20) | 2(4.88) | ||
| Profession | 1.383 | 0.501 | ||
| Farmer | 21(51.22) | 15(36.58) | ||
| Worker | 10(24.39) | 14(34.15) | ||
| Others | 10(24.39) | 12(29.27) | ||
| Smoking | 2.563 | 0.109 | ||
| Yes | 6(14.63) | 12(29.27) | ||
| No | 35(85.37) | 29(70.73) | ||
| Drinking | 1.713 | 0.191 | ||
| Yes | 34(82.93) | 29(70.73) | ||
| No | 7(17.07) | 12(29.27) | ||
| Residence | 0.053 | 0.817 | ||
| City | 14(34.15) | 15(36.58) | ||
| Countryside | 27(65.85) | 26(63.42) |
2.2 2组患者肝功能水平比较
血清中AST、ALT、碱性磷酸酶(alkaline phosphatase,ALP)水平在ADLI组和非ADLI组中差异有统计学意义(均P < 0.05),见表 2。
| Item | ADLI group(n = 41) | Non-ADLI group(n = 41) | Z | P |
| ALT(U/L) | 140.00(103.50-207.45) | 12.00(8.00-15.85) | -7.796 | < 0.001 |
| AST(U/L) | 105.00(65.00-162.90) | 14.70(11.00-19.25) | -7.742 | < 0.001 |
| TBIL(μmol/L) | 8.30(5.95-13.80) | 7.20(5.60-10.55) | -1.707 | 0.088 |
| DBIL(μmol/L) | 2.80(2.20-4.25) | 2.50(1.85-3.385) | -1.703 | 0.089 |
| TP(g/L) | 70.30(66.50-73.35) | 70.20(65.80-74.85) | -0.153 | 0.878 |
| ALB(g/L) | 43.00(40.25-45.30) | 40.80(38.70-43.00) | -2.393 | 0.017 |
| ALP(U/L) | 82.10(67.90-105.50) | 72.00(62.05-85.65) | -1.790 | 0.073 |
| DBIL, direct bilirubin; TP, total protein; ALB, albumin; ALP, alkaline phosphatase. | ||||
2.3 2组患者血清IL-1β与IL-18水平比较
血清IL-1β在ADLI组和非ADLI组中差异有统计学意义(P < 0.01),血清IL-18在2组间比较无统计学差异,见表 3。
| Item | ADLI group(pg/mL) | non-ADLI group(pg/mL) | P |
| IL-1β | 99.10(88.20-106.60) | 58.10(49.20-70.55) | < 0.001 |
| IL-18 | 106.40(88.10-161.90) | 104.00(98.65-160.65) | 0.464 |
2.4 2组患者血清IL-1β与肝功能指标的相关性分析
进一步对研究对象血清IL-1β水平与肝功能指标水平进行相关性分析,发现血清IL-1β与AST、ALT及ALP呈正相关(均P < 0.05),且与ALT、AST相关性更显著(P < 0.01)。
2.5 血清IL-1β水平对ADLI患者的预测价值血清IL-1β水平对ADLI预测价值以AUC方式评估,见图 1。血清IL-1β水平的AUC是0.889(SE为0.037,95%CI:0.817~0.961),进一步根据ROC曲线获得的各样本的灵敏度和特异度,计算约登指数(Youden’S index=灵敏度+特异度-1),以最大值对应数据作为最佳筛查阳性界值(cut-off值),可知,cut-off值为58.55 pg/mL。

|
| 图 1 血清IL -1β预测ADLI的ROC曲线 Fig.1 ROC curve of serum IL-1β predicting ADLI |
3 讨论
炎症反应被认为是ADLI的关键发病机制,细胞凋亡作为程序性细胞死亡的主要形式,被证明在药物诱发肝损伤的炎症反应中起主要作用[8]。近来,程序性细胞死亡的另一种重要形式“pyroptosis”被报道也参与疾病的发生发展过程。IL-1β和IL-18是pyroptosis研究中起关键作用的促炎性细胞因子,可诱发级联放大的炎症反应,最终诱导细胞炎性死亡[9]。ADLI是否与IL-1β和IL-18有关尚未阐明。因此,本研究探讨了IL-1β和IL-18与ADLI的关系。
| Item | IL-1β(pg/mL) | |
| r | P | |
| ALT(U/L) | 0.597 | < 0.001 |
| AST(U/L) | 0.629 | < 0.001 |
| TBIL(μmol/L) | 0.170 | 0.126 |
| DBIL(μmol/L) | 0.026 | 0.817 |
| TP(g/L) | -0.084 | 0.453 |
| ALB(g/L) | 0.187 | 0.092 |
| ALP(U/L) | 0.248 | 0.025 |
本研究中,ADLI组与非ADLI组相比,血清IL-1β水平升高,差异有统计学意义,血清IL-1β与ALT、AST存在相关性,且IL-1β水平诊断ADIL的AUC为0.889。由此可见,IL-1β会随着ADLI的发生而升高。IL-1β主要是由激活的单核巨噬细胞产生,但中性粒细胞、表皮细胞和内皮细胞在受到外界抗原刺激后也可合成与分泌IL-1β,其主要由Toll样受体/Nod样受体通路以及Caspase-1通路进行调节和激活,IL-1β是炎症放大启动因子,可促进炎性细胞的活化与聚集中性粒细胞[10]。关于pyroptosis与ADLI的研究虽未见报道,但已发现在脓毒症诱导小鼠急性肝损伤时,caspase-1表达升高,血清中IL-1β增加,升高的IL-1β加重肝细胞死亡[11]。苯并[a]芘诱导HL-7702人正常肝细胞损伤中,也发现caspase-1及IL-1β水平升高[12]。IL-1β主要作为促炎性介质激活和募集白细胞,尤其是中性粒细胞进入组织[13],可参与器官损伤过程[14]。在热应激诱导肝损伤的研究中发现,抑制IL-1β可降低肝脏中髓过氧化物酶(myeloperoxidase,MPO)活性并缓解肝损伤,表明IL-1β在触发中性粒细胞组织浸润和肝损伤中的重要作用。另外,用IL-1β抑制剂处理的大鼠显示出较低的血清ALT活性和肝脏组织学评分[5]。这些结果提示,在肝细胞受到损伤时伴随着IL-1β的释放,其在肝损伤中发病机制中起作用。本研究结果证明在ADLI过程中也伴随IL-1β的升高,为ADLI中抗IL-1β干预的研究奠定了基础。
IL-18也是T细胞介导肝损伤的媒介,在肝脏中不仅由库普弗细胞表达,也可由损伤的肝细胞合成[15]。IL-18的分泌可加剧代谢紊乱及免疫功能损伤,此外,IL-18还能促进T淋巴细胞的增殖和分化,直接介导肝细胞的损伤[16]。非酒精性脂肪肝病患者与正常人比较,血清IL-18水平升高,提示IL-18可能是脂肪变性损害和肝脏炎症中的一个重要发病因素[17]。然而,本研究中未观察到升高的IL-18。这可能是因为IL-18不是与ADLI关系密切的指标,可能仅在血清中瞬时释放,或在受影响的组织或炎症部位局部表达。迄今为止,在全基因组及转录组研究中尚未出现指示体内IL-1β释放的基因表达特征[18]。
总之,本研究表明血清IL-1β与ADLI有关联,在ADLI诊断中具有潜在价值。下一步需研究IL-1β促成ADLI的发病机制,探索IL-1β在ADLI中靶向治疗的可能性。
| [1] |
CAO J, MI YJ, SHI CL, et al. First-line anti-tuberculosis drugs induce hepatotoxicity:a novel mechanism based on a urinary metabolomics platform[J]. Biochem Biophys Res Commun, 2018, 497(2): 485-491. DOI:10.1016/j.bbrc.2018.02.030 |
| [2] |
YANG MM, ZHANG HP, TAO BL, et al. Possible association of HMOX1 and NQO1 polymorphisms with anti-tuberculosis druginduced liver injury:a matched case-control study[J]. J Clin Pharm Ther, 2019, 44(4): 534-542. DOI:10.1111/jcpt.12818 |
| [3] |
SUTTI S, TACKE F. Liver inflammation and regeneration in druginduced liver injury:sex matters![J]. Clin Sci, 2018, 132(5): 609-613. DOI:10.1042/CS20171313 |
| [4] |
ZHENG ZD, LI GR. Mechanisms and therapeutic regulation of pyroptosis in inflammatory diseases and cancer[J]. Int J Mol Sci, 2020, 21(4): 1456. DOI:10.3390/ijms21041456 |
| [5] |
GENG Y, MA Q, LIU YN, et al. Heatstroke induces liver injury via IL-1β and HMGB1-induced pyroptosis[J]. J Hepatol, 2015, 63(3): 622-633. DOI:10.1016/j.jhep.2015.04.010 |
| [6] |
中华人民共和国国家卫生和计划生育委员会. 肺结核诊断[J]. 传染病信息, 2017, 30(6): 1-12. DOI:10.3969/j.issn.1007-8134.2017.06.001 |
| [7] |
BÉNICHOU C. Criteria of drug-induced liver disorders. Report of an international consensus meeting[J]. J Hepatol, 1990, 11(2): 272-276. DOI:10.1016/0168-8278(90)90124-a |
| [8] |
IORGA A, DARA L, KAPLOWITZ N. Drug-induced liver injury:cascade of events leading to cell death, apoptosis or necrosis[J]. Int J Mol Sci, 2017, 18(5): 1422-0067. DOI:10.3390/ijms18051018 |
| [9] |
刘岳衡, 王慧. 细胞焦亡:程序性死亡研究新热点[J]. 临床与病理杂志, 2016, 36(7): 1006-1011. |
| [10] |
MRIDHA AR, WREE A, ROBERTSON AAB, et al. NLRP3 inflammasome blockade reduces liver inflammation and fibrosis in experimental NASH in mice[J]. J Hepatol, 2017, 66(5): 1037-1046. DOI:10.1016/j.jhep.2017.01.022 |
| [11] |
CHEN YL, XU G, LIANG X, et al. Inhibition of hepatic cells pyroptosis attenuates CLP-induced acute liver injury[J]. Am J Transl Res, 2016, 8(12): 5685-5695. |
| [12] |
YUAN L, LIU JY, DENG H, et al. Benzo[J]. J Agric Food Chem, 2017, 65(44): 9763-9773. DOI:10.1021/acs.jafc.7b03248 |
| [13] |
BAJT ML, FARHOOD A, JAESCHKE H. Effects of CXC chemokines on neutrophil activation and sequestration in hepatic vasculature[J]. Am J Physiol Gastrointest Liver Physiol, 2001, 281(5): G1188-G1195. DOI:10.1152/ajpgi.2001.281.5.G1188 |
| [14] |
HUEBENER P, PRADERE JP, HERNANDEZ C, et al. The HMGB1/RAGE Axis triggers neutrophil-mediated injury amplification following necrosis[J]. J Clin Invest, 2019, 130: 1802. DOI:10.1172/JCI126976 |
| [15] |
BU-ELSAAD N, EL-KAREF A. Protection against nonalcoholic steatohepatitis through targeting IL-18 and IL-1alpha by luteolin[J]. Pharmacol Rep, 2019, 71(4): 688-694. DOI:10.1016/j.pharep.2019.03.009 |
| [16] |
LIU XH, PAN ZY, SU DS, et al. Remifentanil ameliorates liver ischemia-reperfusion injury through inhibition of interleukin-18 signaling[J]. Transplantation, 2015, 99(10): 2109-2117. DOI:10.1097/TP.0000000000000737 |
| [17] |
VECCHIET J, FALASCA K, CACCIATORE P, et al. Association between plasma interleukin-18 levels and liver injury in chronic hepatitis C virus infection and non-alcoholic fatty liver disease[J]. Ann Clin Lab Sci, 2005, 35(4): 415-422. |
| [18] |
FURIE R, PETRI M, ZAMANI O, et al. A phaseⅢ, randomized, placebo-controlled study of belimumab, a monoclonal anti-body that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus[J]. Arthritis Rheum, 2011, 63(12): 3918-3930. DOI:10.1002/art.30613 |
 2020, Vol. 49
2020, Vol. 49