文章信息
- 闫楚凡, 王静, 张劲松
- YAN Chufan, WANG Jing, ZHANG Jinsong
- 过表达ATG4A对晶状体上皮细胞上皮-间质转化的影响
- Effect of autophagy-related gene 4A overexpression on epithelial-mesenchymal transformation in lens epithelial cells
- 中国医科大学学报, 2020, 49(5): 391-395
- Journal of China Medical University, 2020, 49(5): 391-395
-
文章历史
- 收稿日期:2019-10-13
- 网络出版时间:2020-05-07 10:45
2. 沈阳爱尔卓越眼科医院白内障中心, 沈阳 110001
2. Cataract Centre, Shenyang Aier Excellent Eye Hospital, Shenyang 110001, China
晶状体是位于玻璃体前的透明无血管组织,光线经其折射后在视网膜上形成清晰图像,因此晶状体透明度的维持对视力十分重要。晶状体包含晶状体上皮细胞和由其分化而来的纤维细胞2种细胞。在晶状体的赤道部上皮细胞中的细胞器逐渐退化,分化成纤维细胞并将其向晶状体核压缩,这个过程称为上皮-间质转化(epithelial-mesenchymal transformation,EMT)。随着年龄的增长,晶状体的体积和质量都在不断增大[1],由于氧化应激、紫外线照射等原因导致EMT过程发生障碍,可以导致晶状体浑浊并形成白内障,严重影响视力。
自噬是细胞内重要的分解代谢过程,是细胞质内的蛋白大分子和细胞器(线粒体、内质网等)被双层膜结构的自噬泡包裹并运送到溶酶体进行溶解消化的过程[2]。自噬通常分为巨自噬、微自噬和分子伴侣介导的自噬。其中巨自噬研究最广泛,本研究自噬为巨自噬。自噬可以影响多种生物学过程(增殖、凋亡等),GUGNONI等[3]认为自噬与EMT之间存在着复杂的相互作用关系,二者水平的提高可以帮助肿瘤细胞在极端条件下存活,而在这个过程中,细胞骨架和线粒体作为调控的功能中心起到了重要作用。但二者之间具体的相互作用机制目前尚不清楚。
目前已经报道30多种自噬相关基因,其中自噬相关基因4A(autophagy-related gene 4A,ATG4A)是一种半胱氨酸蛋白酶,可以在C-末端切割ATG8,暴露出的甘氨酸能够与磷脂酰乙醇胺(phosphatidyletha-nolamine,PE)结合形成ATG8-PE系统,该系统在自噬泡的形成过程中起到了重要的作用[4-5],但是该基因在EMT方面的作用尚不清楚。本研究通过细胞实验,探索ATG4A在晶状体上皮细胞EMT中的作用。
1 材料与方法 1.1 细胞株、试剂和仪器人晶状体上皮细胞HLE B3细胞株,购自美国ATCC公司,经细胞系短串联重复序列(short tandem repeat,STR)鉴定。ATG4A慢病毒质粒购于加拿大ABM公司。试剂和仪器包括DMSO(美国SIGMA公司),MEM培养液、双抗、胰蛋白酶、PBS(中国凯基公司),胎牛血清(FBS,澳洲AusGeneX公司),RNA iso Plus,cDNA反转录试剂盒、RT-PCR试剂盒(日本TaKaRa公司),Trixon X-100(中国Solarbio公司),4%多聚甲醛(中国博士德公司),SDS-PAGE胶(中国碧云天公司),PCR逆转录仪(美国BIO-RAD公司),mRNA引物(中国Genecreate公司),RT-PCR仪(美国Applied Biosystem公司),荧光显微镜(日本Olympus公司)。
1.2 方法 1.2.1 细胞培养将HLE B3细胞冻存管从-80 ℃冰箱中取出,迅速放入37 ℃水浴锅中摇晃至融化,将其放入离心机中1 000 r/min离心3 min,弃掉上清并加入1 mL完全培养基,吹打至单细胞悬液后移至中皿(直径=6 cm)中,另加入4 mL完全培养基并吹打均匀。弃去旧培养基,PBS冲洗2次并加入新完全培养基(中皿)继续培养。待细胞长至密度为80%~90%时,用0.25%胰蛋白酶液消化,收集细胞后加入新鲜完全培养基铺皿并吹打均匀,按1:3比例传代培养。细胞冻存液(完全培养基:FBS:DMSO=7:2:1)冻存细胞。正常完全培养基培养细胞为对照组,H2O2浓度200 μmol/L培养细胞为实验组。
1.2.2 ATG4A慢病毒质粒转染引物序列包括CMV,5’-CGCAAATGGGCGGTAGGCGTG-3’;SV40,5’-TAGTCAGCCATGGGGCGGAGA-3’,将细胞传代至6孔板中,取对数生长期HLE B3细胞待其密度至50%时换无血清无双抗培养基培养24 h,弃掉培养基,加入在室温下静置了20 min的转染混合液(4 μg质粒DNA,10 μL LipoGeneTM 2000 Star转染液和0.5 ml Opti-MEM),另加入2 mL Opti-MEM并在培养箱中培育6 h,弃转染混合液并换完全培养基培养48 h后进行下一步实验。转染ATG4A质粒的人晶状体上皮细胞为过表达ATG4A组(OE-ATG4A组),转染空载体的人晶状体上皮细胞为阴性对照组(NC组)。
1.2.3 实时qPCR检测各组细胞中EMT分别提取经H2O2处理24 h后正常培养的细胞以及转染36 h后的细胞的总RNA,并用反转录试剂盒将得到的RNA反转录为cDNA,利用实时PCR试剂盒进行实时qPCR反应,操作步骤遵循说明书。所用引物序列如下:ATG4A,上游引物5’-aatggcacaaatgggtgtagg-3’,下游引物5’-ccaaggaattccattcgtcaa-3’;VIM,上游引物5’-agagaggaagccgaaaacacc-3’,下游引物5’-gattccactttgcgttcaagg-3’;E-cadherin,上游引物5’-tgctgtttcttcggaggagag-3’,下游引物5’-gcagctggctcaagtcaaagt-3’。
1.2.4 Western blotting检测各组细胞中EMT细胞转染48 h后,利用蛋白快速提取试剂盒提取总蛋白,使用BCA法测定蛋白浓度。利用SDS-PAGE胶分离蛋白,并通过湿转膜方式将蛋白质转移到PVDF膜上。用5%脱脂奶粉室温封闭2 h,用ATG4A(1:1 000),VIM(1:2 000),E-cadherin(1:5 000)4 ℃摇床上过夜孵育,GAPDH(1:10 000)作为内参对照,将孵育过一抗的PVDF膜用山羊抗兔二抗(1:2 000)室温下摇床上孵育2 h,使用化学发光检测液进行显影。
1.2.5 DCFH-DA活性氧荧光探针检测各组HLE B3细胞内活性氧(reactive oxygen species,ROS)水平HLE B3细胞提前传代至6孔板中,并转染ATG4A质粒和空载体。胰蛋白酶消化细胞至15 mL离心管中,用10 μmol/L DCFH-DA标记细胞于37 ℃中20 min,每隔3~5 min颠倒混匀。用无血清培养基洗涤细胞3次后,用流式细胞仪分析2组细胞中ROS水平。
1.3 统计学分析采用SPSS 23.0软件进行统计学分析,本研究中测量指标的计量资料经K-S检验呈正态分布,以x±s表示;2组比较采用独立样本t检验,P < 0.05为差异有统计学意义。
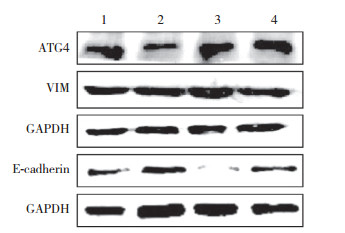
2 结果 2.1 H2O2模型中晶状体上皮细胞的EMT水平使用实时qPCR和Western blotting方法分别从mRNA和蛋白水平检测H2O2对EMT水平的影响,结果发现,与对照组比较,在mRNA水平波形蛋白(vimentin,VIM)表达量上升,E-钙黏蛋白表达量下降,差异有统计学意义(P < 0.05),说明EMT水平明显加强。但蛋白水平表达均无明显变化,差异无统计学意义(P > 0.05)。见表 1、图 1。
| Group | ATG4A mRNA | VIM mRNA | E-cadherin mRNA | ATG4A protein | VIM protein | E-cadherin protein |
| H2O2 | 2.858±0.188 | 5.147±0.3221) | 0.354±0.1371) | 2.150±0.077 | 0.962±0.004 | 1.101±0.011 |
| Control | 1.003±0.079 | 1.000±0.025 | 1.001±0.027 | 1.000±0.020 | 1.000±0.020 | 1.003±0.059 |
| OE-ATG4A | 4.927±0.4112) | 1.511±0.0662) | 0.435±0.0312) | 1.362±0.0302) | 1.462±0.0092) | 0.117±0.0172) |
| NC | 1.003±0.077 | 1.001±0.043 | 1.000±0.005 | 1.000±0.002 | 1.000±0.019 | 1.000±0.062 |
| 1)P < 0.05 vs control group; 2)P < 0.05 vs NC group. | ||||||
|
| 1, H202 group; 2, control group; 3, OE-ATG4A group; 4, NC group. 图 1 Western blotting检测H2O2与ATG4A对HL E B3细胞EMT水平的影响 Fig.1 Western blotting analysis for evaluating the effects of H2O2 and ATG4A on EMT in HLE B3 cells |
2.2 过表达ATG4A的晶状体上皮细胞中EMT水平
结果显示,在mRNA和蛋白水平,与NC组比较,OE-ATG4A组中VIM的表达量均升高,差异均有统计学意义(P < 0.05),而E-钙黏蛋白表达水平均显著降低,差异均有统计学意义(P < 0.05),见表 1、图 1。说明ATG4A能够促进EMT。
2.3 ATG4A过表达对晶状体上皮细胞中ROS水平的影响结果显示,与NC组(230.930±6.746)比较,OE-ATG4A组(233.190±7.099)晶状体上皮细胞内平均荧光强度并没有显著增强,差异无统计学意义(P > 0.05),见图 2。本实验中没有发现过表达ATG4A能够促进晶状体上皮细胞中ROS的水平,该表型还需要进一步验证。

|
| A, OE-ATG4A group; B, NC group. 图 2 ATG4A对HL E B3细胞中ROS水平的影响 Fig.2 The effect of ATG4A on ROS level in HL.E B3 cells |
3 讨论
白内障是世界范围内致盲的首要原因[6],它的形成受多种条件因素(紫外线、氧化应激、激素不良反应等)影响。这些影响因素通过促进或者抑制相关基因表达,使晶状体上皮细胞增殖、凋亡、EMT异常,进而导致白内障的发生。用H2O2处理晶状体上皮细胞,构建的年龄相关性白内障模型被广泛应用于晶状体的发生发展与白内障形成的研究中[7]。
晶状体中有多种酶存在,具有缓解或阻止蛋白质等大分子异常聚集,维持晶状体透明性作用[8],而ATG4A是自噬基因中唯一的蛋白酶[9]。本研究结果显示,在mRNA和蛋白水平均发现H2O2处理的人晶状体上皮细胞中ATG4A表达量显著升高,说明ATG4A能够影响晶状体上皮细胞的发育。
目前关于ATG4A的研究主要集中于其对肿瘤发生发展的影响。YANG等[10]研究表明ATG4A在胃肠道肿瘤细胞中高表达,能够促进胃肠道肿瘤细胞的侵袭、迁移以及代谢。WOLF等[11]发现ATG4A能够维持乳腺癌细胞的干细胞特性。ATG4A在肺癌[12]、子宫颈癌[13]中的作用也陆续被发现,但在晶状体发生发展与白内障形成中的作用尚不清楚。本研究发现,在过表达ATG4A的人晶状体上皮细胞中,EMT水平明显升高,证明ATG4A对该表型有促进作用。
自噬与EMT的关系在眼科疾病中的研究较少,目前只集中于视网膜疾病,且多是细胞层面的实验。FENG等[14]在视网膜上皮细胞中构建EMT模型,发现自噬水平显著升高,而在该种细胞中通过敲除ATG7构建自噬缺陷模型后,发现视网膜上皮细胞失去了上皮细胞表型,说明自噬能够有效抑制视网膜上皮细胞中的EMT并加强细胞间连接。BAEK等[15]发现在视网膜上皮细胞中,KRT8和自噬水平升高能够抑制氧化应激引起的EMT,并阻止细胞死亡。WU等[16]发现在TGF-β诱导的视网膜上皮细胞EMT模型中,自噬的水平显著升高,而雷帕霉素诱导的自噬水平升高能进一步加强视网膜上皮细胞中的EMT水平。此结论与FENG等[14]的结论相反,说明自噬与EMT之间的相互作用关系十分复杂,即使在同一种细胞系中,不同的影响条件也会得出不同的结论。
疾病的发生不是单一的生物学过程,自噬和EMT水平的异常都能导致晶状体发育异常和白内障的形成,因此将二者结合研究对于维持晶状体上皮细胞的正常生长和分化是十分有意义的。本实验首次在人晶状体上皮细胞中将自噬相关基因与EMT水平联系起来,为研究白内障的形成提供了新的方向。
以往研究[17-18]认为ATG4A基因具有ROS依赖性,细胞内ROS的水平可以极大影响ATG4A的表达,然而本研究发现过表达ATG4A的人晶状体上皮细胞中,ROS水平与NC组相比差异无统计学意义(P > 0.05),说明ATG4A无法直接影响正常生长的晶状体上皮细胞中ROS的水平,但是ATG4A在病理条件下能否影响ROS的水平还需进一步探索。
综上所述,ATG4A对于晶状体上皮细胞的EMT水平具有促进作用,但无法直接影响细胞内的ROS水平。本研究利用细胞转染的方法构建ATG4A过表达的人晶状体上皮细胞模型,探索了ATG4A对人晶状体上皮细胞表型的影响,初步论证了ATG4A在晶状体发育和白内障形成过程中的作用。
| [1] |
AUGUSTEYN RC. Growth of the lens:in vitro observations[J]. Clin Exp Optom, 2008, 91(3): 226-239. DOI:10.1111/j.1444-0938.2008.00255.x |
| [2] |
NI ZH, GONG Y, DAI XF, et al. AU4S:a novel synthetic peptide to measure the activity of ATG4 in living cells[J]. Autophagy, 2015, 11(2): 403-415. DOI:10.1080/15548627.2015.1009773 |
| [3] |
GUGNONI M, SANCISI V, MANZOTTI G, et al. Autophagy and epithelial-mesenchymal transition:an intricate interplay in cancer[J]. Cell Death Dis, 2016, 7(12): e2520. DOI:10.1038/cddis.2016.415 |
| [4] |
MORISHITA H, MIZUSHIMA N. Autophagy in the lens[J]. Exp Eye Res, 2016, 144: 22-28. DOI:10.1016/j.exer.2015.08.019 |
| [5] |
LV W, SUI LL, YAN XN, et al. ROS-dependent ATG4 upregulation mediated autophagy plays an important role in Cd-induced proliferation and invasion in A549 cells[J]. Chem Biol Interact, 2018, 279: 136-144. DOI:10.1016/j.cbi.2017.11.013 |
| [6] |
PASCOLINI D, MARIOTTI SP. Global estimates of visual impairment:2010[J]. Br J Ophthalmol, 2012, 96(5): 614-618. DOI:10.1136/bjophthalmol-2011-300539 |
| [7] |
KONG DQ, LIU Y, LI L, et al. Downregulation of Smac attenuates H2O2-induced apoptosis via endoplasmic reticulum stress in human lens epithelial cells[J]. Medicine(Baltimore), 2017, 96(27): e7419. DOI:10.1097/MD.0000000000007419 |
| [8] |
RAJKUMAR S, PRAVEEN MR, GAJJAR D, et al. Activity of superoxide dismutase isoenzymes in lens epithelial cells derived from different types of age-related cataract[J]. J Cataract Refract Surg, 2008, 34(3): 470-474. DOI:10.1016/j.jcrs.2007.10.044 |
| [9] |
YANG Z, KLIONSKY DJ. Mammalian autophagy:core molecular machinery and signaling regulation[J]. Curr Opin Cell Biol, 2010, 22(2): 124-131. DOI:10.1016/j.ceb.2009.11.014 |
| [10] |
YANG SW, PING YF, JIANG YX, et al. ATG4A promotes tumor metastasis by inducing the epithelialmesenchymal transition and stem-like properties in gastric cells[J]. Oncotarget, 2016, 7(26): 39279-39292. DOI:10.18632/oncotarget.9827 |
| [11] |
WOLF J, DEWI DL, FREDEBOHM J, et al. A mammosphere formation RNAi screen reveals that ATG4A promotes a breast cancer stem-like phenotype[J]. Breast Cancer Res, 2013, 15(6): R109. DOI:10.1186/bcr3576 |
| [12] |
HE Q, LU YY, HU SL, et al. An intron SNP rs807185 in ATG4A decreases the risk of lung cancer in a southwest Chinese population[J]. Eur J Cancer Prev, 2016, 25(4): 255-258. DOI:10.1097/CEJ.0000000000000174 |
| [13] |
MAO JJ, WU LX, WANG W, et al. Nucleotide variation in ATG4A and susceptibility to cervical cancer in Southwestern Chinese women[J]. Oncol Lett, 2018, 15(3): 2992-3000. DOI:10.3892/ol.2017.7663 |
| [14] |
FENG H, ZHAO X, GUO Q, et al. Autophagy resists EMT process to maintain retinal pigment epithelium homeostasis[J]. Int J Biol Sci, 2019, 15(3): 507-521. DOI:10.7150/ijbs.30575 |
| [15] |
BAEK A, YOON S, KIM J, et al. Autophagy and KRT8/keratin 8 protect degeneration of retinal pigment epithelium under oxidative stress[J]. Autophagy, 2017, 13(2): 248-263. DOI:10.1080/15548627.2016.1256932 |
| [16] |
WU J, CHEN X, LIU X, et al. Autophagy regulates TGF-beta2-induced epithelial-mesenchymal transition in human retinal pigment epithelium cells[J]. Mol Med Rep, 2018, 17(3): 3607-3614. DOI:10.3892/mmr.2017.8360 |
| [17] |
LI YC, LUO QY, YUAN L, et al. JNK-dependent ATG4 upregulation mediates asperphenamate derivative BBP-induced autophagy in MCF-7 cells[J]. Toxicol Appl Pharmacol, 2012, 263(1): 21-31. DOI:10.1016/j.taap.2012.05.018 |
| [18] |
SCHERZ-SHOUVAL R, SHVETS E, FASS E, et al. Reactive oxygen species are essential for autophagy and specifically regulate the activity of ATG4[J]. EMBO J, 2007, 26(7): 1749-1760. DOI:10.15252/embj.2019101812 |
 2020, Vol. 49
2020, Vol. 49