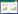文章信息
- 赵哲明, 裴俊鹏, 姜洪磊, 张春东, 金俊哲, 戴冬秋
- ZHAO Zheming, PEI Junpeng, JIANG Honglei, ZHANG Chundong, JIN Junzhe, DAI Dongqiu
- 淋巴结比率用于Ⅲ期直肠癌患者的预后评价
- Lymph node ratio for evaluating the prognosis of patients with stageⅢ rectal cancer
- 中国医科大学学报, 2020, 49(3): 258-263
- Journal of China Medical University, 2020, 49(3): 258-263
-
文章历史
- 收稿日期:2019-02-26
- 网络出版时间:2020-03-17 9:11
直肠癌是最常见的恶性肿瘤之一[1]。淋巴结状态是评估直肠癌患者预后的重要危险因素之一,对指导患者术后治疗有重要意义。美国癌症联盟/国际抗癌联盟(American joint committee on cancer/union for international cancer comtrol,AJCC/UICC)的N分期系统,是基于阳性淋巴结(positive lymph nodes,pLN)的绝对数进行分期。目前,该系统的精准性仍存争议[2-3]。有研究[4-5]表明,pLN与淋巴结检取总数(dissected lymph nodes,DLNs)呈显著相关性,并且DLNs不足时容易导致pLN检出率下降,产生分期偏移现象。在此背景下,有学者[3, 6-7]又提出基于阳性淋巴结比率(lymph nodes positive rate,LNR)和阳性淋巴结对数比率(log odds of positive lymph nodes,LODDS)2种淋巴结分期方法。本研究拟评价以上3种淋巴结分期方法对新辅助放疗后的Ⅲ期直肠癌患者生存预测的准确性,以确定最佳的淋巴结分期方法。
1 材料与方法 1.1 一般资料回顾性分析美国国立癌症研究所监测、流行病学和结果SEER数据库部分直肠癌患者的临床数据。SEER数据库收集并公布基于人群的癌症登记处的癌症发病率、患病率和生存率数据,约占美国总人口的26%。从SEER的数据库中筛选从2004年至2009年行新辅助放疗后的Ⅲ期直肠癌患者。纳入标准:(1)直肠腺癌;(2)分期信息完整;(3)存在淋巴结转移;(4)手术切除;(5)术前行新辅助放疗;(6)原发部位在直肠,且为唯一肿瘤;(7)已知总生存时间和死因。排除仅行局部肿瘤切除或无法获得详细病理信息的病例。
1.2 淋巴结分期方法根据第8版UICC/AJCC基于转移淋巴结数量(N分期)将患者分为4组:N0,无淋巴结转移(本研究未纳入);N1a,1个阳性淋巴结;N1b,2~3个阳性淋巴结;N2a,4~6个阳性淋巴结;N2b,≥ 7个阳性淋巴结。LNR分期方法根据ROSENBERG等[3]的临界值分为4组:0.01 ≤ LNR1 < 0.18;0.18 ≤ LNR2 < 0.42;0.42 ≤ LNR3 < 0.70;LNR4 ≥ 0.70。LODDS分期方法采用WANG等[6]的临界值,分为4组:LODDS0 < -2.2(本研究未纳入);-2.2 ≤ LODDS1 < -1.1;-1.1 ≤ LODDS2 < 0.0;0.0 ≤ LODDS3 < 1.1;LODDS4 ≥ 1.1。由于本研究纳入人群为Ⅲ期直肠癌患者,排除没有淋巴结转移的患者。因此,N分期中缺失N0亚组,LODDS分期缺失LODDS0亚组。
1.3 统计学分析根据寿命表法计算5年总生存率,并用log-rank检验评估组间统计学差异,利用Kaplan-Meier方法绘制生存曲线。所有在单变量分析中有统计学差异的参数都纳入多变量Cox比例风险模型中,以确定预后独立危险因素。3种分期方法分别纳入,避免各分期方法之间相互干扰:第1步只将N分期纳入,第2步将LNR分期纳入,第3步再将LODDS分期纳入。似然比χ2检验用于评估组间同质性,线性趋势χ2检验用来比较各分期系统间辨别能力和单调性,数值越大表明对应模型的同质性、辨别力和单调性越好。利用受试者工作特征(receiver operating characteristic curve,ROC)曲线计算曲线下面积(area under the curve,AUC),利用AUC和Akaike信息标准(akaike information ceiterion,AIC)比较不同分期方法预后评估的准确性(图 1)。AUC = 0.5表示没有预测能力,AUC = 1表示具有完全区分能力。通常,具有低AIC值的预测模型表示更好的模型拟合,而高AUC值表示模型具有更好的区分能力。所有分析均使用SPSS 22.0和R 3.5.1软件进行分析。双尾检验P < 0.05为差异有统计学意义。
|
| A, total population; B, insufficient lymph node detection; C, sufficient lymph node detection. 图 1 ROC曲线 Fig.1 ROC curve |
2 结果 2.1 病理特征
共9 616例患者符合纳入条件,包括5 477例男性(57.0%),中位年龄为47岁(28~74)。淋巴结检取数和阳性淋巴结数分别为17.4±7.9和4.4±4.9,淋巴结检取不充足(n < 12)的患者2 817例(29.3%)。T2期和T3期患者分别为14.6%和70.7%。在单因素分析中,诊断年龄、组织学分级、肿瘤的大小、T分期、淋巴结检取数是否充足,以及3种淋巴结分期方法都与患者总生存率显著相关,有统计学差异(P < 0.05),见表 1、2。
| Variables | n (%) | 5-year OS (%) | P |
| Age (year) | < 0.001 | ||
| ≤65 | 5 789(60.2) | 65.7 | |
| > 65 | 3 827(39.8) | 55.2 | |
| Gender | 0.446 | ||
| Male | 5 477(57.0) | 61.2 | |
| Female | 4 139(43.0) | 62.0 | |
| Histologic grade | < 0.001 | ||
| Well differentiated | 472(4.9) | 69.5 | |
| Moderately differentiated | 7 023(73.0) | 64.0 | |
| sPoorly differentiated | 1 958(20.4) | 52.4 | |
| Undifferentiated | 163(1.7) | 43.3 | |
| Tumor size (cm) | < 0.001 | ||
| ≤5 | 6 787(60.2) | 64.1 | |
| > 5 | 3 827(39.8) | 55.3 | |
| T stage (AJCC) | < 0.001 | ||
| T1 | 459(4.8) | 78.3 | |
| t2 | 401 (14.6) | 77.0 | |
| T3 | 6 802(70.7) | 59.5 | |
| T4 | 954(9.9) | 45.4 | |
| DLNs | < 0.001 | ||
| Inadequate (n < 12) | 2 817(29.3) | 51.3 | |
| Adequate (n≥12) | 6 799(70.7) | 61.6 | |
| N stage (AJCC) | < 0.001 | ||
| N1a | 3 019(31.4) | 68.8 | |
| N1b | 2 963(30.8) | 65.0 | |
| N2a | 1 960(20.4) | 58.3 | |
| N2b | 1 674(17.4) | 46.6 | |
| LNR stage | < 0.001 | ||
| LNR1 | 4 478(46.6) | 69.4 | |
| LNR2 | 2 925(30.4) | 61.1 | |
| LNR3 | 1 357(14.1) | 50.7 | |
| LNR4 | 856(8.9) | 40.6 | |
| LODDS stage | < 0.001 | ||
| LODDS1 | 766(8.0) | 75.1 | |
| LODDS2 | 7 041(73.2) | 64.5 | |
| LODDS3 | 1 675 (17.4) | 46.9 | |
| LODDS4 | 134(1.4) | 23.2 |
| Variables | The first step | The second step | The third step | ||||||||
| HR | 95% CI | P | HR | 95% CI | P | HR | 95% CI | P | |||
| Age (year) | 1.04 | 1.04-1.04 | < 0.001 | 1.04 | 1.04-1.04 | < 0.001 | 1.04 | 1.04-1.04 | < 0.001 | ||
| Histologic grade | 1.23 | 1.16-1.30 | < 0.001 | 1.20 | 1.13-1.27 | < 0.001 | 1.22 | 1.15-1.29 | < 0.001 | ||
| Tumor size (cm) | 1.22 | 1.14-0.31 | < 0.001 | 1.24 | 1.61-1.33 | < 0.001 | 1.26 | 1.18-1.35 | < 0.001 | ||
| T stage | 1.47 | 1.38-1.55 | < 0.001 | 1.45 | 1.37-1.54 | < 0.001 | 1.48 | 1.40-1.56 | < 0.001 | ||
| DLNs | 0.89 | 0.83-0.96 | 0.001 | 1.16 | 1.08-1.25 | < 0.001 | 0.89 | 0.83-0.95 | 0.001 | ||
| N stage | 1.24 | 1.20-1.28 | < 0.001 | - | - | - | - | - | - | ||
| LNR stage | - | - | - | 1.35 | 1.31-1.39 | < 0.001 | - | - | - | ||
| LODDS stage | - | - | - | - | - | - | 1.65 | 1.56-1.74 | < 0.001 |
2.2 3种淋巴结分期方法与患者生存率的关系
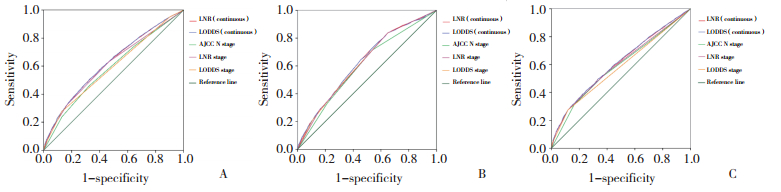
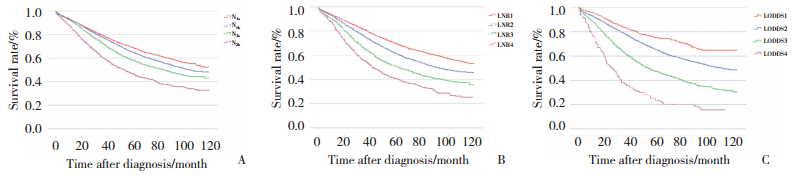
3种淋巴结分期方法作为分类变量的Kaplan-Meier生存分析(图 2)显示,随着分期的递增,3种分期系统患者的5年生存率都逐渐下降。3种分期系统中,各亚组的5年生存率之间差异都有统计学差异(P < 0.05)。创建LODDS与阳性淋巴结数或阳性淋巴结比率间关系的散点图(图 3)。LODDS值随着LNR的增加而增加,表明LODDS和LNR之间关系密切。当LNR为1时,LODDS分期具有异质性,表明LNR在1附近时,相同的LNR分期的患者具有不同的存活率。
|
| A, AJCC N staging; B, LNR staging; C, LODDS staging. 图 2 3种分期方法Kaplan-Meier曲线 Fig.2 Kaplan-Meier curve of three staging methods |
|
| A, the scatter plots of LODDS vs LNR; B, the magnified view of A for LNR between 0.75 to 1. 图 3 散点图 Fig.3 Scatter plot |
2.3 3种淋巴结分期方法的预后准确性比较
采用线性趋势χ2检验评估各分期方法中梯度的辨别能力和单调性,采用似然比χ2检验评估同质性,采用AIC值和AUC值比较各系统之间的预后能力。检取淋巴结总数是否充足对于患者的5年总生存率有统计学差异(P < 0.05)。据此,本研究将患者分成2组,分别为淋巴结检取不充足组(n < 12)和淋巴结检取充足组(n ≥ 12)。当将LNR和LODDS作为连续变量时,无论淋巴结检取数是否充足,LNR与LODDS都有良好的预测预后的能力(表 3)。而将LNR和LODDS作为分类变量时,无论淋巴结检取数是否充足,LNR分期方法都有更高的AUC、线性趋势χ2检验值和似然比χ2检验值,以及更低的AIC值,表明LNR分期方法的亚组间同质性、辨别力和单调性更好,具有更好的模型拟合及区分能力,能够更精准的预测患者的预后。在总人群中,LNR和LODDS分期方法均优于N分期。当淋巴结检取数不充足时,LNR分期方法具有比N分期更高的AUC、线性趋势χ2检验值和似然比χ2检验值,更低的AIC值,表明当淋巴结检取总数不充足时,LNR分期方法在预测预后方面强于N分期方法。
| Variables | Linear-trend chi-square | Likelihood ratio chi-square | AIC | AUC |
| ALL Patients | ||||
| LNR | 94.57 | 445.89 | 66 930.97 | 0.621 |
| LODDS | 93.79 | 464.74 | 66 899.16 | 0.622 |
| N stage | 81.38 | 314.41 | 67 078.87 | 0.584 |
| LNR | 81.70 | 431.75 | 66 961.53 | 0.608 |
| LODDS | 81.35 | 416.09 | 66 977.19 | 0.589 |
| n < 12 | ||||
| LNR | 7.72 | 101.19 | 17 652.00 | 0.627 |
| LODDS | 5.68 | 111.20 | 17 634.18 | 0.627 |
| N stage | 5.99 | 73.47 | 17 671.54 | 0.601 |
| LNR | 7.58 | 103.51 | 17 638.21 | 0.622 |
| LODDS | 1.87 | 97.19 | 17 643.17 | 0.620 |
| n≥12 | ||||
| LNR | 126.65 | 378.90 | 44 492.31 | 0.607 |
| LODDS | 121.27 | 377.47 | 44 493.21 | 0.608 |
| N stage | 78.02 | 251.08 | 44 585.60 | 0.586 |
| LNR | 116.68 | 368.14 | 44 511.65 | 0.597 |
| LODDS | 101.83 | 350.88 | 44 535.04 | 0.579 |
3 讨论
淋巴结状态是预测直肠癌患者预后及制定术后治疗方案的关键因素[8]。目前,第8版AJCC/UICC的N分期仍然是应用最广泛的淋巴结分期方法,但该分期方法的精确性仍值得商榷[2-3]。有研究[9]表明,pN与DLNs有明显的相关性,而DLNs受外科医生技能、区域淋巴结实际数量、淋巴结清扫及检取数的影响。LNR分期系统综合考虑了pLNs和DLNs因素,被认为是新辅助放疗后直肠癌患者重要预后因素[10-12]。有研究[5]认为,LNR亦具有局限性,即当所有DLNs都发生转移时,相同LNR值的患者总生存率有异质性。LODDS在胃癌和乳腺癌中已被证明受DLNs的影响更小,能有效降低分期偏移[13-14]。PERSIANI等[6]证明LODDS是结肠癌一个独立的预后因素,其比pN和LNR分期方法更能准确地评估结肠癌患者预后,且受DLNs的影响更小,能够进一步降低分期偏移。
本研究利用AIC值和AUC值评估当前3种淋巴结分期方法的相对判别能力。当淋巴结状态作为连续变量时,LNR与LODDS具有相似的预测预后能力,且不受DLNs数量的影响。而当淋巴结状态作为分类变量时,LNR分期方法表现最佳,截断值(cutoff值)是造成这种差异的主要原因。不同的研究者使用不同的统计方法,用来确定每个淋巴结分期方法的理想cut-off值。例如,SONG等[15]利用log-rank统计方法、ROSENBERG等[3]利用分类和回归树技术、BERGER等[9]利用四分位数法、KORNPRAT等[16]利用ROC统计方法以及WANG等[6]利用X-tile程序。以上是计算cut-off值的代表性方法,cut-off值的多样性,制约着其在临床上的应用。因此,最佳cut-off值若能达成共识,对于临床应用极其重要。导致cut-off值异质性的原因有很多,SPOLVERATO等[17]认为,不同的统计方法、数据类型和淋巴结检取的数量差异可以部分地解释异质性来源。因此,最好将淋巴结状态设定为连续变量,以揭示其真实的预测能力。
除淋巴结状态外,淋巴结检取数是否充足亦被证实是影响直肠癌患者预后的重要因素之一[18]。NCCN指南推荐,为了进行准确的分期,淋巴结检取数应至少12枚,本研究中淋巴结检取不充分的患者占29.3%。因此,本研究基于淋巴结检取是否充足进行了亚组分析,以研究不同淋巴结分期方法预测预后的精准性。当作为分类变量分析时,无论被检淋巴结是否充足,LNR都是最佳预后模型,LODDS次之,N分期较差。当作为连续变量进行分析时,无论淋巴结检取数是否充足,LNR与LODDS分期方法预测预后的精准性相近。考虑到新辅助治疗可能会减少淋巴结检取总数,从而影响淋巴结分期系统的准确性[19]。因此,对于Ⅲ期新辅助放疗后行直肠癌手术的患者而言,LNR分期方法是潜在的预测预后最可靠的淋巴结分期方法。
本研究亦存在一定的局限性。首先,本研究是基于SEER数据库的一项回顾性研究。其次,SEER数据库缺乏一些重要的临床信息,包括新辅助治疗的完整信息,手术方式和转移淋巴结的具体位置等。而此研究的样本量大、随访时间长等优点,又可以部分弥补此类缺陷。
综上,LNR分期方法有望成为AJCC/UICC分期系统中N分期的补充或替代的淋巴结分期方法,其可以更加精准预测新辅助放疗后Ⅲ期直肠癌术后患者预后信息,从而为患者术后进一步治疗制定方案提供重要依据。但是,在LNR分期方法中,最佳cutoff值仍需要进一步确认并达成共识。
| [1] |
SIEGEL RL, MILLER KD, FEDEWA SA, et al. Colorectal cancer statistics, 2017[J]. CA:Cancer J Clin, 2017, 67(3): 177-193. DOI:10.3322/caac.21395 |
| [2] |
LYKKE J, JESS P, ROIKJAER O, et al. The prognostic value of lymph node ratio in a national cohort of rectal cancer patients[J]. Eur J Surg Oncol, 2016, 42(4): 504-512. DOI:10.1016/j.ejso.2016.01.012 |
| [3] |
ROSENBERG R, FRIEDERICHS J, SCHUSTER T, et al. Prognosis of patients with colorectal cancer is associated with lymph node ratio:a single-center analysis of 3, 026 patients over a 25-year time period[J]. Ann Surg, 2008, 248(6): 968-978. DOI:10.1097/SLA.0b013e318190eddc |
| [4] |
JOSEPH NE, SIGURDSON ER, HANLON AL, et al. Accuracy of determining nodal negativity in colorectal cancer on the basis of the number of nodes retrieved on resection[J]. Ann Surg Oncol, 2003, 10(3): 213-218. DOI:10.1245/aso.2003.03.059 |
| [5] |
TSAI HL, LU CY, HSIEH JS, et al. The prognostic significance of total lymph node harvest in patients with T2-4N0M0 colorectal cancer[J]. J Gastrointest Surg, 2007, 11(5): 660-665. DOI:10.1007/s11605-007-0119-x |
| [6] |
WANG JP, HASSETT JM, DAYTON MT, et al. The prognostic superiority of log odds of positive lymph nodes in stageⅢcolon cancer[J]. J Gastrointest Surg, 2008, 12(10): 1790-1796. DOI:10.1007/s11605-008-0651-3 |
| [7] |
PERSIANI R, CANANZI FC, BIONDI A, et al. Log odds of positive lymph nodes in colon cancer:a meaningful ratio-based lymph node classification system[J]. World J Surg, 2012, 36(3): 667-674. DOI:10.1007/s00268-011-1415-x |
| [8] |
BRENNER H, KLOOR M, POX CP. Colorectal cancer[J]. Lancet, 2014, 383(9927): 1490-1502. DOI:10.1016/s0140-6736(13)61649-9 |
| [9] |
BERGER AC, SIGURDSON ER, LEVOYER T, et al. Colon cancer survival is associated with decreasing ratio of metastatic to examined lymph nodes[J]. J Clin Oncol, 2005, 23(34): 8706-8712. DOI:10.1200/JCO.2005.02.8852 |
| [10] |
KOO T, SONG C, KIM JS, et al. Impact of lymph node ratio on oncologic outcomes in ypStageⅢrectal cancer patients treated with neoadjuvant chemoradiotherapy followed by total mesorectal excision, and postoperative adjuvant chemotherapy[J]. PLoS One, 2015, 10(9): e0138728. DOI:10.1371/journal.pone.0138728 |
| [11] |
LI QG, LI DW, ZHUO CH, et al. Metastatic lymph node ratio can further stratify prognosis in rectal cancer patients treated with preoperative radiotherapy:a population-based analysis[J]. Tumour Biol, 2014, 35(7): 6389-6395. DOI:10.1007/s13277-014-1817-0 |
| [12] |
PARK IJ, YU CS, LIM SB, et al. Ratio of metastatic lymph nodes is more important for rectal cancer patients treated with preoperative chemoradiotherapy[J]. World J Gastroenterol, 2015, 21(11): 3274-3281. DOI:10.3748/wjg.v21.i11.3274 |
| [13] |
CHEN LJ, CHUNG KP, CHANG YJ, et al. Ratio and log odds of positive lymph nodes in breast cancer patients with mastectomy[J]. Surg Oncol, 2015, 24(3): 239-247. DOI:10.1016/j.suronc.2015.05.001 |
| [14] |
SUN Z, XU Y, LI DM, et al. Log odds of positive lymph nodes:a novel prognostic indicator superior to the number-based and the ratio-based N category for gastric cancer patients with R0 resection[J]. Cancer, 2010, 116(11): 2571-2580. DOI:10.1002/cncr.24989 |
| [15] |
SONG YX, GAO P, WANG ZN, et al. Which is the most suitable classification for colorectal cancer, log odds, the number or the ratio of positive lymph nodes?[J]. PLoS One, 2011, 6(12): e28937. DOI:10.1371/journal.pone.0028937 |
| [16] |
KORNPRAT P, POLLHEIMER MJ, LINDTNER RA, et al. Value of tumor size as a prognostic variable in colorectal cancer:a critical reappraisal[J]. Am J Clin Oncol, 2011, 34(1): 43-49. DOI:10.1097/COC.0b013e3181cae8dd |
| [17] |
SPOLVERATO G, EJAZ A, KIM Y, et al. Prognostic performance of different lymph node staging systems after curative intent resection for gastric adenocarcinoma[J]. Ann Surg, 2015, 262(6): 991-998. DOI:10.1097/SLA.0000000000001040 |
| [18] |
KIDNER TB, OZAO-CHOY JJ, YOON J, et al. Should quality measures for lymph node dissection in colon cancer be extrapolated to rectal cancer?[J]. Am J Surg, 2012, 204(6): 843-847. DOI:10.1016/j.amjsurg.2012.05.003 |
| [19] |
BAXTER N, MORRIS A, ROTHENBERGER D, et al. Impact of preoperative radiation for rectal cancer on subsequent lymph node evaluation:a population-based analysis[J]. Int J Radiat Oncol Biol Phys, 2005, 61(2): 426-431. DOI:10.1016/j.ijrobp.2004.06.259 |
 2020, Vol. 49
2020, Vol. 49