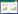文章信息
- 郑启智, 赵劲博, 盛伟伟, 周建平, 董明
- ZHENG Qizhi, ZHAO Jinbo, SHENG Weiwei, ZHOU Jianping, DONG Ming
- TMEM206促进表皮生长因子诱导的结直肠癌上皮-间质转化
- TMEM206 promotes epidermal growth factor-induced epithelial-mesenchymal transition in colorectal cancer cells
- 中国医科大学学报, 2020, 49(3): 224-229
- Journal of China Medical University, 2020, 49(3): 224-229
-
文章历史
- 收稿日期:2018-03-15
- 网络出版时间:2020-03-17 14:51
结直肠癌是最常见的恶性肿瘤和癌症相关死亡原因之一, 目前在全世界范围内其发病率和死亡率仍较高[1]。结直肠癌的发生、发展是一个多基因、多阶段、长期形成的复杂病变过程, 局部侵袭和远处转移是导致结直肠癌患者死亡的最重要因素[2]。上皮-间质转化(epithelial-mesenchymal transition, EMT)被认为是影响结直肠癌侵袭、转移的重要作用机制之一。生长因子如转化生长因子β (transforming growth factor-β, TGF-β)、表皮生长因子(epidermal growth factor, EGF)等介导EMT的发生, 同时TGF-β、Wnt、Notch等多种信号通路相互交错调控EMT的过程[3]。跨膜蛋白(transmembrane protein, TMEM)家族成员被证实在肿瘤发生、发展中起重要作用[4-5]。而本课题组前期研究[6]表明, TMEM206过表达可通过与AKT和细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)信号通路相互作用, 促进结直肠癌的恶性进展。本研究的目的是探讨TMEM206影响结直肠癌EMT的机制。
1 材料与方法 1.1 材料人结直肠癌细胞系HCT116和SW480 (中科院上海细胞库), TMEM206兔抗人多克隆抗体(英国Abcam公司), pCMV6、pCMV6-Myc-DDK-206 (RC202838) (美国OriGene公司), Lipofectamine 3000 (美国Invitrogen公司), PVDF膜(美国Millipore公司), p-ERK和c-Myc抗体(美国Cell Signaling Technology公司), 纤连蛋白(Fibronectin)、Zeb1、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、Snail1、Snail2和β-actin抗体(美国Proteintech公司), 二抗(中国中杉金桥), IgG抗体(美国Santa Cruz公司), 磁珠(美国Bio-Rad公司), EGF (美国Proteintech公司), 牛血清白蛋白(美国Sigma公司), 24孔板(美国Corning Costar公司), 基质胶(美国BD Biosciences公司)。
1.2 方法 1.2.1 细胞培养HCT116、SW480细胞均使用RPMI 1640培养基(含10%胎牛血清和100 IU/mL青-链霉素), 置于37 ℃、5%CO2的孵箱中培养, 隔天消化传代。
1.2.2 细胞转染用Lipofectamine 3000等相关转染试剂作为溶液, 分别使用TMEM206质粒和NC-PCMV6空载质粒对HCT116、SW480细胞进行转染, 将细胞分为TMEM206 (206组)和对照组(NC组)。将2种细胞接种至6孔板后, 在细胞密度约为60%时, 将相容的质粒和Lipofectamine 3000、p3000加入, 细胞培养8 h后用于其他实验。
1.2.3 EMT构建质粒转染后的2种细胞用50 ng/mL EGF在48~72 h内处理2次。使用1%牛血清白蛋白为对照, 分为NC组、206组、NC+EGF组和206+EGF组, 用含有1%胎牛血清的推荐生长培养基培养细胞, 以增强EGF的作用。
1.2.4 Western blotting收集进行上述EMT构建后的HCT116、SW480细胞, 提取总蛋白。通过10% SDS-PAGE分离样品蛋白, 并转移至PVDF膜。然后将膜置于5%脱脂奶粉中封闭2 h。与TMEM206、p-ERK、c-Myc、Fibronectin、Zeb1、E-cadherin、N-cadherin、Vimentin、Snail1、Snail2和β-actin抗体在4 ℃孵育过夜。之后将膜与二抗在室温下孵育2 h。ECL发光方法检测蛋白条带, 运用Image J软件分析各条带灰度值。该实验重复3次。
1.2.5 侵袭和迁移实验(Transwell实验)在24孔板中进行细胞侵袭和迁移测定。将转染后细胞的密度调整为2×105/孔, 将上述EMT构建中的NC组、206组、NC+EGF组和206+EGF组的HCT116及SW480细胞接种到小室中。将300 μL细胞悬液接种到上室中, 下室中加入600 μL含有20%胎牛血清的RPMI 1640培养基。侵袭实验中上室用200 mg/mL基质胶包被, 其余同迁移实验, 37 ℃下孵育3 h后进行侵袭测定。24 h后取出小室, 冰甲醇固定30 min, 0.1%结晶紫染色30 min。每孔任意选取3个视野(200×)获得细胞图像。结果表示为每个视野迁移的细胞数。每个实验重复3次。
1.2.6 免疫共沉淀TMEM206质粒转染细胞以增加其表达。48 h后提取蛋白。将质粒标签Myc-tag和IgG抗体与磁珠室温孵育1 h后, 将磁珠与样品蛋白在4 ℃孵育过夜。煮沸样品后用于SDS-PAGE, 然后进行Western blotting分析。
1.3 统计学分析应用SPSS 19.0软件进行统计学分析。计量数据均通过3次以上的独立实验获得。Western blotting、细胞迁移和侵袭测定结果用x±s表示, 采用t检验进行比较。P < 0.05为差异有统计学意义。
2 结果 2.1 TMEM206过表达促进EGF诱导的EMT样细胞形态EGF诱导后, HCT116和SW480细胞均表现出EMT样细胞形态:大多数细胞丧失其上皮特征并呈现纺锤形和成纤维细胞样形态(图 1)。同时发现, TMEM206上调增强了EGF诱导的EMT样细胞形态。大多数HCT116细胞中, 206+EGF组细胞较206组细胞出现了明显的细胞形态改变, 纺锤形和成纤维细胞样形态更为显著(图 1)。SW480细胞中, 这种促进作用更为明显。
|
| A, cell morphology in HCT116 cells; B, cell morphology in SW480 cells. 图 1 转染质粒、EGF处理后结直肠癌细胞的形态×100 Fig.1 Cell morphology of plasmid-transfected colorectal cancer cells after EGF treatment ×100 |
2.2 TMEM206过表达促进EGF诱导2种结直肠癌细胞中EMT相关蛋白表达的变化
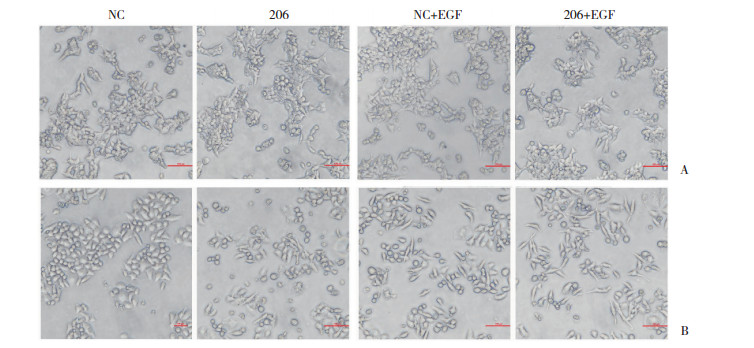
对比2种细胞转染后的NC组、206组、NC+EGF组和206+EGF组EMT相关蛋白表达的变化, 结果发现, EGF显著诱导2种细胞中E-cadherin减少以及Fibronectin、Vimentin、Zeb1、N-cadherin、Snail1、Snail2蛋白增加。然而, TMEM206过表达部分促进了EGF诱导的EMT相关蛋白变化, 包括促进EGF诱导的E-cadherin减少以及Fibronectin、Zeb1、Snail1、Snail2蛋白增加(Vimentin和N-cadherin除外)。见图 2。
|
| A, expression of EMT-related proteins in HCT116 cells; B, expression of EMT-related proteins in SW480 cells. * P < 0.05 vs control group; ** P < 0.01 vs control group. 图 2 转染质粒、EGF处理后结直肠癌细胞中EMT和EGFR-ERK/MAPK信号传导相关蛋白表达的变化 Fig.2 Changes in the expression of EMT and EGFR-ERK/MAPK signaling-related proteins in plasmid-transfected colorectal cancer cells after EGF treatment |
2.3 TMEM206过表达在2种结直肠癌细胞中促进EGF激活的ERK/MAPK-cMyc信号传导
EGF在HCT116和SW480细胞中显著激活ERK/MAPK-cMyc信号传导, 随后pERK和c-Myc蛋白表达增加(图 2)。无EGF刺激下, 单独TMEM206过表达不影响相关蛋白表达。然而, TMEM206过表达促进了EGF诱导的pERK和c-Myc蛋白增加(图 2)。上述结果提示, TMEM206和ERK/MAPK-cMyc信号通路特异性相互作用。
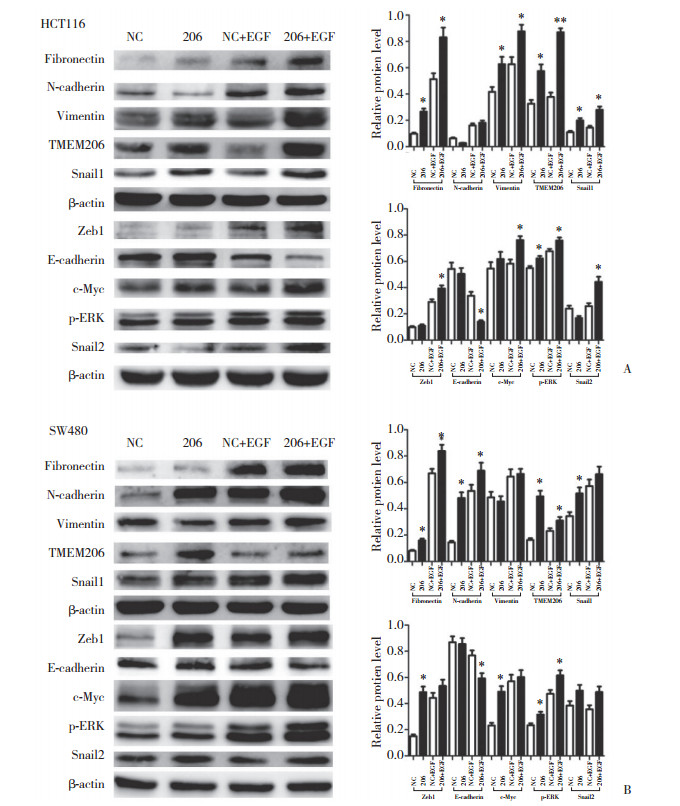
另外, TMEM206过表达部分上调EGFR-ERK/MAPK-c-Myc信号传导的关键蛋白, 包括Fibronectin、c-Myc和p-ERK (图 2)。接下来, 通过免疫共沉淀测定来证实这些结果。结果显示, TMEM206与c-Myc和E-cadherin免疫共沉淀(图 3)。但TMEM206并不与ERK直接结合, 这与之前的共沉淀结果一致。结果表明, 结直肠癌细胞中TMEM206和EGF诱导的EGFR-ERK/MAPK-c-Myc信号通路之间相互作用。

|
| A, HCT116 lysates were immunoprecipitated; B, SW480 lysates were immunoprecipitated. Input and IgG bands were used as the positive and negative controls, respectively. 图 3 通过免疫共沉淀检测Myc-tag、E-cadherin和c-Myc之间的相互作用 Fig.3 Interaction between Myc-tag, E-cadherin, and c-Myc as observed by immunoprecipitation |
2.4 TMEM206过表达促进EGF增强的结直肠癌细胞侵袭和迁移
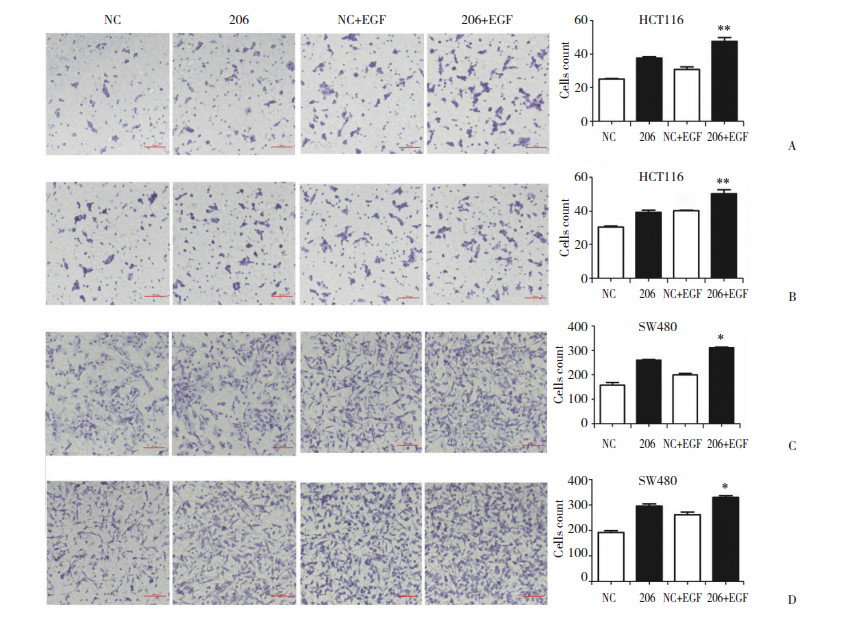
EMT在结直肠癌细胞的侵袭和转移中具有重要作用, EGF能够显著增强结直肠癌细胞的侵袭和迁移。本研究发现, TMEM206过表达质粒转染HCT116细胞后的206组细胞, 其侵袭和迁移能力明显增强。同时, TMEM206过表达进一步促进了EGF增强的细胞侵袭和迁移。EGF诱导后, 与NC+EGF组相比, 206+EGF组中细胞侵袭和迁移明显增加。结果提示, TMEM206过表达促进了结直肠癌细胞中EGF诱导的EMT。在SW480细胞中发现了同样的现象。见图 4。
|
| A, HCT116 cell invasion; B, HCT116 cell migration; C, SW480 cell invasion; D, SW480 cell migration. * P < 0.05 vs control group; ** P < 0.01 vs control group. 图 4 转染质粒、EGF处理后结直肠癌细胞的侵袭和迁移能力×200 Fig.4 Invasion and migration of plasmid-transfected colorectal cancer cells after EGF treatment ×200 |
3 讨论
TMEM206是TMEM家族成员, 在神经、肾脏和肠道组织中高度表达。之前的研究[6]表明, TMEM206在结直肠癌组织中上调, 其表达与T分期和UICC分期呈正相关, 与结直肠癌分化呈负相关。TMEM206能够增加结直肠癌细胞系中的p-AKT水平, 而AKT在肿瘤增殖、侵袭和迁移中起重要调节作用[7-8], 同时, p-ERK (p44/p42)也明显变化, 其参与Ras/Raf/MEK/ERK途径[9]。进入细胞核的ERK活性形式作用于各种转录因子, 参与细胞分化、增殖和转移的调节[10-11], 在肿瘤EMT中也起着重要作用。
本研究探讨了TMEM206在结直肠癌中对EMT的作用。在EMT过程中, 上皮细胞标志蛋白E-cadherin表达下调, Vimentin、Snail、Slug及其他间质特性蛋白表达上调[12-13], 导致细胞极性改变、细胞骨架重建以及细胞间黏附丧失, 从而使细胞获得高迁移、高侵袭、抗凋亡等间质表型特征。本研究首次发现, TMEM206过表达促进EGF诱导的2种结直肠癌细胞系中的EMT。众所周知, EMT (从E-cadherin减少的良性至浸润性癌的初始转化)和间充质-上皮细胞转化被认为是癌症转移的关键事件。TMEM206过度表达促进了结直肠癌中EGF诱导的EMT相关蛋白(E-cadherin、Fibronectin)的变化, 进一步表明TMEM206还在结直肠癌中EGF诱导的EMT中起重要作用。
本研究中, EGF在结直肠癌细胞中激活EGFR-ERK/MAPK-c-Myc信号通路, 而TMEM206过表达促进了EGF诱导的p-ERK和c-Myc蛋白增加, 同时也促进了EMT相关蛋白的改变, 如E-cadherin减少, Fibronectin、Zeb1、Snail1、Snail2增加。功能学实验也表明, TMEM206过表达进一步增强了EGF对结直肠癌细胞侵袭和迁移能力的诱导。上述指标均表明, TMEM206与EGFR-ERK/MAPK-c-Myc信号通路在EGF诱导的EMT中发生了密切的相互作用。可以得出结论, TMEM206通过ERK/MAPK-c-Myc信号通路促进结直肠癌细胞中EGF诱导的EMT。而EGFR-ERK/MAPK-c-Myc信号通路也具有重要的抗癌药物, 通过Smad2阻断转化生长因子-β信号通路的激活来抑制纤维连接蛋白原纤维形成, 减少细胞迁移并最终抑制结直肠癌中EMT[14]。综合之前的研究, TMEM206和ERK/MAPK-c-Myc信号通路协同作用促进结直肠癌的侵袭和转移。当然, 还需进一步研究其中相应的分子机制。
此外, 越来越多的证据表明, 各种癌细胞中Ca2+细胞内稳态的改变与肿瘤的发生、进展和转移密切相关。Ca2+传感器钙调蛋白以Ca2+依赖性方式增强Myc转录和致癌活性[15]。所以, TMEM206与肿瘤细胞内Ca2+的关系也需进一步明确, 未来的研究将进一步探讨。这些结果有望为结直肠癌的治疗、预后评估和新靶向治疗药物的开发提供新的理论和实验基础。
综上所述, 本研究结果为TMEM206在结直肠癌中的潜在作用提供了重要的依据。虽然结直肠癌的预后优于其他类型癌症, 但其远处转移极大地影响了一些结直肠癌患者的预后。因此, 研究TMEM206在鉴定新型靶向治疗或良好的诊断标志物中的作用至关重要。
| [1] |
JEMAL A, BRAY F, CENTER MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. DOI:10.3322/caac.20107 |
| [2] |
CHEN WQ, ZHENG RS, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
HUBER MA, KRAUT N, BEUG H. Molecular requirements for epithelial-mesenchymal transition during tumor progression[J]. Curr Opin Cell Biol, 2005, 17(5): 548-558. DOI:10.1016/j.ceb.2005.08.001 |
| [4] |
LEE CH, LIANG CW, ESPINOSA I. The utility of discovered on gastrointestinal stromal tumor 1(DOG1) antibody in surgical pathology-the GIST of it[J]. Adv Anat Pathol, 2010, 17(3): 222-232. DOI:10.1097/PAP.0b013e3181d973c2 |
| [5] |
LI MW, HAN YZ, ZHOU HZ, et al. Transmembrane protein 170B is a novel breast tumorigenesis suppressor gene that inhibits the Wnt/β-catenin pathway[J]. Cell Death Dis, 2018, 9(2): 91. DOI:10.1038/s41419-017-0128-y |
| [6] |
ZHAO JB, ZHU DH, ZHANG XP, et al. TMEM206 promotes the malignancy of colorectal cancer cells by interacting with AKT and extracellular signal-regulated kinase signaling pathways[J]. J Cell Physiol, 2019, 234(7): 10888-10898. DOI:10.1002/jcp.27751 |
| [7] |
MATSON DR, HARDIN H, BUEHLER D, et al. AKT activity is elevated in aggressive thyroid neoplasms where it promotes proliferation and invasion[J]. Exp Mol Pathol, 2017, 103(3): 288-293. DOI:10.1016/j.yexmp.2017.11.009 |
| [8] |
WEI WT, NIAN XX, WANG SY, et al. miR-422a inhibits cell proliferation in colorectal cancer by targeting AKT1 and MAPK1[J]. Cancer Cell Int, 2017, 17: 91. DOI:10.1186/s12935-017-0461-3 |
| [9] |
HAN D, WU G, CHANG C, et al. Disulfiram inhibits TGF-β-induced epithelial-mesenchymal transition and stem-like features in breast cancer via ERK/NF-κB/Snail pathway[J]. Oncotarget, 2015, 6(38): 40907-40919. DOI:10.18632/oncotarget.5723 |
| [10] |
GAO JJ, LIU X, YANG F, et al. By inhibiting Ras/Raf/ERK and MMP-9, knockdown of EpCAM inhibits breast cancer cell growth and metastasis[J]. Oncotarget, 2015, 6(29): 27187-27198. DOI:10.18632/oncotarget.4551 |
| [11] |
MARAMPON F, GRAVINA GL, POPOV VM, et al. Close correlation between MEK/ERK and Aurora-B signaling pathways in sustaining tumorigenic potential and radioresistance of gynecological cancer cell lines[J]. Int J Oncol, 2014, 44(1): 285-294. DOI:10.3892/ijo.2013.2167 |
| [12] |
YANG J, WEINBERG RA. Epithelial-mesenchymal transition:at the crossroads of development and tumor metastasis[J]. Dev Cell, 2008, 14(6): 818-829. DOI:10.1016/j.devcel.2008.05.009 |
| [13] |
PINO MS, KIKUCHI H, ZENG M, et al. Epithelial to mesenchymal transition is impaired in colon cancer cells with microsatellite instability[J]. Gastroenterology, 2010, 138(4): 1406-1417. DOI:10.1053/j.gastro.2009.12.010 |
| [14] |
GRIGGS LA, HASSAN NT, MALIK RS, et al. Fibronectin fibrils regulate TGF-β1-induced epithelial-mesenchymal transition[J]. Matrix Biol, 2017, 60-61: 157-175. DOI:10.1016/j.matbio.2017.01.001 |
| [15] |
RAFFEINER P, SCHRAFFL A, SCHWARZ T, et al. Calciumdependent binding of myc to calmodulin[J]. Oncotarget, 2017, 8(2): 3327-3343. DOI:10.18632/oncotarget.13759 |
 2020, Vol. 49
2020, Vol. 49