文章信息
- 李亚娟, 孟繁杰, 罗丽双, 于月新, 郝冬梅
- LI Yajuan, MENG Fanjie, LUO Lishuang, YU Yuexin, HAO Dongmei
- Usher综合征1型家系PCDH15基因的突变分析与产前诊断
- Analysis of PCDH15 gene mutation and prenatal diagnosis in a pedigree affected with Usher syndrome type 1
- 中国医科大学学报, 2020, 49(3): 220-223
- Journal of China Medical University, 2020, 49(3): 220-223
-
文章历史
- 收稿日期:2019-03-26
- 网络出版时间:2020-03-17 9:51
2. 北部战区总医院生殖医学科, 沈阳 110016
2. Department of Reproductive Medicine, General Hospital of Northern Theater Command, Shenyang 110016, China
耳聋的病因复杂, 是多种因素共同作用的结果。据报道, 50%~60%的先天性耳聋与遗传因素有关[1]。在遗传性耳聋中, 以耳聋为唯一症状的非综合征型耳聋约占70%, 合并其他症状的综合征型耳聋约占30%[2]。Usher综合征(Usher syndrome, USH)是以先天性耳聋, 视网膜色素变性, 伴或不伴前庭功能障碍为特征的常染色体隐性遗传疾病[3]。发病率为3.5/100 000~6.2/100 000 [4]。Usher综合征的基因型和表型具有临床异质性, 分为USH1, USH2和USH3 3种临床类型[5]。目前与USH1明确有关的基因有5个: MYO7A (USH1B)、USH1C (USH1C)、CDH23 (USH1D)、PCDH15 (USH1F)和USH1G (USH1G) [6]。
本研究应用目标基因捕获和高通量测序技术快速高效地检测出一个先天性耳聋家系的致病基因PCDH15, 发现2个新突变位点, 确诊先证者为USH1, 并针对PCDH15基因突变为先证者母亲进行了产前诊断。
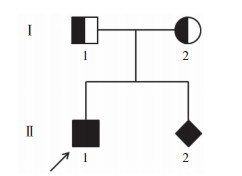
1 材料与方法 1.1 研究对象先证者, 男, 8岁, 足月出生, 先天性耳聋, 出生后抬头、翻身、坐、爬及行走等运动发育迟缓, 19个月学会走路, 明显落后于同龄幼儿, 且平衡能力差, 行走过程中经常跌倒。经过长期的平衡锻炼后很少跌倒; 2岁时行人工耳蜗植入获得听力, 目前语言沟通能力良好; 2.5岁发现视力异常, 经外院检查为弱视和散光。先证者父母表型正常, 非近亲结婚, 无家族遗传病史。先证者母亲再次怀孕, 于孕18周进行产前胎儿基因诊断。本研究经北部战区总医院(原中国人民解放军第202医院)伦理委员会批准, 先证者父母签署知情同意书。患者家系图见图 1。
|
| Arrow indicates the proband. 图 1 Usher1综合征家系图 Fig.1 Pedigree map of a family presenting congenital deafness |
1.2 方法 1.2.1 样本获取和DNA提取
采集先证者和父母全血2 mL, EDTA抗凝, 应用CWBIO BloodGen Midi Kit试剂盒提取DNA。先证者母亲于孕18周在超声引导下经腹取羊水10 mL, 应用TIANGEN微量样本基因组DNA提取试剂盒提取胎儿DNA。
1.2.2 目标基因捕获和高通量测序制备先证者DNA文库, 采用美国IDT公司的xGen Exome Research Panel v1.0捕获探针对耳聋相关基因全外显子和相邻内含子(50 bp)区域进行捕获和富集, 使用高通量测序平台(Illumina hiseq X10)进行测序。测序数据采用the Burrows-Wheeler Aligner (BWA)软件与UCSC hg19人类参考序列进行比对和鉴别遗传变异, 注释信息包括碱基和氨基酸的保守性, 生物学功能预测, 正常人群分布频率数据库(DYDF、dbSNP、千人基因组、千人南方、千人北方和EXAC), 人类基因突变数据库(HGMD、OMIM和Clinvar)。
1.2.3 引物设计和PCR扩增针对高通量测序筛选出的PCDH15基因突变位点设计上下游测序引物(表 1)。PCR反应条件为95 ℃预变性5 min, 95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 扩增30个循环, 最后72 ℃延伸10 min。反应体系为50 μL。
| Primer name | Base sequence | Annealing temperature (℃) | Amplification product size (bp) |
| c.3490_3491insA | F: AATGCATCGTTTCTTGTCCTCCAG | 60 | 278 |
| R: CTCCAAGTTTCAGGCTTTTGTTT | |||
| c.4115delG | F: AGACTTCTGACTCAGCTTGTGTTT | 60 | 418 |
| R: CCATGTTACCAGAGATGGTTTTC |
1.2.4 Sanger测序验证
针对PCDH15基因突变位点, 使用美国ABI 3730XL测序仪对先证者和父母进行Sanger测序, 采用DNASTAR软件与参考序列(NM_001142771)进行序列比对分析。
1.2.5 致病性预测从美国医学遗传学与基因组学学会(ACMG)变异解读规则、遗传方式及临床特征吻合度三方面分析筛选变异位点, 三方面都符合的突变判定为致病基因。
1.2.6 胎儿产前诊断确定致病基因突变位点及来源后, 利用上述测序引物及PCR反应条件, 通过Sanger测序对胎儿羊水DNA进行针对性突变检测, 确认胎儿是否携带PCDH15基因突变。
2 结果 2.1 目标基因捕获和高通量测序结果检测耳聋相关基因302个, 测序量7 133 M, 平均测序深度120.93%, 覆盖度99.95%, 20×以上覆盖度99.29%。结果显示, 先证者携带PCDH15基因第31号外显子c.4115delG (p.G1372Efs*4)和第27号外显子c.3490_3491insA (p.M1164Nfs*12)复合杂合突变。
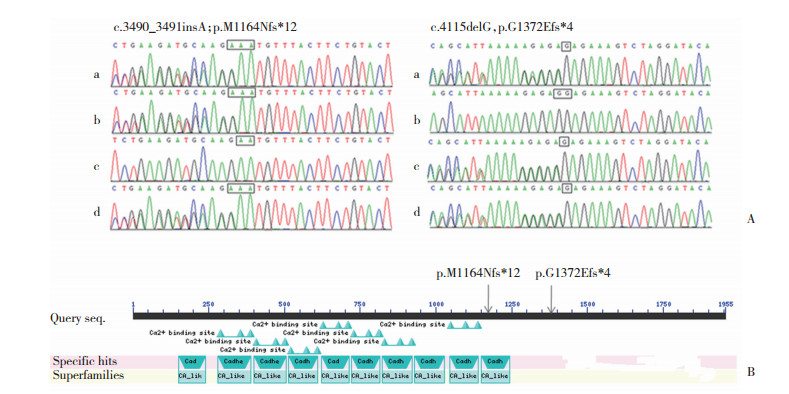
2.2 Sanger测序验证结果先证者携带PCDH15基因第31号外显子c.4115delG (p.G1372Efs*4)和第27号外显子c.3490_3491insA(p.M1164Nfs*12)复合杂合突变; 先证者父亲携带c.3490_3491insA (p.M1164Nfs*12)杂合性突变, 母亲携带c.4115delG (p.G1372Efs*4)杂合性突变。先证者的基因突变分别来源于父亲和母亲, 该家系符合常染色体隐性遗传, 见图 2。
|
| A, sanger sequencing of PCDH15 gene. a, the proband; b, the proband's father; c, the proband's mother; d, 18-week-old fetus. B, conserved domains (accession:Q96QU1) of the full WT PCDH15 protein. The arrows indicate the positions of the truncated proteins, p.M1164Nfs*12 and p.G1372Efs*4. 图 2 PCDH15基因Sanger测序结果和PCDH15蛋白功能结构域 Fig.2 Sanger sequencing of PCDH15 gene and the conserved domains of PCDH15 |
2.3 突变致病性分析结果
根据美国医学遗传学与基因组学学会(ACMG)指南, c.3490_3491insA和c.4115delG为移码突变, 属于功能缺失型突变, 是极强的致病证据。PCDH15基因是已知的USH1致病基因, 与先证者临床表型和遗传方式高度吻合。因此, 先证者诊断为USH1, PCDH15基因的复合杂合突变为该家系先天性耳聋的致病基因。
检索正常人数据库(DYDF, dbSNP、千人基因组、千人南方、千人北方和EXAC), c.4115delG未见收录, c.3490_3491insA (rs746865307)频率为0.000 23 (EXAC); 检索人类基因突变数据库(HGMD, OMIM和Clinvar) 2种突变都未见报道。c.4115delG和c.3490_3491insA是PCDH15基因新的致病突变位点。
2.4 胎儿产前诊断结果羊水DNA中检测到胎儿携带PCDH15基因c.4115delG (p.G1372Efs*4)和c.3490_3491insA (p.M1164Nfs*12)复合杂合突变, 与先证者基因型相同, 见图 2。
3 讨论USH1在3种临床类型中是最严重的, 以先天性双侧感音性神经耳聋, 持续的前庭功能障碍和青春期前色素性视网膜炎为特征[7]。USH1患者前庭功能障碍临床表现为运动发育迟缓, 患儿难以独立坐稳, 需他人帮助, 于生后9~11个月可以独坐, 往往到18个月后才会走路[8-9]。本研究中, 先证者先天性耳聋, 各项运动发育指标落后, 尤以会走路时间晚为显著特征, 并有视力异常, 其临床表型特征高度符合USH1临床类型。
人类PCDH15基因编码原钙黏蛋白-15, 含39个外显子, 1 955个氨基酸, 包括胞外结构域(多达11个胞外钙黏蛋白重复序列), 1个跨膜结构域, 以及细胞质结构域(CD1、CD2或CD3) [10-11]。原钙黏蛋白-15属于钙依赖性细胞黏附分子钙黏着蛋白超家族[12], 免疫细胞化学方法显示其定位于内耳毛细胞纤毛束和视网膜光感受器上[13]。听觉和平衡觉依赖于内耳毛细胞功能, 位于毛细胞顶端的静纤毛间的顶连接通过声波和头部运动传递机械力, 将机械信号转换为电信号, 从而打开毛细胞的机械电传导通道。顶连接是由原钙黏蛋白-15和钙黏蛋白-23形成的细丝, PCDH15基因突变影响其相互作用, 导致隐性形式的耳聋[14]。最新研究[15]发现原钙黏蛋白15具有顺式同源二聚体结构, 是毛细胞感知机械刺激的关键结构, PCDH15基因突变使其在毛细胞中的功能受到干扰。PCDH15基因错义突变导致非综合征性耳聋[10], 而许多更严重的突变(移码、无义、剪接、大片段缺失)则引起综合征性耳聋, 表现为听力和前庭功能受损等。PCDH15基因突变都是分散的, 没有突变热点[16]。
通过NCBI在线生物信息学分析软件识别PCDH15蛋白质结构域, 先证者携带的PCDH15基因c.3490_3491insA (p.M1164Nfs*12), 由于1 bp的插入导致该蛋白第1 164位甲硫氨酸(M)突变为天冬酰胺(N), 继续翻译12个氨基酸序列后出现终止密码子, 蛋白翻译提前终止, 形成截短蛋白, 失去部分钙黏蛋白重复序列, 该蛋白1 164位后的结构域在真核生物高度保守, 具有重要功能, 该突变导致蛋白功能的失活具有致病性。c.4115delG (p.G1372Efs*4)由于1 bp的缺失导致该蛋白第1 372位甘氨酸(G)突变为谷氨酸(E), 在1 375位提前终止翻译, 形成截短蛋白, 丢失第1 375位后500多个氨基酸残基, 也可导致蛋白功能失活具有致病性。PCDH15基因的2个移码突变可引起蛋白结构和功能的改变, 或者截短蛋白通过无义RNA介导的mRNA衰变途径被降解, 从而使内耳毛细胞的顶连接失去功能, 导致先证者耳聋的发生。
确定耳聋基因致病突变后, 提取胎儿羊水DNA进行检测, 发现胎儿携带c.4115delG (p.G1372Efs*4)和c.3490_3491insA (p.M1164Nfs*12)复合杂合突变, 推测胎儿出生后会出现与先证者相同的表型, 先证者母亲知情选择终止妊娠。
综上所述, 本研究检出2个新的致病突变位点c.4115delG和c.3490_3491insA, 丰富了PCDH15基因的突变谱。确诊先证者为USH1, 并针对PCDH15基因突变为先证者母亲进行了产前诊断, 为患病家系的遗传咨询和产前诊断提供了依据。
| [1] |
MORTON CC, NANCE WE. Newborn hearing screening:a silent revolution[J]. N Engl J Med, 2006, 354(20): 2151-2164. DOI:10.1056/NEJMra050700 |
| [2] |
袁慧军, 卢宇. 新一代测序技术在遗传性耳聋基因研究及诊断中的应用[J]. 遗传, 2014, 36(11): 1112-1120. DOI:10.3724/SP.J.1005.2014.1112 |
| [3] |
APARISI MJ, ALLER E, FUSTER-GARCÍA C, et al. Targeted next generation sequencing for molecular diagnosis of Usher syndrome[J]. Orphanet J Rare Dis, 2014, 9: 168. DOI:10.1186/s13023-014-0168-7 |
| [4] |
YAN D, LIU XZ. Genetics and pathological mechanisms of Usher syndrome[J]. J Hum Genet, 2010, 55(6): 327-335. DOI:10.1038/jhg.2010.29 |
| [5] |
PETIT C. Usher syndrome:from genetics to pathogenesis[J]. Annu Rev Genomics Hum Genet, 2001, 2: 271-297. DOI:10.1146/annurev.genom.2.1.271 |
| [6] |
BOOTH KT, KAHRIZI K, BABANEJAD M, et al. Variants in CIB2 cause DFNB48 and not USH1J[J]. Clin Genet, 2018, 93(4): 812-821. DOI:10.1111/cge.13170 |
| [7] |
SMITH RJ, BERLIN CI, HEJTMANCIK JF, et al. Clinical diagnosis of the usher syndromes. Usher syndrome consortium[J]. Am J Med Genet, 1994, 50(1): 32-38. DOI:10.1002/ajmg.1320500107 |
| [8] |
MÖLLER CG, KIMBERLING WJ, DAVENPORT SL, et al. Usher syndrome:an otoneurologic study[J]. Laryngoscope, 1989, 99(1): 73-79. DOI:10.1288/00005537-198901000-00014 |
| [9] |
SMITH RJ, PELIAS MZ, DAIGER SP, et al. Clinical variability and genetic heterogeneity within the Acadian usher population[J]. Am J Med Genet, 1992, 43(6): 964-969. DOI:10.1002/ajmg.1320430612 |
| [10] |
AHMED ZM, RIAZUDDIN S, AYE S, et al. Gene structure and mutant alleles of PCDH15:nonsyndromic deafness DFNB23 and type 1 Usher syndrome[J]. Hum Genet, 2008, 124(3): 215-223. DOI:10.1007/s00439-008-0543-3 |
| [11] |
AHMED ZM, GOODYEAR R, RIAZUDDIN S, et al. The tip-link antigen, a protein associated with the transduction complex of sensory hair cells, is protocadherin-15[J]. J Neurosci, 2006, 26(26): 7022-7034. DOI:10.1523/JNEUROSCI.1163-06.2006 |
| [12] |
AHMED ZM, RIAZUDDIN S, BERNSTEIN SL, et al. Mutations of the protocadherin gene PCDH15 cause Usher syndrome type 1F[J]. Am J Hum Genet, 2001, 69(1): 25-34. DOI:10.1086/321277 |
| [13] |
AHMED ZM, RIAZUDDIN S, AHMAD J, et al. PCDH15 is expressed in the neurosensory epithelium of the eye and ear and mutant alleles are responsible for both USH1F and DFNB23[J]. Hum Mol Genet, 2003, 12(24): 3215-3223. DOI:10.1093/hmg/ddg358 |
| [14] |
KAZMIERCZAK P, SAKAGUCHI H, TOKITA J, et al. Cadherin 23 and protocadherin 15 interact to form tip-link filaments in sensory hair cells[J]. Nature, 2007, 449(7158): 87-91. DOI:10.1038/nature06091 |
| [15] |
DIONNE G, QIU XF, RAPP M, et al. Mechanotransduction by PCDH15 relies on a novel Cis-dimeric architecture[J]. Neuron, 2018, 99(3): 480-492. DOI:10.1016/j.neuron.2018.07.006 |
| [16] |
JAIJO T, OSHIMA A, ALLER E, et al. Mutation screening of the PCDH15 gene in Spanish patients with Usher syndrome type I[J]. Mol Vis, 2012, 18: 1719-1726. |
 2020, Vol. 49
2020, Vol. 49