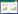文章信息
- 于冬冬, 赵丹阳, 杨鸫祥, 杨关林
- YU Dongdong, ZHAO Danyang, YANG Dongxiang, YANG Guanlin
- 辛伐他汀通过NF-κB通路抑制破骨细胞的分化
- Simvastatin inhibits osteoclast differentiation through the NF-κB pathway
- 中国医科大学学报, 2020, 49(3): 198-202, 208
- Journal of China Medical University, 2020, 49(3): 198-202, 208
-
文章历史
- 收稿日期:2018-09-03
- 网络出版时间:2020-03-17 9:39
2. 沈阳市第一人民医院神经内科, 沈阳 110041;
3. 辽宁中医药大学附属医院中西医结合内科, 沈阳 110032
2. Department of Neurology, The First People's Hospital of Shenyang, Shenyang 110041, China;
3. TCM Internal Medicine, The Affiliated Hospital, Liaoning University of Traditional Chinese Medicine, Shenyang 110032, China
绝经后骨质疏松症(postmenopasal osteoporosis, PMOP)是最常见的原发性骨质疏松症。在PMOP的发病过程中, 破骨细胞过度活化同时伴随过度骨吸收[1]。临床目前应用的防治PMOP药物都存在一定程度的不良反应, 而且没有一种抗骨质疏松药物能够完全恢复丢失的骨量[2]。
他汀类药物是临床治疗高脂血症的常用药物[3]。研究[4]发现, 他汀类药物影响破骨细胞的分化及骨吸收, 但具体的作用机制尚不明确。本研究试图阐明辛伐他汀对破骨细胞分化调节及其潜在机制, 为临床防治PMOP提供新思路及研究依据。
1 材料与方法 1.1 材料 1.1.1 细胞小鼠单核/巨噬细胞RAW264.7 (美国ATCC公司)。
1.1.2 试剂辛伐他汀(Simvastatin, SIM, 美国Sigma公司。溶于无水乙醇, 储存浓度10-2 mol/L, -20℃保存); 重组人可溶性RNAK配体(recombinant human soluble RANK Ligand, sRANKL, 美国Peprotech公司); 重组人巨噬细胞集落刺激因子(recombinant human macrophage colony stimulating factor, M-CSF, 美国Peprotech公司); DMEM (美国Hychone公司); 胎牛血清(美国Hychone公司); TRAP染色试剂盒(美国Sigma公司); 核因子κB (nuclear factor kappa B, NF-κB)免疫荧光检测试剂盒(中国Beyotime公司); WST-1检测试剂盒(中国Beyotime公司); p65、p-p65一抗(美国Cell signaling公司); 鬼笔环肽检测试剂(美国AAT BiBe Questy公司)。
1.1.3 仪器细胞孵箱(美国Thermo公司); 倒置相差显微镜(日本Olympus公司); 免疫荧光显微镜(日本Olympus公司); 流式细胞仪(美国BD公司); AMR-100酶标仪(中国杭州奥盛仪器有限公司)。
1.2 实验方法 1.2.1 小鼠单核/巨噬细胞RAW 264.7培养及诱导分化RAW 264.7细胞在DMEM未分化培养基中培养(含10%胎牛血清、不含抗生素、37℃、5%CO2孵箱内培养, 注意调节培养基的pH值, 宁偏酸性勿碱性)。细胞接种于10 cm2培养板内, 细胞传代可用胰酶, 但一定要注意控制胰酶消化的时间。也可以用无菌枪头把细胞从贴壁的状态直接吹打成悬浮细胞。诱导分化培养基(DMEM、10%胎牛血清、15 ng/mL sRANKL、15 ng/mL M-CSF)继续培养7 d。
1.2.2 WST-1检测细胞增殖活性研究分为对照组、10-5~10-9 mol/L的SIM组。细胞以5×103/孔平铺于96孔平板中, 24 h后更换诱导分化培养基, 诱导培养基培养7 d后, 细胞经SIM处理3、12、24、48 h, 每孔加20 μL WST-1检测剂。在孵箱中孵育1 h。450 nm读取吸光度值。光密度(optical delnsity, OD)值= (处理后细胞OD值-对照组细胞OD值/N), n > 3。
1.2.3 TRAP染色检测破骨细胞分化诱导分化培养基中加入不同浓度的sRANKL+M-SCF (0、5 ng/mL、15 ng/mL、50 ng/mL)诱导分化7 d。TRAP染色根据Sigma试剂盒进行操作。分析SIM对成骨细胞分化影响的分析共分5组, 分别为A组(对照组)、B组(sRANKL+M-SCF组)、C组(SIM+sRANKL+M-SCF组)、D组(PDTC+sRANKL+M-CSF)、E组(SIM+PDTC+sRANKL+M-CSF)。RAW264.7细胞(5×104/孔)在24孔板内培养, 在含和不含SIM (10-6 mol/L)的条件下进行诱导分化培养及药物干预。
1.2.4 肌动蛋白检测破骨细胞吸收活性吸收活性检测分为4组。A组(对照组)、B组(sRANKL+M-SCF组)、C组(SIM+sRANKL+M-SCF组)和D组(PDTC+sRANKL+M-CSF组)。RAW264.7细胞(5×104细胞/孔)在24孔板内培养, 在含和不含SIM (10-6 mol/L)的条件下诱导分化7 d。用免疫固定液在室温下固定15 min, 用免疫洗涤液(含0.1%的Triton X-100)在冰上冲洗3 min后, 用鬼笔环肽检测试剂染色40 min, 用DAPI溶液染色细胞核5 min。使用共焦显微镜拍照。使用滤光器鬼笔环肽检测试剂(激发:492 nm; 发射:518 nm)。
1.2.5 免疫荧光检测NF-κB核转位免疫荧光检测共分为4组。A组(对照组)、B组(sRANKL+M-SCF组)、C组(SIM+sRANKL+M-SCF组)、D组PDTC+sRANKL+M-CSF组。细胞在盖玻片上并培养过夜, 在含和不含SIM (10-6 mol/L)的条件下诱导分化7 d。细胞固定后, 用p-p65抗体孵育细胞(以1:400的比例稀释)过夜, 用DAPI染色细胞核(5 min), 免疫荧光显微镜检测。
1.2.6 Western blotting检测分别用sRANKL+M-SCF和SIM+sRANKL+M-SCF进行处理。细胞在含和不含SIM (10-6 mol/L)的条件下诱导分化7 d。提取蛋白, 定量, 上样, 蛋白电泳, 转膜, 封闭, 一抗孵育过夜, 二抗标记, ECL发光法曝光成像。Image J软件测定平均灰度值, 与内参值进行标准化后进行统计分析。
1.3 统计学分析采用SPSS 13.0软件进行统计分析, 数据以x±s表示, 采用ANOVA检验, P < 0. 05为差异有统计学意义。
2 结果 2.1 SIM抑制RAW264.7细胞增殖活性采用WST-1方法对RAW264.7细胞增殖活性进行检测, 结果显示, SIM (10-5 mol/L、10-6 mol/L)均能抑制破骨细胞的增殖活性, 但是SIM (10-6 mol/L)作用24 h、48 h能稳定抑制RAW264.7细胞的增殖活性。因此, SIM (10-6 mol/L)作用24 h作为实验用药浓度及作用时间。见表 1。
| Group | Time of SIM (h) | |
| 24 h | 48 h | |
| Control | 1.4±0.01 | 1.3±0.01 |
| SIM 10-5 mol/L | 0.8±0.011) | 1.2±0.031) |
| SIM 10-6 mol/L | 0.9±0.021) | 1.1±0.011) |
| 1) compared with control group, P < 0.05. | ||
2.2 破骨细胞的形态学观察
未分化的RAW264.7细胞呈圆形, 透光度好, 边界清晰。加入诱导液后, 细胞触角逐渐增多, 细胞略呈短梭形, 细胞透光度下降, 继而细胞融合成巨大的多核破骨细胞(细胞核数≥3) (B组破骨细胞数量44%±0.15%), 加入SIM (C组破骨细胞数量18%±0.12%, P = 0.004)及PDTC (D组破骨细胞数量33%±0.23%, P = 0.034)后, 破骨细胞的分化受到抑制, 融合的破骨细胞数量明显减少, SIM+PDTC组(E组破骨细胞数量21%±0.12%, P = 0.064)的作用效果与单独SIM组及PDTC相似。见图 1。
|
| A, control group; B, sRANKL+M-CSF group; C, SIM+sRANKL+M-CSF group; D, PDTC+sRANKL+M-CSF group; E, SIM+PDTC+sRANKL+M-CSF group. Arrows indicate osteoclasts after induction of fusion. 图 1 SIM抑制破骨细胞形成×200 Fig.1 SIM inhibited osteoclast formation ×200 |
2.3 TRAP染色检测破骨细胞分化
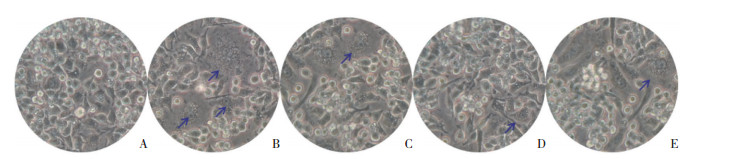
TRAP检测不同浓度的sRANKL+M-CSF对破骨细胞分化的影响, RAW264.7细胞在不同浓度的sRANKL+M-CSF诱导分化7 d, 结果按破骨细胞数(细胞核数≥3) /总细胞数来确定破骨细胞的分化效果。对照组没有破骨细胞分化, 5 ng/mL组为8%±0.15%, 15 ng/mL组为40%±1.5%, 而50 ng/mL组为15%±1.6% (P = 0.032)。其中, 浓度为15 ng/mL组的sRANKL+M-CSF具有最大的诱导RAW264.7细胞向破骨细胞分化的效果。因此, 将浓度为15 ng/mL的sRANKL+M-CSF诱导分化7 d作为本研究诱导分化的浓度及时间。见图 2。
|
| A, 0 ng/mL; B, 5 ng/mL; C, 15 ng/mL; D, 50 ng/mL. 图 2 不同浓度的sRANKL+M-CSF诱导破骨细胞分化×200 Fig.2 Osteoclast differentiation induced by different concentrations of sRANKL+M-CSF ×200 |
2.4 SIM抑制破骨细胞的分化
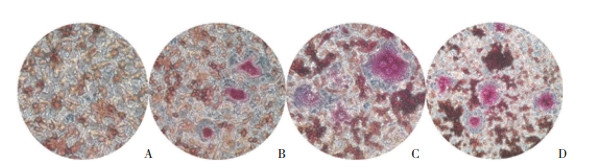
RAW264.7细胞在15 ng/mL的sRANKL+M-CSF诱导分化7 d, 结果按破骨细胞数(≥3核细胞) /总细胞数确定破骨细胞的分化效果, 在诱导分化培养基中单独加入SIM (10-6 mol/L, C组破骨细胞数为18%±0.12%)及PDTC (10-5 mol/L, D组破骨细胞数为35%±0.13%, B组破骨细胞数为48%±0.25%)和SIM+PDTC (20%±0.11%)的情况下, 破骨细胞的分化受到抑制, SIM+PDTC组的一致分化效果与单独SIM组及PDTC相似(P > 0.05)。见图 3。
|
| A, control group; B, sRANKL+M-CSF group; C, SIM+sRANKL+M-CSF group; D, PDTC+sRANKL+M-CSF group; E, SIM+PDTC+sRANKL+M-CSF group. 图 3 SIM抑制破骨细胞的分化×200 Fig.3 SIM inhibits osteoclast differentiation ×200 |
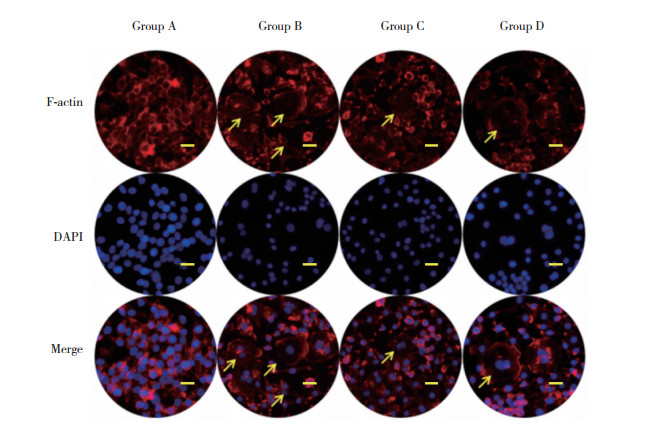
2.5 SIM抑制破骨细胞肌动蛋白环的形成
用荧光显微镜检测肌动蛋白环, 以观察成熟的破骨细胞肌动蛋白环的结构。sRANKL+ M-CSF能够诱导明显诱导肌动蛋白环的形成(B组:41%±0.15%), SIM能够抑制肌动蛋白环的形成(C组:10%±0.08%), 加入PDTC后的作用效果与SIM相似(D组:11%±0.13%)。见图 4。
|
| Arrows indicate osteoclast F-actin rings. Scale bar=50 μm. 图 4 SIM抑制破骨细胞肌动蛋白环的形成 Fig.4 SIM inhibits actin ring formation in osteoclasts |
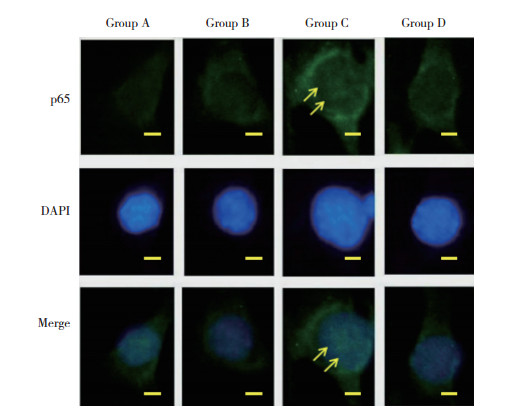
2.6 SIM抑制NF-κB的核转位
免疫荧光检测结果显示, 破骨细胞分化后, p65向细胞核内转位, SIM能够抑制其向细胞核内转位。见图 5。
|
| Arrows indicate nuclear, phosphorylated p65 protein. Scale bar=50 μm. 图 5 SIM抑制p65细胞核内转位 Fig.5 SIM inhibits intranuclear translocation of p65 in cells |
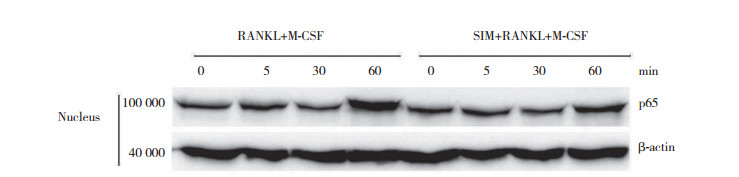
2.7 Westerm blotting结果
进一步分析SIM抑制成骨细胞分化的潜在机制, 免疫印迹检测通路蛋白显示, sRANKL+M-CSF能促进细胞核内p65的磷酸化(0 min, 5 min, 30 min, 60 min), 尤以60 min时p65磷酸化明显, 加入SIM后p65的细胞核内转位受到抑制, 60 min时抑制效果明显, 提示SIM发挥其抑制破骨细胞分化的药效学机制是通过抑制NF-κB信号通路完成的(P < 0.05)。见图 6。
|
| 图 6 SIM抑制p65磷酸化 Fig.6 SIM inhibits p65 phosphorylation |
3 讨论
PMOP与雌激素缺乏密切相关, 具有骨质疏松症的一般特征, 如骨小梁结构破坏和骨折风险增加[5]。研究[6-8]表明, 雌激素能抑制破骨细胞的形成。在PMOP的发病过程中, 过度激活破骨细胞形成和过度骨吸收是一个重要的因素, 因此, 抑制破骨细胞分化仍是PMOP治疗的一个重要策略。
他汀类药物具有抗血栓、抗氧化和抗炎和多效性的治疗作用。研究[9]表明, 他汀类药物对骨骼具有一定的药理学作用。还有研究[10-11]表明, 他汀类药物增加了卵巢切除的骨形成、抑制破骨细胞生成, 但其潜在机制尚不清楚。
本研究揭示了辛伐他汀抑制破骨细胞分化的潜能, TRAP染色检测显示, 辛伐他汀抑制sRANKL和M-CSF诱导的RAW264.7细胞向破骨细胞的形成和分化。破骨细胞形成过程中, 细胞骨架重排导致肌动蛋白环的形成。这些肌动蛋白环在维持细胞结构中起着至关重要的作用[12]。F-肌动蛋白环检测结果表明, 辛伐他汀能够抑制破骨细胞吸收活性, 这对预防和治疗PMOP具有重要意义。
NF-κB信号通路是调节破骨细胞成熟、分化、凋亡的重要通路[13], 进一步研究辛伐他汀发挥抑制破骨细胞分化的潜在机制。结果显示, 辛伐他汀抑制NF-κB通路的核心蛋白p65的激活, 抑制p65的细胞核内转位, 进而抑制破骨细胞的分化。因此, 本研究为临床应用辛伐他汀防治PMOP提供了依据。
| [1] |
EGHBALI-FATOURECHI G, KHOSLA S, SANYAL A, et al. Role of RANK ligand in mediating increased bone resorption in early postmenopausal women[J]. J Clin Invest, 2003, 111(8): 1221-1230. DOI:10.1172/JCI17215 |
| [2] |
LEWIECKI EM. New targets for intervention in the treatment of postmenopausal osteoporosis[J]. Nat Rev Rheumatol, 2011, 7(11): 631-638. DOI:10.1038/nrrheum.2011.130 |
| [3] |
MOSHIRI A, SHAHREZAEE M, SHEKARCHI B, et al. Three-dimensional porous gelapin-simvastatin scaffolds promoted bone defect healing in rabbits[J]. Calcif Tissue Int, 2015, 96(6): 552-564. DOI:10.1007/s00223-015-9981-9 |
| [4] |
MAEDA T, MATSUNUMA A, KAWANE T, et al. Simvastatin promotes osteoblast differentiation and mineralization in MC3T3-E1 cells[J]. Biochem Biophys Res Commun, 2001, 280(3): 874-877. DOI:10.1006/bbrc.2000.4232 |
| [5] |
ORYAN A, KAMALI A, MOSHIRI A. Potential mechanisms and applications of statins on osteogenesis:current modalities, conflicts and future directions[J]. J Control Release, 2015, 215: 12-24. DOI:10.1016/j.jconrel.2015.07.022 |
| [6] |
DEEKS ED. Denosumab:a review in postmenopausal osteoporosis[J]. Drugs Aging, 2018, 35(2): 163-173. DOI:10.1007/s40266-018-0525-7 |
| [7] |
NITTA K, YAJIMA A, TSUCHIYA K. Management of osteoporosis in chronic kidney disease[J]. Intern Med, 2017, 56(24): 3271-3276. DOI:10.2169/internalmedicine.8618-16 |
| [8] |
COSMAN F. Long-term treatment strategies for postmenopausal osteoporosis[J]. Curr Opin Rheumatol, 2018, 30(4): 420-426. DOI:10.1097/BOR.0000000000000509 |
| [9] |
PASCO JA, KOTOWICZ MA, HENRY MJ, et al. Statin use, bone mineral density, and fracture risk:geelong osteoporosis study[J]. Arch Intern Med, 2002, 162(5): 537-540. DOI:10.1001/archinte.162.5.537 |
| [10] |
MOSHIRI A, SHARIFI AM, ORYAN A. Role of Simvastatin on fracture healing and osteoporosis:a systematic review on in vivo investigations[J]. Clin Exp Pharmacol Physiol, 2016, 43(7): 659-684. DOI:10.1111/1440-1681.12577 |
| [11] |
MOON HJ, KIM SE, YUN YP, et al. Simvastatin inhibits osteoclast differentiation by scavenging reactive oxygen species[J]. Exp Mol Med, 2011, 43(11): 605-612. DOI:10.3858/emm.2011.43.11.067 |
| [12] |
KIM K, LEE SH, HA KIM J, et al. NFATc1 induces osteoclast fusion via up-regulation of Atp6v0d2 and the dendritic cell-specific transmembrane protein(DC-STAMP)[J]. Mol Endocrinol, 2008, 22(1): 176-185. DOI:10.1210/me.2007-0237 |
| [13] |
ZHU SW, WEI WF, LIU ZW, et al. Tanshinone-ⅡA attenuates the deleterious effects of oxidative stress in osteoporosis through the NF-κB signaling pathway[J]. Mol Med Rep, 2018, 17(5): 6969-6976. DOI:10.3892/mmr.2018.8741 |
 2020, Vol. 49
2020, Vol. 49