文章信息
- 赵海燕, 王晓非
- ZHAO Haiyan, WANG Xiaofei
- miR-181a-5p对缺氧诱导的大鼠肺动脉高压的影响
- Effect of miR-181a-5p on hypoxia-induced pulmonary arterial hypertension in rats
- 中国医科大学学报, 2020, 49(2): 129-133
- Journal of China Medical University, 2020, 49(2): 129-133
-
文章历史
- 收稿日期:2019-02-01
- 网络出版时间:2019-12-23 11:11
肺动脉高压(pulmonary arterial hypertension,PAH)是一种高度恶化的血管疾病,发病率和死亡率极高。研究[1]显示,结缔组织疾病(connective tissue disease,CTD)是引起PAH的最主要因素之一。研究[2]表明,与原发性PAH相似,CTD相关性PAH也具有血管内增生、平滑肌肥厚、中层增厚等临床病理表现。提示两者之间存在共同的发病机制及作用靶点。已有研究[3]报道缺氧引起的内皮细胞损伤可能是CTD相关性PAH形成的主要因素,缺氧条件下由肺血管重构引起的肺动脉高压则是右心室衰竭和死亡的主要原因[4]。因此,改善血管生成对于PAH及CTD的治疗及预后具有重要的意义。CTD相关性PAH的病情复杂,且预后极差,目前临床上还没有具体的治疗方案来改善和稳定病情。因此,对CTD相关性PAH机制研究尤为重要。
微小RNA(microRNA,miRNA)是一种高度保守的、长度为20~25个核苷酸的非编码单链RNA,在生物体生理、病理过程中发挥重要作用[5]。近年来研究[6-7]发现miRNA参与细胞增殖分化、细胞凋亡、免疫反应、肿瘤发生等多种病理生理过程,同时也在血管系统信号网络调控中起到重要作用。作为miRNA家族成员之一,miR-181a在内皮细胞的增殖和血管生成中同样扮演着重要的角色[8-9]。然而,关于miR-181a在CTD相关性PAH中的作用与机制研究却鲜有报道。本研究探讨miR-181a-5p在缺氧诱导的CTD相关性PAH中的作用及其机制。
1 材料与方法 1.1 主要试剂野百合碱(monocrotaline,MCT;上海阿拉丁生化科技有限公司),胰酶、EDTA、DMSO(美国Sigma-Aldrich公司),血管内皮生长因子(vascular endothelial growth factor,VEGF)一抗、基质金属蛋白酶(matrix metalloproteinase,MMP-2)一抗、MMP-9一抗、β-actin一抗、全蛋白提取试剂盒、BCA蛋白浓度测定盒(沈阳万类生物科技有限公司),MTT细胞增殖检测试剂盒(上海碧云天生物技术有限公司)、酶标仪(美国BIOTEK公司)。
1.2 实验动物健康雄性SD大鼠40只,4~6周龄,体质量180~220 g,由辽长生生物技术股份有限公司提供。饲养于12 h光照/12 h黑暗,温度恒定(22±1)℃,湿度恒定(45~55)%环境中,给予标准饲料进食,自由饮水。SD大鼠于实验前适应性喂养1周,此期间无精神不正常现象,无摄食不正常现象,无其他疾病发生。
1.3 实验方法 1.3.1 PAH大鼠模型的建立选取健康雄性SD大鼠40只,随机分成对照组、模型组、LV-NC组与LV-miR-181a-5p组,每组10只。模型组、LV-NC组与LV-miR-181a-5p组大鼠皮下注射MCT(60 mg/kg),建立PAH模型;LV-miR-181a-5p组大鼠分别于建模前48 h、建模后第7天和第14天滴鼻给予LV-miR-181a-5p(2×108 TU,美国Addgene公司)干预,LV-NC组大鼠使用相同剂量LV-NC(美国Addgene公司)滴鼻作为对照,对照组注射等量生理盐水。模型建立21 d后,同步处死各组大鼠,收集肺组织,于4 %中性多聚甲醛固定,待用于后续HE染色检测。
1.3.2 大鼠肺动脉内皮细胞原代培养取大鼠新鲜肺动脉组织,漂洗、纵向剖开并剪碎至1.5 mm×1.5 mm大小,以内膜面贴于无菌培养皿,置于37 ℃培养箱内孵育2 h,待组织微干贴于皿底,加入4 mL完全培养基,于37 ℃,5 % CO2培养条件下培养72 h,然后移去培养皿内动脉组织。原代大鼠肺动脉内皮细胞使用含10 % FBS的DMEM培养基进行培养。将分离得到的原代大鼠肺动脉内皮细胞随机分为4组:对照组、模型组、LV-NC组与LV-miR-181a-5p组。其中,模型组、LV-NC组与LV-miR-181a-5p组细胞于5 % O2条件下培养24 h,建立PAH细胞模型;LV-miR-181a-5p组细胞使用LV-miR-181a-5p感染进行干预,LV-NC组细胞同步感染LV-NC作为对照。
1.3.3 实时PCR检测提取原代大鼠肺动脉内皮细胞总RNA,将其反转录成cDNA。以cDNA为模板,利用miR-181a-5p特异性引物和染料分子SYBR Green进行PCR扩增。miR-181a-5p正向引物序列为CGGGCAACATTCAACGCTGT,反向引物序列为GTGCAGGGTCCGAGGTATTC。PCR反应条件为94 ℃反应5 min,94 ℃变性10 s,60 ℃退火延伸30 s,40个循环,循环结束后进行熔解曲线,60~94 ℃进行测定分析,利用2-△△Ct方法分析PCR结果。
1.3.4 肺组织HE染色取大鼠肺组织,经4 %中性多聚甲醛固定,乙醇梯度脱水,二甲苯透明,石蜡包埋,切片厚5 μm,进行HE染色,乙醇梯度脱水及二甲苯透明后显微镜(×200)下观察。
1.3.5 Western blotting检测提取原代大鼠肺动脉内皮细胞总蛋白,BCA法分析定量蛋白含量,采用11 %、15 %分离胶,5 %浓缩胶进行电泳,湿法转移至PVDF膜,5 %脱脂奶粉封闭,一抗VEGF(1:500)、MMP-2(1:500)、MMP-9(1:500)、β-actin(1:1 000)孵育,4 ℃过夜,TBST洗涤后用辣根过氧化物(HRP)标记的二抗(1:5 000)于37 ℃孵育45 min,ECL法检测。用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.3.6 MTT法检测细胞增殖活性选取对数生长期原代大鼠肺动脉内皮细胞,经过慢病毒感染与缺氧诱导后,加入MTT工作液(0.5 mg/mL)置于恒温培养箱(37 ℃,5 % CO2)中培养4.5 h,4.5 h后吸去上清,每孔加入150 μL DMSO,避光静置10 min后在酶标仪上测定570 nm处吸光度(optical density,OD)值。
1.4 统计学分析采用SPSS 21.0软件进行统计分析,数据以x±s表示,组间比较采用单因素方差分析,通过Bonforroni法校正。P < 0.05为差异有统计学意义。
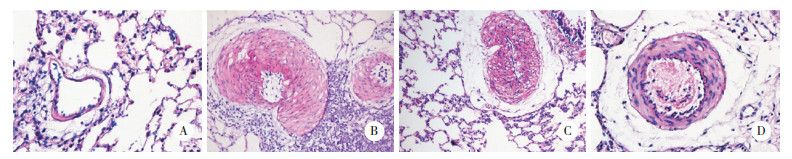
2 结果 2.1 各组大鼠肺组织形态学观察与对照组大鼠比较,模型组大鼠肺动脉组织中膜明显增厚,有显著的肺血管生成现象,内皮细胞损伤、脱落。与模型组大鼠比较,LV-miR-181a-5p组大鼠肺动脉组织中膜增厚、肺血管生成及内皮细胞损伤、脱落现象均得到显著改善;LV-NC组大鼠肺动脉组织中膜增厚、肺血管生成以及内皮细胞损伤、脱落现象无显著差异。见图 1。
|
| A, control group; B, model group; C, LV-NC group; D, LV-miR-181a-5p group. 图 1 各组大鼠肺组织形态学比较 ×200 Fig.1 Pulmonary morphologic changes in each group ×200 |
2.2 各组大鼠肺动脉内皮细胞miR-181a-5p的表达
实时PCR结果显示,对照组、模型组、LV-NC组和LV-miR-181a-5p组细胞miR-181a-5p表达分别为1.00±0.03、0.31±0.03、0.29±0.02和1.34±0.04。与对照组细胞比较,模型组细胞miR-181a-5p的表达水平显著降低(P < 0.05)。与模型组细胞比较,LV-miR-181a-5p组细胞miR-181a-5p的表达水平显著升高(P < 0.05);LV-NC组细胞miR-181a-5p的表达水平无统计学差异(P > 0.05)。
2.3 各组大鼠肺动脉内皮细胞VEGF、MMP-2与MMP-9蛋白的表达Western blotting结果显示,与对照组比较,模型组VEGF、MMP-2与MMP-9蛋白的表达水平显著增高(P < 0.05)。与模型组比较,LV-miR-181a-5p组VEGF、MMP-2与MMP-9蛋白的表达水平显著降低(P < 0.05);LV-NC组细胞VEGF、MMP-2与MMP-9蛋白的表达水平无显著差异(P < 0.05)。见图 2、表 1。

|
| 1, control group; 2, model group; 3, LV-NC group; 4, LV-miR-181A-5p group. 图 2 各组细胞中VEGF、MMP-2与MMP-9蛋白表达情况 Fig.2 Protein expression of VEGF, MMP-2, and MMP-9 in each group |
| Group | VEGF | MMP-2 | MMP-9 |
| Control | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| Model | 3.66±0.151) | 3.55±0.121) | 3.46±0.11) |
| LV-NC | 3.77±0.18 | 3.28±0.04 | 3.43±0.12 |
| LV-miR-181A-5p | 2.13±0.592) | 1.87±0.062) | 2.13±0.052) |
| 1)P < 0.05 vs control group;2)P < 0.05 vs model group. | |||
2.4 各组大鼠肺动脉内皮细胞增殖能力检测
MTT结果显示,对照组、模型组、LV-NC组和LV-miR-181a-5p组细胞增殖活性检测结果分别为0.581±0.080、0.997±0.102、0.931±0.079和0.603±0.085。与对照组比较,模型组增殖能力显著升高(P < 0.05)。与模型组比较,LV-miR-181a-5p组细胞的增殖能力显著下降(P < 0.05);LV-NC组细胞的增殖能力无统计学差异(P > 0.05)。
3 讨论CTD是一类自身免疫疾病,其发生往往伴随着PAH的产生。研究[10-11]表明,PAH是CTD患者最为严重的并发症之一,预后极差。研究[12]显示,在CTD早期患者发现并治疗PAH能够有效改善患者的预后。
PAH是一类心血管系统疾病,表现为血管收缩、血管重构和血管阻力增加[13]。由细胞过度增殖引起的血管重构是其最主要的临床病理特征,也是导致其恶化的最重要原因。因此,延缓肺血管重构进程是提高患者预后和生存的重要手段。
VEGF是一种强效促血管生成因子,是血管生成和内皮细胞生物学的关键介质,它通过多样化和复杂的信号传导途径在各种疾病中发挥作用[14-15]。有研究[16-17]表明,VEGF对内皮细胞有特异性作用,并具有多种影响,包括介导血管新生、血管通透性、血管生成和内皮细胞生长等。本研究结果显示,在缺氧诱导的PAH中,VEGF呈高表达,内皮细胞血管生成能力显著升高,当VEGF的表达受到抑制后,内皮细胞血管生成能力显著降低,缺氧诱导的PAH得到了改善,表明VEGF所引起的内皮细胞血管生成在CTD相关性PAH中起到了重要的调控作用,与以往研究[18]结果一致。
MMP是一种锌依赖性内肽酶,在胚胎发育、神经过程、伤口愈合、血管生成、关节炎、心血管疾病和癌症中发挥关键作用[19]。MMP还可以通过激活内皮细胞介导细胞外基质的组织重塑和渗透参血管生成。MMP-2和MMP-9是肺发育过程中主要的明胶酶,对基底膜组分的降解效果优于其他MMP[20]。MMP-2和MMP-9通过调控内皮细胞的迁移和增殖参与血管生成过程。有研究[21]报道,缺氧可以激活与肿瘤侵袭相关的蛋白酶MMP-2和MMP-9,也会引起血管异常,促进PAH的形成。本研究结果显示,与正常肺动脉内皮细胞比较,经过缺氧诱导后,MMP-2和MMP-9的表达水平显著上升,内皮细胞增殖能力与血管生成能力显著升高,表明CTD相关性PAH与MMP-2和MMP-9引起的内皮细胞增殖和血管生成密切相关;而当MMP-2和MMP-9的表达受到抑制后,内皮细胞增殖能力与血管生成能力显著降低,缺氧诱导的PAH得到了一定的改善,与以往研究[22]结果一致。
miRNA是一类在转录后水平上调节基因表达的非编码小分子RNA,在细胞分化、增殖与凋亡等进程中具有重要的调控作用。研究表明,作为miRNA家族中的成员,miR-181a-5p在内皮细胞增殖与血管生成过程中起重要的调控作用。LI等[23]发现miR-181a-5p在乳腺癌和结肠癌疾病中,能够抑制细胞的增殖和血管生成进程,进而对乳腺癌和结肠癌疾病起到一定的干预作用。有研究[24]发现miR-181a-5p能够降低细胞的增殖能力,进而对胶质瘤及肺癌等疾病的发生与发展起抑制作用。本研究结果显示,在缺氧诱导的PAH中,miR-181a-5p的表达水平显著降低,当过表达miR-181a-5p后,缺氧诱导的PAH得到了明显的改善,这种改善作用与VEGF、MMP-2和MMP-9表达水平的降低及内皮细胞血管生成能力和增殖能力的降低联系密切,与有关miR-181a-5p作用与机制的研究报道[25]一致。
综上所述,miR-181a-5p能通过负调控VEGF、MMP-2、MMP-9的表达来影响缺氧PAH内皮细胞的增殖和血管生成,进而对缺氧引起的CTD相关性PAH起到改善作用。本实验为寻找缺氧诱导的CTD相关性PAH的新治疗靶点提供了理论依据和实验基础。
| [1] |
FISCHER A, DENTON CP, MATUCCI-CERINIC M, et al. Ambrisentan response in connective tissue disease-associated pulmonary arterial hypertension(CTD-PAH)-A subgroup analysis of the ARIES-E clinical trial[J]. Respir Med, 2016, 117: 254-263. DOI:10.1016/j.rmed.2016.06.018 |
| [2] |
姚晓军, 刘伦旭. 肺癌的流行病学及治疗现状[J]. 现代肿瘤医学, 2014, 22(8): 1982-1986. DOI:10.3969/j.issn.1672-4992.2014.08.74 |
| [3] |
JIANG J, XIA Y, LIANG Y, et al. miR-190a-5p participates in the regulation of hypoxia-induced pulmonary hypertension by targeting KLF15 and can serve as a biomarker of diagnosis and prognosis in chronic obstructive pulmonary disease complicated with pulmonary hypertension[J]. Int J Chron Obstruct Pulmon Dis, 2018, 13: 3777-3790. DOI:10.2147/COPD.S182504 |
| [4] |
HUMBERT M, COGHLAN JG, GHOFRANI HA, et al. Riociguat for the treatment of pulmonary arterial hypertension associated with connective tissue disease:results from PATENT-1 and PATENT-2[J]. Ann Rheum Dis, 2017, 76(2): 422-426. DOI:10.1136/annrheumdis-2015-209087 |
| [5] |
ALVAREZ-GARCIA I, MISKA EA. MicroRNA functions in animal development and human disease[J]. Development, 2005, 132(21): 4653-4662. DOI:10.1242/dev.02073 |
| [6] |
LOVIS P, GATTESCO S, REGAZZI R. Regulation of the expression of components of the exocytotic machinery of insulin-secreting cells by microRNAs[J]. Biol Chem, 2008, 389(3): 305-312. DOI:10.1515/BC.2008.026 |
| [7] |
BOCKMEYER CL, MAEGEL L, JANCIAUSKIENE S, et al. Plexiform vasculopathy of severe pulmonary arterial hypertension and microRNA expression[J]. J Heart Lung, 2012, 31(7): 764-772. DOI:10.1016/j.healun.2012.03.010 |
| [8] |
YANG C, TAHIRI H, CAI C, et al. MicroRNA-181a inhibits ocular neovascularization by interfering with vascular endothelial growth factor expression[J]. Cardiovasc Ther, 2018, 36(3): e12329. DOI:10.1111/1755-5922.12329 |
| [9] |
ZHAO X, WANG Y, MENG C, et al. FMRP regulates endothelial cell proliferation and angiogenesis via the miR-181a-CaM-CaMKII pathway[J]. Cell Bio Int, 2018, 42(10): 1432-1444. DOI:10.1002/cbin.11039 |
| [10] |
MCLAUGHLIN V, HUMBERT M, COGHLAN G, et al. Pulmonary arterial hypertension:the most devastating vascular complication of systemic sclerosis[J]. Rheumatology(Oxford), 2009, 48(Supplement 3): Ⅲ25-Ⅲ31. DOI:10.1093/rheumatology/kep107 |
| [11] |
KÄHLER CM, COLLESELLI D. Pulmonary arterial hypertension (PAH)in connective tissue diseases[J]. Rheumatology(Oxford), 2006, 45(Supplement 3): Ⅲ11-Ⅲ13. DOI:10.1093/rheumatology/kel291 |
| [12] |
潘婕.三种结缔组织病相关肺动脉高压的临床特点及预后分析[D].南宁: 广西医科大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10598-1019108587.htm
|
| [13] |
LIANG S, YU H, CHEN X, et al. PDGF-BB/KLF4/VEGF signaling axis in pulmonary artery endothelial cell angiogenesis[J]. Cellular Physiol Biochem, 2017, 41(6): 2333-2349. DOI:10.1159/000475652 |
| [14] |
EVANS I. An overview of VEGF-mediated signal transduction[J]. Methods Mol Biol, 2015, 1332: 91-120. DOI:10.1007/978-1-4939-2917-7_7 |
| [15] |
GURU SK, PATHANIA AS, KUMAR S, et al. Secalonic acid-D represses HIF1/VEGF-mediated angiogenesis by regulating the akt/mTOR/p70S6K signaling cascade[J]. Cancer Res, 2015, 75(14): 2886-2896. DOI:10.1158/0008-5472.can-14-2312 |
| [16] |
MASSENA S, CHRISTOFFERSSON G, VÅGESJÖ E, et al. Identification and characterization of VEGF-A-responsive neutrophils expressing CD49d, VEGFR1, and CXCR4 in mice and humans[J]. Blood, 2015, 126(17): 2016-2026. DOI:10.1182/blood-2015-03-631572 |
| [17] |
FEARNLEY GW, BRUNS AF, WHEATCROFT SB, et al. VEGF-A isoform-specific regulation of calcium ion flux, transcriptional activation and endothelial cell migration[J]. Biol Open, 2015, 4(6): 731-742. DOI:10.1242/bio.201410884 |
| [18] |
KHAYATI F, PÉREZ-CANO L, MAOUCHE K, et al. EMMPRIN/CD147 is a novel coreceptor of VEGFR-2 mediating its activation by VEGF[J]. Oncotarget, 2015, 6(12): 9766-9780. DOI:10.18632/oncotarget.2870 |
| [19] |
ZHUO YF, ZENG QC, ZHANG P, et al. VEGF promoter polymorphism confers an increased risk of pulmonary arterial hypertension in a Chinese population[J]. Yonsei Med J, 2017, 58(2): 305-311. DOI:10.3349/ymj.2017.58.2.305 |
| [20] |
BIRKEDAL-HANSEN H, MOORE WG, BODDEN MK, et al. Matrix metalloproteinases:a review[J]. Crit Rev Oral Biol Med, 1993, 4(2): 197-250. DOI:10.1177/10454411930040020401 |
| [21] |
BRAT DJ, CASTELLANO-SANCHEZ AA, HUNTER SB, et al. Pseudopalisades in glioblastoma are hypoxic, express extracellular matrix proteases, and are formed by an actively migrating cell population[J]. Cancer Res, 2004, 64(3): 920-927. DOI:10.1158/0008-5472.can-03-2073 |
| [22] |
HOWELL K, PRESTON RJ, MCLOUGHLIN P. Chronic hypoxia causes angiogenesis in addition to remodelling in the adult rat pulmonary circulation[J]. J Physiol(Lond), 2003, 547(Pt 1): 133-145. DOI:10.1113/jphysiol.2002.030676 |
| [23] |
LI YY, KUSCU C, BANACH A, et al. MiR-181a-5p inhibits cancer cell migration and angiogenesis via downregulation of matrix metalloproteinase-14[J]. Cancer Res, 2015, 75(13): 2674-2685. DOI:10.1158/0008-5472.CAN-14-2875 |
| [24] |
王颖, 郭人花. miR-181a-5p在非小细胞肺癌中抗癌机制的研究[J]. 中国生化药物杂志, 2014, 34(6): 6-10. |
| [25] |
SUN W, WANG X, LI J, et al. MicroRNA-181a promotes angiogenesis in colorectal cancer by targeting SRCIN1 to promote the SRC/VEGF signaling pathway[J]. Cell Death Dis, 2018, 9(4): 438. DOI:10.1038/s41419-018-0490-4 |
 2020, Vol. 49
2020, Vol. 49