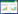文章信息
- 张华, 郭澍, 佟爽, 陈义庆, 崔梦莹, 赵崇如
- ZHANG Hua, GUO Shu, TONG Shuang, CHEN Yiqing, CUI Mengying, ZHAO Chongru
- 脂肪干细胞外泌体提取方法的改良及其对成骨效应的影响
- Improved isolation of exosomes derived from adipose-derived stem cells and effect on osteogenesis
- 中国医科大学学报, 2020, 49(2): 115-119, 128
- Journal of China Medical University, 2020, 49(2): 115-119, 128
-
文章历史
- 收稿日期:2018-12-24
- 网络出版时间:2019-12-23 14:26
脂肪干细胞(adipose-derived stem cells,ADSCs)存在于人体脂肪组织内,取材容易,且其具有较强的增殖能力及分化能力,通过旁分泌途径发挥生物学作用,已经用于多种动物模型治疗中[1-2]。19世纪80年代外泌体(外泌体)首次提出,它是由细胞内部的囊泡释放到胞外环境,形成具有脂质双层结构的膜源性小囊泡,内含不同种类的蛋白质、脂质、信号因子等具有生物学活性的物质,通过将囊泡内的生物学活性物质转移至靶细胞,参与体内多种生物学活动及疾病的发生[3-4]。本研究将传统的ExoQuick试剂盒提取方法进行改良,提取ADSCs来源外泌体,与超速离心法、ExoQuick试剂盒法比较,以获得高纯度、无丢失的外泌体样本。有研究[5]报道外泌体具有与来源细胞相同的信号分子等生物学物质,在细胞间进行信息传递,因此本研究将3种方法提取的外泌体加入传统的ADSCs成骨诱导过程中,观察其能否提高ADSCs的成骨效率,以验证提取的外泌体具有生物学活性并携带与ADSCs相同的生物学物质。
1 材料与方法 1.1 标本来源及ADSCs的分离培养ADSCs来源于中国医科大学附属第一医院整形外科行吸脂术的19岁健康女性患者皮下脂肪组织(经中国医科大学附属第一医院伦理委员会批准,征得患者知情同意),无菌条件下强力清洗消化中和反应,1 200 r/min 25 ℃离心5 min,洗去残留的红细胞及油脂。加入含15%FBS和1%青-链霉素的DMEM/F12基础培养基重悬细胞,接种于75 cm2培养瓶。放入孵箱内培养,换液后用倒置相差显微镜观察,待ADSCs融合约80%时传代备用。
1.2 ADSCs多向分化取P3 ADSCs接种于6孔板中,用成骨诱导培养基诱导20 d后加入多聚甲醛固定,茜素红染色,倒置相差显微镜下观察钙化结节行成情况。取第3代ADSCs接种于15 mL离心管中,用成软骨诱导培养基诱导28 d后加入多聚甲醛固定,Alican染色,光学显微镜下观察软骨块形成情况。
1.3 超速离心法、ExoQuick试剂盒法及ExoQuick试剂盒改良法提取ADSCs来源外泌体 1.3.1 超速离心法取P3 ADSCs无血清培养72 h后,收集上清,4 ℃条件下,2 000 g离心30 min收集上清,20 000 g离心60 min收集上清,100 000 g离心60 min,收集超离管底部沉淀至1管中,PBS稀释,100 000 g离心60 min,最后将收集的沉淀以100 μL PBS重悬,分装,-80 ℃保存,收集的外泌体设为标本A。
1.3.2 ExoQuick试剂盒法取P3 ADSCs无血清培养72 h后,收集上清,4 ℃条件下,3 000 g离心15 min,取上清液,按照试剂说明书,加入沉淀剂放置过夜,1 500 g离心8 min,弃上清,沉淀以100 μL PBS重悬,分装,-80 ℃保存,收集的外泌体设为标本B。
1.3.3 ExoQuick试剂盒改良法取P3 ADSCs无血清培养72 h后,收集上清,4 ℃条件下,3 000 g离心30 min取上清液,20 000 g离心60 min,取上清液,按照试剂说明书,加入沉淀剂放置过夜,1 500 g离心8 min,弃上清,沉淀以100 μL PBS重悬,分装,-80 ℃保存,收集的外泌体设为标本C。
1.4 ADSCs来源外泌体的形态学及免疫表型鉴定 1.4.1 透射电镜观察形态将各组提取的外泌体悬液(1 μL)载样于铜网表面,38 ℃干燥箱静置30 min,滴加磷钨酸(20 g/L)室温复染3 min,滤纸从侧面吸干复染液,蒸馏水洗涤铜网5次,晾干,透射电镜观察照相。
1.4.2 Western blotting检测蛋白表达水平将ADSCs与处理后的3组外泌体加入裂解液冰上静置20 min,涡旋,冰上静置10 min,4 ℃、14 000 r/min离心20 min,吸取上清液至EP管中,根据BCA试剂盒说明书进行蛋白定量,加入5×上样缓冲液,100 ℃金属浴10 min使蛋白变性。并根据定量结果分别上样,电泳结束后,按照Marker指示的分子质量截胶,转膜,清洗封闭,分别孵CD63抗体(1:500稀释)、CD9抗体(1:250稀释)4 ℃过夜,洗膜后分别孵二抗(1:2 000稀释)1 h,洗膜后加入显色剂观察。
1.5 外泌体加入ADSCs成骨分化诱导并行功能学检测 1.5.1 分组处理取P3 ADSCs融合至80%左右时,分别将3种提取方法提取的外泌体,以200 ng/μL的质量浓度分别加入成骨诱导培养基中,对ADSCs进行成骨分化诱导。具体分为:A组,加入标本A外泌体成骨诱导液的ADSCs;B组,加入标本B外泌体成骨诱导液的ADSCs;C组,加入标本C外泌体成骨诱导液的ADSCs;空白对照组(D组):加入无外泌体的普通成骨诱导液的ADSCs。诱导20 d后进行茜素红染色,倒置相差显微镜下观察各组钙化结节形成情况。
1.5.2 Western blotting检测蛋白表达水平将4组ADSCs加入裂解液,置于冰上裂解30 min,用细胞刮刀刮净培养瓶底部的细胞裂解物,并收集至EP管中,涡旋,冰上静置10 min,4 ℃、14 000 r/min离心20 min,吸取上清液至EP管中,根据BCA试剂盒说明书进行蛋白定量,加入5×上样缓冲液,100 ℃金属浴10 min使蛋白变性。并根据定量结果分别上样,电泳结束后,按照Marker指示的分子质量截胶,转膜,清洗封闭。分别孵育Runx2抗体、OCN抗体反应过夜,二抗孵育1 h,洗膜后加入显色剂观察。
1.6 统计学分析采用SPSS 13.0统计软件进行统计,各组数据以x±s表示,组间比较采用独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 ADSCs形态学观察及多向分化ADSCs接种后5 d,镜下观察可见ADSCs长满培养瓶底部,生长状态良好,细胞形态均一,呈集落样生长,方向性明显(图 1A)。ADSCs经成骨诱导,胞体逐渐变大,由长梭形变成多角形,20 d茜素红染色镜下观察可见钙结节被染成红色(图 1B)。ADSCs经成软骨诱导,在管底可见乳白色球形细胞团块,28 d Alican染色镜下观察可见胞质及细胞外基质分泌的硫酸黏蛋白被染色蓝色(图 1C)。
|
| A, morphological character of ADSCs; B, osteogenic differentiation (oil red O staining); C, chondrogenic differentiation (Alican staining). 图 1 ADSCs形态特点及多向分化鉴定 ×100 Fig.1 Morphology and multidirectional differentiation of ADSCs ×100 |
2.2 ADSCs来源外泌体的形态学及免疫表型鉴定 2.2.1 外泌体形态学观察结果
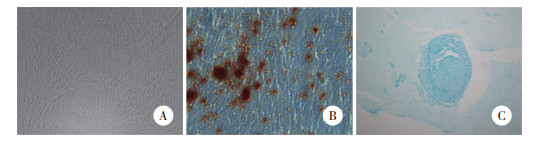
结果显示,标本A、B、C外泌体在透射电镜下均可见明显异质性圆形或类圆形小囊泡,直径40~130 nm,有完整膜,内有低电子密度小颗粒。标本A外泌体含量较标本B、C少,且囊泡大小不均一;标本B、C外泌体含量较多,且囊泡大小较均一,但经多次实验标本B均显示背景污染严重,分析可能存在其他蛋白质污染(图 2)。
|
| A, group A; B, group B; C, group C. 图 2 ADSCs来源exosomes的形态学鉴定 ×60 000 Fig.2 Morphology of exosomes ×60 000 |
2.2.2 Western blotting检测蛋白表达水平
与对照组比较,3组标本都有CD9、CD63蛋白表达。与A组比较,B组CD9、CD63蛋白表达显著增多(P < 0.01);与B组比较,C组CD9、CD63蛋白表达显著增多(P < 0.01),见图 3。

|
| A, the protein expressions of CD9 and CD63 were detected by Western blotting; B, the protein expressions of CD9;C, the protein expressions of CD63. *P < 0.01 vs group A; # P < 0.01 vs group B. 图 3 Western blotting检测各组CD9、CD63蛋白表达 Fig.3 CD9 and CD63 protein expressions determined by by Western blotting |
2.3 外泌体与ADSCs共培养后成骨分化诱导及其功能学检测 2.3.1 成骨分化诱导
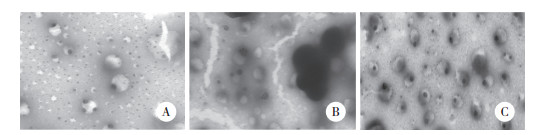
结果显示,4组经镜下观察均可见胞体逐渐变大,由长梭形变成多角形,20 d茜素红染色镜下观察可见钙结节被染成红色。C组较其他3组镜下红色钙结节密度更大,见图 4。
|
| A, exosome-extracted from ultracentrifugation method were added to the osteoblast induction process of adipose-derived stem cells for morphological observation; B, exosome-extracted from the ExoQuick kit method were added to the osteoblast induction process of adipose-derived stem cells for morphological observation; C, exosome-extracted from the improved ExoQuick kit method were added to the osteoblast induction process of adipose-derived stem cells for morphological observation; D, the osteoblast induction process of the group without exosomes adipose-derived stem cells for morphological observation. 图 4 各组成骨分化诱导结果 ×100 Fig.4 Induction of osteogenic differentiation in each group ×100 |
2.3.2 Western blotting检测蛋白表达水平
结果显示,4组都有Runx2、OCN蛋白表达。与D组比较,A、B、C组Runx2、OCN蛋白表达显著增多(P < 0.01);且B组较A组Runx2、OCN蛋白表达更多(P < 0.01),C组较B组Runx2、OCN蛋白表达更多(P < 0.01),见图 5。
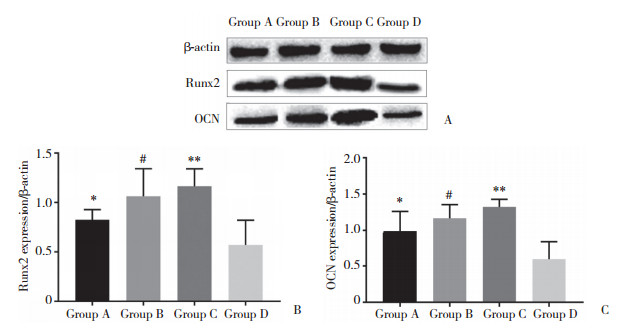
|
| A, the protein expressions of Runx2 and OCN were detected by Western blotting; B, the protein expressions of Runx2;C, the protein expressions of OCN. *P < 0.01 vs group D; # P < 0.01 vs group A; **P < 0.01 vs group B. 图 5 成骨诱导20 d后各组Runx2、OCN蛋白表达 Fig.5 Expressions of Runx2 and OCN proteins in each group induced after 20 days |
3 讨论
ADSCs来源便捷、易增殖,具有向成骨细胞、成软骨细胞、成纤维细胞等多向分化潜能。它可通过旁分泌分泌各种细胞因子(IGF、TGF和VEGF、肝细胞生长因子等),能够促进多种组织与细胞的生长,发挥多种生物学作用[6-7]。相同体积的脂肪组织和骨髓组织,脂肪组织中干细胞的数量远远超过骨髓组织,因此,ADSCs被广泛用于组织修复或再生(骨/软骨修复、心血管组织再生、椎间盘修复等[8])。本实验通过对ADSCs形态学观察及成骨、成软骨分化,证实提取的细胞为ADSCs。
几乎所有类型的细胞都在生理或病理条件(细胞活化、应激和凋亡)下释放外泌体。外泌体的形成是由细胞膜内陷形成胞内小泡,以出芽形式释放到胞外环境,其内具有与来源细胞相同的信息,在细胞间进行信息传递[9-11]。所以获取高纯度和无蛋白丢失的外泌体样本是进一步探寻其功能机制的基础。外泌体的直径多介于40~150 nm之间,净化非常困难,目前已知的提取方法有多种,包括超速离心法、免疫亲和捕获、密度梯度离心法、ExoQuick试剂盒法等[12-13]。因超速离心法及ExoQuick试剂盒法应用较多,仪器试剂较易准备,所以本次研究采用超速离心法和ExoQuick试剂盒法提取ADSCs来源外泌体,且尝试在ExoQuick试剂盒法前加一步超度离心作为ExoQuick试剂盒改良法,以探究更高效的ADSCs中外泌体的提取方法。
本研究结果显示,根据透射电镜观察,可见标本A外泌体大小不一,分布较稀疏。标本B外泌体大小较均一,密度也较标本A多,但经过多次提取观察背景污染均比较严重,可能因ExoQuick试剂盒是根据外泌体表面的脂质双分子层结构具有一定的疏水性,用试剂捆绑水分子,通过常规离心收集沉淀获取外泌体,虽然这种方法从细胞中获取外泌体的方法简单易操作,但其分离出的沉淀中会掺杂一些未知的疏水大分子物质。标本C外泌体大小较均一,密度较标本A多,与标本B相仿,且背景清晰。根据Western blotting检测,3种方法均表达外泌体表面特异性标志物CD9、CD63蛋白,但标本A的蛋白表达量较低,标本B、C蛋白表达量较高,且标本C的蛋白表达量较标本B高。证实ExoQuick试剂盒改良法以离心去除部分大分子蛋白质后,提高了外泌体的提取效率,为ADSCs来源外泌体的最优提取方法。
外泌体内含有不同种类的蛋白质、脂质、mRNAs、microRNAs、信号分子等与其来源细胞相同的生物学活性物质,较易通过膜融合,将生物学活性物质选择性地传递至邻近细胞,发挥多种生物学功能[14]。为了验证3种方法提取的外泌体是否具有生物学活性,发挥信息传递作用,选择ADSCs成骨分化方向,分别在成骨诱导液中加入3种方法提取的外泌体,对ADSCs进行成骨诱导,ADSCs诱导一段时间后进行镜下观察和Western blotting检测。结果显示,外泌体的成骨诱导液诱导的ADSCs较普通成骨诱导液诱导的ADSCs,镜下观察到更多的红色钙结节;经Western blotting检测,加入外泌体的成骨诱导液诱导的ADSCs较普通成骨诱导液诱导的ADSCs Runx2和OCN表达量也有所提高。且加入ExoQuick试剂盒改良法提取的外泌体的成骨诱导过程,镜下观察到的红色钙结节最为密集;Western blotting显示Runx2和OCN表达量最多。进一步证实了外泌体确实具备进入细胞的活性、促进ADSCs成骨分化,且ExoQuick试剂盒改良法提取的ADSCs来源外泌体纯度高,诱导效果最好。
综上所述,改良的ExoQuick试剂盒法与超速离心法、ExoQuick试剂盒法均能获得外泌体,且ExoQuick试剂盒改良法为提取ADSCs来源外泌体的最优方法。经ADSCs成骨分化诱导实验,验证提取的外泌体均具备进入ADSCs的活性,携带与ADSCs相同的促进ADSCs的成骨分化生物学物质,且ExoQuick试剂盒改良法提取的外泌体诱导效果最好,本研究为进一步探究ADSCs来源外泌体信息传递机制及临床应用奠定了基础。
| [1] |
PITTENGER MF, MACKAY AM, BECK SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411): 143-147. DOI:10.1126/science.284.5411.143 |
| [2] |
LI TF, YAN YM, WANG BY, et al. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis[J]. Stem Cells Dev, 2013, 22(6): 845-854. DOI:10.1089/scd.2012.0395 |
| [3] |
HU GW, LI Q, NIU X, et al. Exosomes secreted by human-induced pluripotent stem cell-derived mesenchymal stem cells attenuate limb ischemia by promoting angiogenesis in mice[J]. Stem Cell Res Ther, 2015, 6: 10. DOI:10.1186/scrt546 |
| [4] |
SHEN T, ZHENG QQ, SHEN J, et al. Effects of adipose-derived mesenchymal stem cell exosomes on corneal stromal fibroblast viability and extracellular matrix synthesis[J]. Chin Med J, 2018, 131(6): 704-712. DOI:10.4103/0366-6999.226889 |
| [5] |
KATSUDA T, TSUCHIYA R, KOSAKA N, et al. Human adipose tissue-derived mesenchymal stem cells secrete functional neprilysin-bound exosomes[J]. Sci Rep, 2013, 3: 1197. DOI:10.1038/srep01197 |
| [6] |
GRANÉLI C, THORFVE A, RUETSCHI U, et al. Novel markers of osteogenic and adipogenic differentiation of human bone marrow stromal cells identified using a quantitative proteomics approach[J]. Stem Cell Res, 2014, 12(1): 153-165. DOI:10.1016/j.scr.2013.09.009 |
| [7] |
SIVANATHAN KN, GRONTHOS S, ROJAS-CANALES D, et al. Interferon-gamma modification of mesenchymal stem cells:implications of autologous and allogeneic mesenchymal stem cell therapy in allotransplantation[J]. Stem Cell Rev Rep, 2014, 10(3): 351-375. DOI:10.1007/s12015-014-9495-2 |
| [8] |
FRASER JK, WULUR I, ALFONSO Z, et al. Fat tissue:an underappreciated source of stem cells for biotechnology[J]. Trends Biotechnol, 2006, 24(4): 150-154. DOI:10.1016/j.tibtech.2006.01.010 |
| [9] |
蒋欢, 刘尧, 陈旭. 间充质干细胞外泌体应用于组织再生的研究进展[J]. 中国医科大学学报, 2018, 47(1): 73-77. DOI:10.12007/j.issn.02584646.201801.016 |
| [10] |
李超然, 黄桂林, 王帅. 间充质干细胞来源外泌体促进损伤组织修复与再生的应用与进展[J]. 中国组织工程研究, 2018, 22(1): 133-139. DOI:10.3969/j.ssn.2095-4344.0423 |
| [11] |
余思, 刘尧, 陈旭. 间充质干细胞外泌体免疫调节作用及其机制的研究进展[J]. 中国医科大学学报, 2018, 47(10): 939-941. DOI:10.12007/j.issn.0258-4646.2018.10.017 |
| [12] |
KOH YQ, ALMUGHLLIQ FB, VASWANI K, et al. Exosome enrichment by ultracentrifugation and size exclusion chromatography[J]. Front Biosci(Landmark Ed), 2018, 23: 865-874. DOI:10.2741/4621 |
| [13] |
HISEY CL, DORAYAPPAN KDP, COHN DE, et al. Microfluidic affinity separation chip for selective capture and release of label-free ovarian cancer exosomes[J]. Lab Chip, 2018, 18(20): 3144-3153. DOI:10.1039/c8lc00834e |
| [14] |
ZHAO H, SHANG QW, PAN ZZ, et al. Exosomes from adipose-derived stem cells attenuate adipose inflammation and obesity through polarizing M2 macrophages and beiging in white adipose tissue[J]. Diabetes, 2018, 67(2): 235-247. DOI:10.2337/db17-0356 |
 2020, Vol. 49
2020, Vol. 49