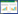文章信息
- 刘和合, 张欣馨, 王游津, 孔珺
- LIU Hehe, ZHANG Xinxin, WANG Youjin, KONG Jun
- 小鼠视网膜内Spata7基因敲除模型构建及其光感受器细胞凋亡机制的研究
- Mechanism of apoptosis in retinal photoreceptor cells in Spata7 knockout mice
- 中国医科大学学报, 2020, 49(12): 1070-1075
- Journal of China Medical University, 2020, 49(12): 1070-1075
-
文章历史
- 收稿日期:2020-05-05
- 网络出版时间:2020-12-03 10:26
视网膜色素变性(retinitis pigmentosa,RP)是一种进行性、不可逆性、遗传性视网膜疾病[1]。常表现为夜盲、视野缺损和渐进性视力下降。RP一般先累及中周部视网膜,逐渐向后极部进展。这是由于光感受器细胞中的视杆细胞最先发生凋亡,随着疾病进展,视锥细胞也逐渐死亡[2-3]。目前已发现超过80种基因可导致RP。Spata7基因突变是导致早发型隐性遗传RP的关键基因之一,可致光感受器细胞早期死亡[4-7]。Spata7蛋白表达于视网膜光感受器细胞中连接纤毛处,其突变导致光感受器细胞的连接纤毛破坏,引发光感受器细胞相关蛋白的内节到外节的转运障碍[8-9]。视紫红质蛋白(rhodopsin,RHO)位于光感受器细胞外节处,是维持光感受器细胞功能的重要蛋白。当RHO合成后无法被转运到光感受器细胞外节时,会停留在光感受器细胞内质网(endoplasmic reticulum,ER),导致ER应激,并发生光感受器细胞死亡[10-13]。部分RP是由于RHO在光感受器细胞ER内的非正常折叠或运输障碍造成。由此推测Spata7基因突变可能导致RHO在ER内聚集,发生ER应激,导致光感受器细胞死亡。
规律间隔成簇短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR) /Cas9技术是近年来用于基因敲除的基因编辑方法,多用于全身目的基因敲除[14-16]。本研究首次运用腺相关病毒(adeno-associated virus,AAV)作为载体,将CRISPR/Cas9系统搭载入视网膜,构建Spata7视网膜内敲除模型,验证了CRISPR/Cas9技术视网膜内靶向敲除的有效性,并进一步探讨了Spata7基因在光感受器细胞中的功能。
1 材料与方法 1.1 实验动物C57BL/6基因背景的野生型小鼠在12 h光照和12 h暗适应下饲养。本研究严格遵守ARVO关于在眼科和视觉研究中的动物使用声明,实验方案获得中国医科大学伦理委员会的批准。
1.2 方法 1.2.1 AAV载体的构建运用http://crispr-era.stanford.edu网站进行Spata7 gRNA的设计,选取分数最高的gRNA (GTTCTGGACTTCGCTGGAGG)。将Spata7 gRNA克隆进pTR-GRK1 AAV8载体,同时将GFP克隆入同一载体,形成AAV8-GRK1-GFP-Spata7 gRNA结构。将Cas9单独克隆入另一载体,形成AAV8-GRK-Cas9载体结构。AAV8-Spata7gRNA和AAV8-Cas9的病毒浓度分别为3.15×1013和3.45×1013 vg/mL。
1.2.2 视网膜下注射AAV8-Spata7gRNA-GFP与AAV8-Cas9按1︰1混合。将出生14 d的小鼠分为2组,实验组右眼注射1 µL AAV混合液,左眼注射等量PBS,对照组左右眼均注射1 µL PBS,以对照注射本身对左右眼带来的损伤。将小鼠麻醉后,用30号斜角针头在角巩膜缘睫状体平坦部进行浅穿刺,将35号钝针引入玻璃体腔并向腹侧推进,直到针尖穿过视网膜,用超微量泵Ⅱ和Micro4控制器将病毒悬液注入视网膜下间隙。
1.2.3 视网膜电生理检查将小鼠置于暗室过夜后,在暗室内行暗适应视网膜电图(electroretinogram,ERG)检查,采用6个闪光强度(-34,-24,-14,-4,0,10 dB)记录a波和b波。
1.2.4 实时PCR于注射1个月后摘取小鼠视网膜,三唑试剂(美国Invitrogen公司)提取总RNA,DNA酶Ⅰ (美国Invitrogen公司)处理,防止基因组DNA污染。反转录产生cDNA。采用Maxima SYBR Green/ROX qPCR Master Mix (美国Fisher Scientific公司)和StepOne实时PCR系统(美国Invitrogen公司)测定敲除后Spata7的mRNA表达水平,并用GAPDH进行标准化。Spata7上游引物序列为5’- TACCCGCCCATAAAGTCAAG-3’,下游引物序列为5’-CAGATGGGGACAGTGATGTG-3’;GAPDH引物序列为5’-ACCCAGAAGACTGTGGATGG-3’,5’-CACATTGGGGGTAGGAACAC-3’。
1.2.5 免疫荧光检测及HE染色处死小鼠后,取眼球置入Davidson’s fixative溶液固定过夜,脱水、包埋、切片,制成7 µm厚切片。切片脱蜡后行抗原修复,冷却后用1×PBS清洗。于0.5%TBS-Triton X中孵育20 min后,在含有10%山羊血清的缓冲液中室温孵育1 h,加入1︰500鸡抗GFP、1︰25小鼠抗cas9、1︰500小鼠抗RHO抗体和1︰100兔抗chop,4 ℃孵育过夜。TBS洗涤,二抗(1︰500 Alexa Fluor®488结合山羊抗兔IgG、1︰500 Cy3®山羊抗鼠IgG、1︰500 Cy3®山羊抗鸡IgG)室温下孵育2 h。用1︰1 000 Topro3/DAPI和洗涤液对细胞核进行复染。最后,在载玻片上滴入长效防污剂(美国Life Technologies公司)。石蜡切片HE染色,所有切片取材位置相同,为靠近视盘中央处。
1.3 统计学分析采用GraphPad Prism5统计软件进行数据分析和图表绘制,采用独立样本t检验比较,P < 0.05为差异有统计学意义。
2 结果 2.1 Spata7体内敲除后眼底照相对AAV注射1个月后的实验组小鼠进行眼底照相,观察小鼠的视网膜损伤情况以及GFP的表达情况。如图 1所示,在正常光频道下,可见AAV注射眼视网膜鼻上方及颞上方血管弓附近视网膜色素上皮萎缩、边界不清,视网膜鼻上方可见星状白色增殖膜,病灶面积约占视网膜10%~20%,病灶内继发色素增殖呈斑驳样,并伴有部分黄色渗出,视盘周围血管纹理清晰,色泽正常。病灶周边可见荧光着染,提示GFP在AAV注射眼视网膜细胞内大量表达。蓝光下可见与PBS注射眼相比,AAV注射眼有大量的GFP表达,几乎覆盖整个视网膜,表达效率约为80%。说明病毒注射成功,视网膜注射和病毒感染保持较高效率。
|
| 图 1 视网膜下腔注射1个月后实验组小鼠眼底照相检查结果 Fig.1 Fundus imaging results of mice in experimental group one month after injection |
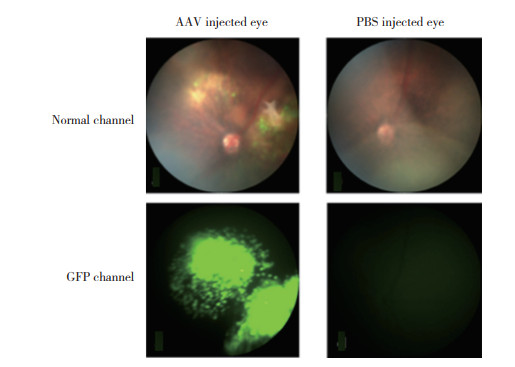
根据小鼠视网膜眼底照相结果确定病毒感染成功后,取实验组及对照组小鼠各4只行ERG,检查注射后光感受器细胞的功能。结果如图 2所示,在不同光照强度下,对照组小鼠左右眼a波和b波数值接近(P > 0.05),且在正常数值范围内(在光强度为1 cd2/m2时,a波正常值为100~150 μv,b波正常值300~350 μv)。说明视网膜下腔注射不会对视网膜造成损伤。而实验组小鼠在不同光照强度下,AAV注射眼a波和b波均明显低于PBS对照眼,在光强度为1 cd2/m2时,a波降低约100 μv,b波降低约200 μv (P < 0.05),提示AAV注射眼光感受器细胞大量死亡。
|
| A, a wave and b wave amplitude in control group; B, a wave and b wave amplitude in experimental group. 图 2 视网膜下注射1个月后2组小鼠ERG检查结果 Fig.2 One month after sub-retinal injection, the results of ERG in the two groups were examined |
2.2 Spata7基因体内敲除的效率
将4只注射AAV 1个月后的实验组小鼠处死,取视网膜行实时荧光定量PCR检测。结果显示,AAV注射眼Spata7的表达效率比PBS注射眼低54%,差异有统计学意义(P < 0.05)。说明1 µL AAV病毒/CRISPR系统混合液(浓度3×1013 vg/mL)行一次性视网膜下腔注射对Spata7基因的敲除效率为54%。
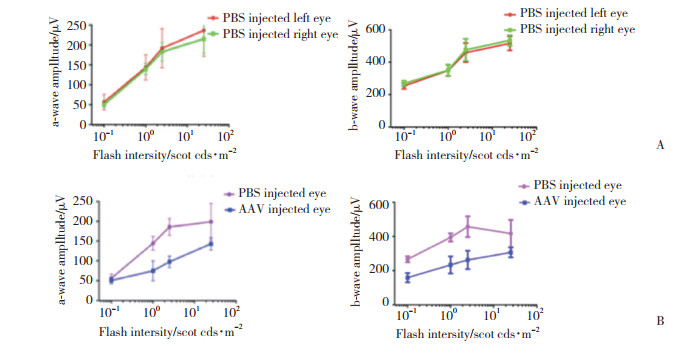
2.3 HE染色结果HE染色结果如图 3所示,对照组(左右眼均注射PBS)左右眼视网膜光感受器细胞层厚度一致且未见明显细胞死亡。进一步说明了视网膜下腔注射不会对光感受器细胞产生大的损伤,且左右眼注射水平相对一致。而实验组小鼠AAV注射眼光感受器细胞层(外核层)明显薄于PBS对照眼,意味着Spata7部分敲除后光感受器细胞大量死亡。
|
| A, PBS treated eyes in control group; B, AAV treated eye and PBS treated eye in experimental group. Scale bar=20 μm. ONL, outer nuclear layer; INL, inner nuclear layer. 图 3 实验组和对照组小鼠的HE染色结果 Fig.3 HE Staining results of the mice in experimental and control groups |
2.4 免疫荧光染色结果
免疫荧光染色结果显示,GFP和Cas9蛋白的表达基本覆盖整个视网膜,与眼底照相结果一致。AAV-Spata7-GFP-gRNA和AAV-Cas9病毒可感染同一光感受器细胞,实现了对细胞内Spata7基因的敲除(图 4)。与PBS注射眼相比,实验组小鼠AAV注射眼ER内RHO大量表达于光感受器细胞内节,少量表达于外核层。同时,在AAV注射眼光感受器细胞内节中可见ER应激标记蛋白CHOP的表达(图 5)。
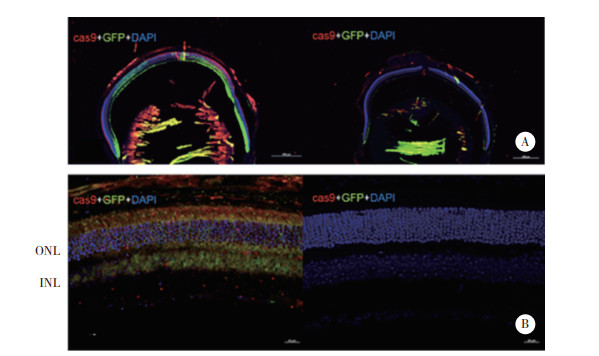
|
| A, GFP and Cas9 immunofluorescence staining results in the whole retina (scale bar =50 μm); B, GFP and Cas9 immunofluorescence staining results in ONL (scale bar =20 μm). OS, outer segment; IS, inner segment. 图 4 GFP与Cas9蛋白的免疫荧光染色结果 Fig.4 Immunofluorescence staining results of GFP and Cas9 |
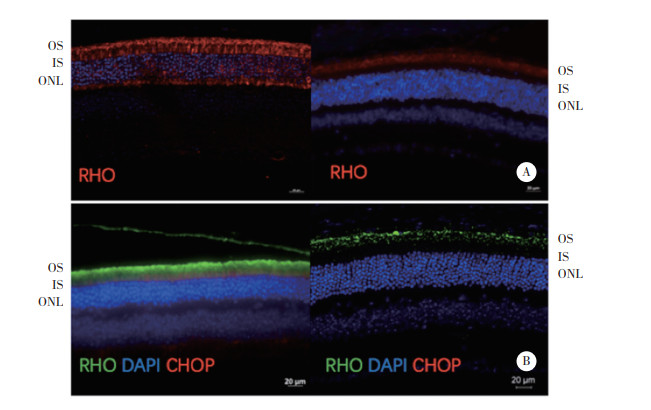
|
| A, AAV treated eye and PBS treated control eye (scale bar =50 μm); B, AAV treated eye and PBS treated control eye (scale bar =20 μm). 图 5 RHO和CHOP免疫荧光染色结果 Fig.5 Immunofluorescence staining results of RHO and CHOP |
3 讨论
为了研究Spata7基因突变后光感受器细胞死亡的机制,本研究首次运用AAV载体和视网膜下腔注射技术,在小鼠视网膜内建立了CRISPR/Cas9系统,对Spata7基因进行视网膜内特异性敲除。实验组小鼠眼底照相显示GFP高表达,免疫荧光显示GFP和Cas9蛋白广泛表达,qRT-PCR显示Spata7 mRNA表达水平显著降低,均表明AAV感染及Spata7视网膜内敲除效率较高;实验组小鼠ERG a波和b波峰值显著降低,视网膜光感受器细胞层(外核层)明显变薄,表明光感受器细胞大量死亡,提示Spata7基因视网膜内敲除模型建立成功。该模型的建立,对比传统意义上利用CRISPR/Cas9技术构建Spata7基因敲除鼠,获得的效果等同,即敲除后早期即发生光感受器细胞大量死亡。但本模型的优势在于定点敲除视网膜内的Spata7基因,而全身其他器官的Spata7基因则被保留,因此,不影响小鼠发育及其他器官功能,尤其是公鼠的睾丸功能,保证了敲除鼠的生育能力。同时,该方法与利用Cre-Loxp系统构建的选择性敲除鼠相比,优势在于耗时少,方法简单,不需要进行筛选[17-18],既避免了全身敲除对小鼠其他器官功能带来伤害,又大幅节省了研究时间,提高了研究效率。同为运用AAV作为载体搭载CRISPR/Cas9系统进入视网膜,另一研究团队用此方法对小鼠RHO基因进行了敲除,但其AAV对视网膜的感染效率仅为30%,目的基因的敲除效率也随之显著降低[19]。而本研究通过改进小鼠视网膜下腔注射的进针角度,大幅提高了AAV感染效率。小鼠视网膜下腔注射常规进针角度与水平面成45°,但本研究组发现由于出生14 d小鼠与成年鼠眼位有细微差别,导致斜行45°进针并不能保证注射位点靠近视网膜后极部,从而导致AAV感染效率降低,故将进针角度调高至75°~80°,保证了注射位点靠近后极部,大幅度提高了AAV对视网膜的感染效率(80%),保证了CRISPR/Cas9系统对Spata7基因的有效敲除。
本研究对Spata7基因视网膜内敲除1个月后光感受器细胞的死亡机制进行了探讨。结果显示,RHO在实验组小鼠AAV注射眼光感受器细胞内节中呈高表达,提示RHO滞留在光感受器细胞ER内。ER应激标记蛋白CHOP在小鼠AAV注射眼光感受器细胞内节中高表达,意味着RHO在ER内的聚集引发了ER应激。说明视网膜内敲除Spata7基因后,RHO不能被转运到光感受器细胞外节,而停留在了ER,造成了ER应激,导致光感受器细胞凋亡。
本研究也存在局限性:仅探讨了AAV注射1个月后Spata7基因的敲除情况及敲除后的光感受器细胞死亡情况,关于AAV搭载的CRISPR/Cas9系统对Spata7基因的远期敲除效应还有待继续研究;仅对AAV注射眼和PBS对照眼的光感受器细胞死亡情况和RHO运输情况进行了比较,未对AAV注射眼内不同AAV注射效率区域之间进行比较;Spata7视网膜内的敲除效率还可进一步提高。对此,可将常用的、分子量较大的SpCas9改为近年新发现的、分子量较小的SaCas9,使Cas9、gRNA和GFP包装进入同一AAV载体,以克服AAV载体容量有限不能同时搭载这三者的局限性[20],同时在此基础上可设计多个gRNA同步定位Spata7基因,以提高敲除效率。
| [1] |
ZHANG QJ. Retinitis pigmentosa[J]. Asia-Pac J Ophthalmol, 2016, 5(4): 265-271. DOI:10.1097/apo.0000000000000227 |
| [2] |
PAGON RA. Retinitis pigmentosa[J]. Surv Ophthalmol, 1988, 33(3): 137-177. DOI:10.1016/0039-6257(88)90085-9 |
| [3] |
NATARAJAN S. Retinitis pigmentosa:a brief overview[J]. Indian J Ophthalmol, 2011, 59(5): 343-346. DOI:10.4103/0301-4738.83608 |
| [4] |
XIAO X, SUN W, LI S, et al. Spectrum, frequency, and genotype-phenotype of mutations in SPATA7[J]. Mol Vis, 2019, 25: 821-833. |
| [5] |
MATSUI R, MCGUIGANⅢ DB, GRUZENSKY ML, et al. SPATA7:evolving phenotype from cone-rod dystrophy to retinitis pigmentosa[J]. Ophthalmic Genet, 2016, 37(3): 333-338. DOI:10.3109/13816810.2015.1130154 |
| [6] |
PERRAULT I, HANEIN S, GERARD X, et al. Spectrum of SPATA7 mutations in Leber congenital amaurosis and delineation of the associated phenotype[J]. Hum Mutat, 2010, 31(3): E1241-E1250. DOI:10.1002/humu.21203 |
| [7] |
EBLIMIT A, AGRAWAL SA, THOMAS K, et al. Corrigendum to "Conditional loss of Spata7 in photoreceptors causes progressive retinal degeneration in mice"[ExpExp. Eye Res. 166 (2018) 120-130][J]. Exp Eye Res, 2018, 171: 119. DOI:10.1016/j.exer.2018.03.011 |
| [8] |
ZAHID S, BRANHAM K, SCHLEGEL D, et al. SPATA7. In: retinal dystrophy gene atlas[M]. Berlin: Springer International Publishing, 2018: 257-258. DOI: 10.1007/978-3-319-10867-4_79.
|
| [9] |
DHARMAT R, EBLIMIT A, ROBICHAUX MA, et al. SPATA7 maintains a novel photoreceptor-specific zone in the distal connecting cilium[J]. J Cell Biol, 2018, 217(8): 2851-2865. DOI:10.1083/jcb.201712117 |
| [10] |
ILLING ME, RAJAN RS, BENCE NF, et al. A rhodopsin mutant linked to autosomal dominant retinitis pigmentosa is prone to aggregate and interacts with the ubiquitin proteasome system[J]. J Biol Chem, 2002, 277(37): 34150-34160. DOI:10.1074/jbc.M204955200 |
| [11] |
LEE WS, YOO WH, CHAE HJ. ER stress and autophagy[J]. Curr Mol Med, 2015, 15(8): 735-745. DOI:10.2174/1566524015666150921105453 |
| [12] |
RASHID HO, YADAV RK, KIM HR, et al. ER stress:autophagy induction, inhibition and selection[J]. Autophagy, 2015, 11(11): 1956-1977. DOI:10.1080/15548627.2015.1091141 |
| [13] |
PRICE BA, SANDOVAL IM, CHAN F, et al. Mislocalization and degradation of human P23H-rhodopsin-GFP in a knockin mouse model of retinitis pigmentosa[J]. Invest Ophthalmol Vis Sci, 2011, 52(13): 9728-9736. DOI:10.1167/iovs.11-8654 |
| [14] |
JACINTO FV, LINK W, FERREIRA BI. CRISPR/Cas9-mediated genome editing:From basic research to translational medicine[J]. J Cell Mol Med, 2020, 24(7): 3766-3778. DOI:10.1111/jcmm.14916 |
| [15] |
CHEN SM, YAO YF, ZHANG YC, et al. CRISPR system:Discovery, development and off-target detection[J]. Cell Signal, 2020, 70: 109577. DOI:10.1016/j.cellsig.2020.109577 |
| [16] |
SARIN S, ZUNIGA-SANCHEZ E, KURMANGALIYEV YZ, et al. Role for wnt signaling in retinal neuropil development:analysis via RNA-seq and in vivo somatic CRISPR mutagenesis[J]. Neuron, 2018, 98(1): 109-126. DOI:10.1016/j.neuron.2018.03.004 |
| [17] |
TANG JC, RUDOLPH S, DHANDE OS, et al. Cell type-specific manipulation with GFP-dependent Cre recombinase[J]. Nat Neurosci, 2015, 18(9): 1334-1341. DOI:10.1038/nn.4081 |
| [18] |
JIMENO D, FEINER L, LILLO C, et al. Analysis of kinesin-2 function in photoreceptor cells using synchronous Cre-loxP knockout of Kif3a with RHO-Cre[J]. Invest Ophthalmol Vis Sci, 2006, 47(11): 5039-5046. DOI:10.1167/iovs.06-0032 |
| [19] |
TSAI YT, WU WH, LEE TT, et al. Clustered regularly interspaced short palindromic repeats-based genome surgery for the treatment of autosomal dominant retinitis pigmentosa[J]. Ophthalmology, 2018, 125(9): 1421-1430. DOI:10.1016/j.ophtha.2018.04.001 |
| [20] |
RAN FA, CONG L, YAN WX, et al. In vivo genome editing using Staphylococcus aureus Cas9[J]. Nature, 2015, 520(7546): 186-191. DOI:10.1038/nature14299 |
 2020, Vol. 49
2020, Vol. 49