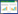文章信息
- 方晓丹, 李娟, 戴姝艳
- FANG Xiaodan, LI Juan, DAI Shuyan
- TIM-3在宫颈癌外周血T细胞中的表达及相关性研究
- Expression of TIM-3 in T cells from the peripheral blood of cervical cancer patients: correlation analysis
- 中国医科大学学报, 2020, 49(11): 1011-1015
- Journal of China Medical University, 2020, 49(11): 1011-1015
-
文章历史
- 收稿日期:2019-10-31
- 网络出版时间:2020-10-29 10:01
宫颈癌是威胁女性生命健康的妇科肿瘤疾病。在中国,每年有13.15万宫颈癌新发患者,占全球新发宫颈癌的28.8%[1]。高危型人乳头瘤病毒(human papilloma virus,HPV)感染已确定与宫颈癌的发病密切相关,在宫颈癌中,HPV是位于皮肤表层的感染侵袭,因此奠定了T细胞介导的细胞免疫在宫颈癌免疫应答中的地位[2]。T细胞免疫球蛋白黏蛋白(T cell immunoglobulin mucin domain containing molecules,TIM)-3是TIM家族中的一员。目前研究[3]表明,其在自身免疫性疾病、慢性病毒感染及肿瘤的发生发展中均发挥着重要的调控作用。TIM-3可与多种配体结合,进而抑制T细胞介导的免疫应答,参与诱导免疫耐受[4]。TIM-3已经被证实在非小细胞肺癌[5]、胃癌[6]、食管癌[7]和前列腺癌[8]等多种癌症外周血T细胞中高表达,但有关TIM-3在宫颈癌外周血T细胞中的表达鲜有研究。因此,本研究主要检测了宫颈癌患者外周血中CD4+T细胞和CD8+T细胞表达水平及T细胞中TIM-3的表达情况,并探讨TIM-3的表达与宫颈癌患者病理参数的相关性,为TIM-3成为宫颈癌患者临床免疫治疗提供实验依据。
1 材料与方法 1.1 临床资料研究标本来自2017年8月至2018年1月于中国医科大学附属盛京医院妇科病房住院手术的患者。观察组包括宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)Ⅱ~Ⅲ期15例,年龄范围为23~55岁;宫颈癌患者24例,年龄范围为30~63岁。对照组为术后石蜡病理证实为畸胎瘤且宫颈筛查未见异常(宫颈HPV检测为阴性且液基细胞学检查未见上皮内病变)的患者,共21例,年龄范围为20~42岁。2组患者年龄等一般资料无统计学差异(P > 0.05)。根据国际妇产科协会(Federation International of Gynecology and Obstetr,FIGO)临床分期(2009年)将宫颈癌患者分为Ⅰ~Ⅱ期16例,Ⅲ~Ⅳ期8例,所有患者均签署知情告知同意书,研究获得中国医科大学盛京医院伦理委员会批准。纳入标准:(1)所有患者均非亲属关系;(2)所有病例组患者均经病理学证实,CIN患者均经术后病理证实,宫颈癌患者为原发性宫颈癌,不伴有其他肿瘤疾病;(3)所有患者均为未进行放疗或者化疗的初诊患者。排除标准:(1)1个月内接受过输血治疗的患者;(2)合并免疫系统疾病或使用过免疫相关药物的患者;(3)2周内进行过抗炎治疗的患者。
1.2 仪器与试剂人淋巴细胞分离液(天津灏洋生物制品科技有限公司);Multifuge 3SR+台式冷冻离心机(德国赫利氏公司);流式细胞仪(美国BD公司的BD FACSCalibur型流式细胞仪);FITC标记的鼠抗人CD4单克隆抗体(货号:555346,美国BD公司);PE-Cy5标记的鼠抗人CD8单克隆抗体(货号:555636,美国BD公司);PE标记的鼠抗人TIM-3单克隆抗体(货号:fab2365p,美国RD公司)。
1.3 方法取所有受试者清晨空腹静脉外周血2 mL,使用肝素钠抗凝管常温保存。用密度梯度离心法提取外周血单个核细胞(peripheral blood mononuclear cell,PBMC),将PBMC悬液中加入5倍体积PBS混匀,水平2 000 r/min离心5 min,4 ℃。弃上清,PBS重悬后加入PE-Cy5标记的鼠抗人CD4单克隆抗体、FITC标记的鼠抗人CD8单克隆抗体、PE标记的鼠抗人TIM-3抗体进行标记,避光孵育30 min;采用PBS清洗2次,1 200 r/min离心5 min,弃上清,加入PBS重悬。采用流式细胞术检测CD4+T细胞,CD8+T细胞及细胞表面TIM-3的表达。
1.4 统计学分析所有标本经过Flowjo7.6.5分析,数据录入SPSS 22.0统计软件进行统计学分析,并使用GraphPad Prism 6软件绘制图形。计量数据以x±s表示,采用LSD-t检验进行多个样本均数两两之间的比较,计数资料统计采用Fisher确切法,P < 0.05为差异有统计学意义。
2 结果 2.1 宫颈癌患者外周血T细胞的表达荧光标记宫颈病变患者及非宫颈病变患者外周血CD4+T细胞及CD8+T细胞,流式细胞仪分析后数据再进行统计学分析。结果表明,在宫颈病变患者中,宫颈癌(18.54%±7.52%)及CIN患者(21.29%±11.31%)外周血中的CD4+T细胞百分比明显低于非宫颈病变患者(30.43%±8.43%),差异有统计学意义(P < 0.05),但是宫颈癌与CIN变患者之间无统计学差异。CIN外周血中的CD8+T细胞百分比(20.38%±9.79%)较非宫颈病变患者(27.35%±11.67%)明显降低,差异有统计学意义(P < 0.05)。宫颈癌患者外周血中的CD8+T细胞百分比(16.17%±9.27%)也较非宫颈病变患者(27.35%±11.67%)明显降低,差异有统计学意义(P < 0.05)。而宫颈癌患者与CIN患者外周血中的CD8+T细胞百分比无统计学差异。
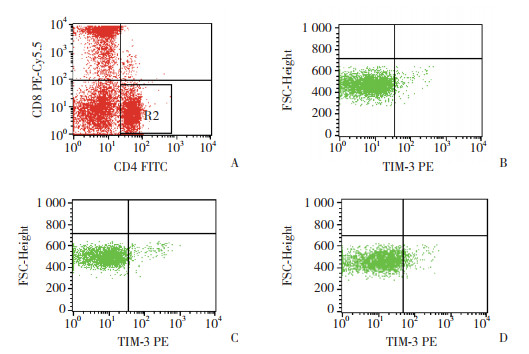
2.2 TIM-3在宫颈癌患者外周血T细胞表面的表达流式细胞仪方法分析TIM-3在外周血CD4+T及CD8+T细胞的表达(图 1、2),结果显示,TIM-3在CIN患者及宫颈癌患者外周血CD4+T细胞表面的表达量分别为8.24%±9.58%及8.38%±9.13%,高于对照组的表达量(3.41%±2.82%),差异有统计学意义(P < 0.05)。TIM-3在CIN患者及宫颈癌患者外周血CD8+T细胞表面的表达量分别17.72%±10.55%及18.78%± 10.22%,较对照组的表达量(11.11%±5.49%)高,差异有统计学意义(P < 0.05)。而宫颈癌患者与CIN患者外周血CD8+T细胞表面的表达量无统计学差异。
|
| A, CD4+ T-cells in the peripheral blood:gating strategy; B, expression of TIM-3 on the surface of CD4+ T-cells in the peripheral blood of an individual with no cervical lesions; C, expression of TIM-3 on the surface of CD4+ T-cells in the peripheral blood of a CIN patient; D, expression of TIM-3 on the surface of CD4+ T-cells in the peripheral blood of a cervical cancer patient. 图 1 TIM-3在对照组、CIN患者及宫颈癌患者外周血CD4+T细胞上的表达 Fig.1 TIM-3 expression on CD4+T-cells in the peripheral blood of a healthy control, a CIN patient, and a cervical carcinoma patient |
|
| A, CD8+ T- cells in the peripheral blood:gating strategy; B, expression of TIM-3 on the surface of CD8+ T-cells in the peripheral blood of an individual with no cervical lesions; C, expression of TIM-3 on the surface of CD8+ T-cells in the peripheral blood from a CIN patient; D, expression of TIM-3 on the surface of CD8+ T-cells in the peripheral blood of a cervical cancer patient. 图 2 TIM-3在对照组、CIN患者及宫颈癌患者外周血CD8+T细胞上的表达 Fig.2 TIM-3 expression on CD8+T-cells in the peripheral blood of a healthy control, a CIN patient, and a cervical carcinoma patient |
2.3 TIM-3在宫颈癌患者外周血T细胞表达与临床病理因素的关系(表 1)
| Parameters | n | Expression of TIM-3 on CD8+T cells | P | Expression of TIM-3 on CD4+T cells | P | ||
| Low(n = 12) | High(n = 12) | Low(n = 12) | High(n = 12) | ||||
| FIGO stage | 0.001 | 0.027 | |||||
| Ⅰ-Ⅱ | 16 | 12 | 4 | 11 | 5 | ||
| Ⅲ-Ⅳ | 8 | 0 | 8 | 1 | 7 | ||
| Age(year) | 0.640 | 1.000 | |||||
| <60 | 18 | 10 | 8 | 9 | 9 | ||
| ≥60 | 6 | 2 | 4 | 3 | 3 | ||
| Lymph node | 0.684 | 0.102 | |||||
| Negative | 12 | 7 | 5 | 8 | 4 | ||
| Positive | 12 | 5 | 7 | 4 | 8 | ||
| Tumor size(cm) | 0.414 | 0.219 | |||||
| <2 | 13 | 8 | 5 | 8 | 5 | ||
| ≥2 | 11 | 4 | 7 | 4 | 7 | ||
| Squamous cell carcinoma antigen | 0.680 | 0.098 | |||||
| Elevated | 14 | 6 | 8 | 5 | 9 | ||
| Normal | 10 | 6 | 4 | 7 | 3 | ||
对24位宫颈癌患者进一步分析,结果显示,Ⅲ~Ⅳ期患者外周血中的TIM-3在CD4+T及CD8+T细胞中的百分比与I~Ⅱ期比较有统计学差异,TIM-3在宫颈癌外周血T细胞表面的表达水平与FIG0(2009年)临床分期相关(P < 0.05),与淋巴结转移、肿物大小、年龄及鳞状细胞癌抗原值高低无相关性(P > 0.05)。
3 讨论宫颈癌是最常见的妇科恶性肿瘤,在病毒感染初期CD4+T(Th0)细胞在接受到不同信号的刺激后,分别向适应机体条件的方向分化,肿瘤微环境中T细胞的功能障碍或衰竭是肿瘤发病的关键机制[9-10]。目前,恢复功能障碍T细胞的抗肿瘤活性已成为肿瘤免疫治疗领域的研究热点[11-12]。
TIM-3是TIM家族中的一员,于2002年首次于小鼠Th1及CD8+T细胞上被发现[4],随后的研究[13-16]表明TIM-3也表达于树突细胞(dendritic cell,DC)、自然杀伤(natural killer,NK)细胞及肥大细胞等固有免疫细胞表面。TIM-3在慢性病毒感染和肿瘤中起负性免疫调节作用,其持续表达能诱导T细胞的凋亡,导致T细胞功能耗竭[17-19]。JONES等[20]研究表明,TIM-3在获得性免疫缺陷综合征患者的CD4+T细胞和CD8+T细胞表面高表达,与CD4+T细胞数量成反比,与血浆中病毒载量呈正相关。在慢性乙型病毒感染性肝炎患者中,TIM-3在乙型肝炎病毒特异性CD8+T细胞表面的表达水平明显升高,通过阻断Gal-9/TIM-3信号通路可以有效恢复乙型肝炎病毒特异性CD8+T细胞的功能[21-22]。但TIM-3在宫颈癌领域少有研究,本研究结果显示,宫颈病变(宫颈癌及CIN)患者较非宫颈病变患者外周血CD4+T细胞及CD8+T细胞减少,但外周血CD4+T细胞及CD8+T细胞表面的TIM-3表达水平明显升高,与TIM-3在其他疾病中的研究结果一致。本课题组的前期研究[23]显示,Galetin-9在宫颈鳞状癌中过度表达,并且与FIGO(2009年)分期呈正性作用,以上结果均与本研究的结果契合。TIM-3作为免疫负性调节家族中一员,其高表达可诱导T细胞凋亡,导致T细胞功能耗竭,使宫颈病变患者CD4+T细胞及CD8+T细胞的表达百分比减少,从而促进宫颈癌的发生发展。
本研究进一步深入分析了宫颈癌的不同临床病理因素与TIM-3在外周血T细胞表达水平的关系。结果显示,TIM-3在外周血T细胞的表达水平与宫颈癌的分期呈正相关。与年龄、肿瘤大小、淋巴结转移及鳞状细胞癌抗原升高无相关性。说明宫颈癌的发生的发展可能是一个多因素多环节的过程。
本研究结果显示,TIM-3在宫颈癌外周血T细胞表面高表达,并且与分期呈正性关系,对宫颈癌的早期病毒感染期的预防治疗提供依据,同时为疾病的靶向特异性治疗提供理论依据。然而本研究对于TIM-3在宫颈癌中具体的作用机制并未进行深入研究,并且缺乏组织水平上研究,日后仍然需要大量实验进一步研究。TIM-3很可能成为一种新的免疫学治疗靶点。
| [1] |
陈慧, 周思园, 孙振球. 常见妇科三大恶性肿瘤的流行及疾病负担研究现状[J]. 中国现代医学杂志, 2015, 25(6): 108-112. |
| [2] |
包振宇, 邹先彪, 张云杰. 人乳头瘤病毒感染及其免疫学进展[J]. 实用皮肤病学杂志, 2015, 8(4): 284-286, 290. DOI:10.11786/sypfbxzz.1674-1293.20150413 |
| [3] |
顾广祥. TIM-3在诱导免疫耐受中的研究进展[J]. 微生物学免疫学进展, 2017, 45(4): 70-74. DOI:10.13309/j.cnki.pmi.2017.04.015 |
| [4] |
MONNEY L, SABATOSCA, GAGLIAJL, et al. Th1-specific cell surface protein TIM-3 regulates macrophage activation and severity of an autoimmune disease[J]. Nature, 2002, 415(6871): 536. DOI:10.1038/415536a |
| [5] |
JI P, CHEN DK, BIAN JY, et al. Up-regulation of TIM-3 on CD4+ tumor infiltrating lymphocytes predicts poor prognosis in human nonsmall-cell lung cancer[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2015, 31(6): 808-811. |
| [6] |
CHENG G, LI M, WU J, et al. Expression of TIM-3 in gastric cancer tissue and its relationship with prognosis[J]. Int J Clin Exp Pathol, 2015, 8(8): 9452-9457. |
| [7] |
XIE JH, WANG J, CHENG SL, et al. Expression of immune checkpoints in T cells of esophageal cancer patients[J]. Oncotarget, 2016, 7(39): 63669-63678. DOI:10.18632/oncotarget.11611 |
| [8] |
JAPP AS, KURSUNEL MA, MEIER S, et al. Dysfunction of PSAspecific CD8+T cells in prostate cancer patients correlates with CD38 and TIM-3 expression[J]. Cancer Immunol Immunother, 2015, 64(11): 1487-1494. DOI:10.1007/s00262-015-1752-y |
| [9] |
MIRZAEI R, SARKAR S, YONG VW. T cell exhaustion in glioblastoma:intricacies of immune checkpoints[J]. Trends Immunol, 2017, 38(2): 104-115. DOI:10.1016/j.it.2016.11.005 |
| [10] |
THOMMEN DS, SCHUMACHER TN. T cell dysfunction in cancer[J]. Cancer Cell, 2018, 33(4): 547-562. DOI:10.1016/j.ccell.2018.03.012 |
| [11] |
MCKINNEY EF, SMITH KG. T cell exhaustion and immunemediated disease:the potential for therapeutic exhaustion[J]. Curr Opin Immunol, 2016, 43: 74-80. DOI:10.1016/j.coi.2016.09.005 |
| [12] |
WORONIECKA K, CHONGSATHIDKIET P, RHODIN K, et al. T-cell exhaustion signatures vary with tumor type and are severe in glioblastoma[J]. Clin Cancer Res, 2018, 24(17): 4175-4186. DOI:10.1158/1078-0432.CCR-17-1846 |
| [13] |
FRISANCHO-KISS S, NYLAND JF, DAVIS SE, et al. Cutting edge:T cell Ig mucin-3 reduces inflammatory heart disease by increasing CTLA-4 during innate immunity[J]. J Immunol, 2006, 176(11): 6411-6415. DOI:10.4049/jimmunol.176.11.6411 |
| [14] |
NAKAE S, ⅡKURA M, SUTO H, et al. TIM-1 and TIM-3 enhancement of Th2 cytokine production by mast cells[J]. Blood, 2007, 110(7): 2565-2568. DOI:10.1182/blood-2006-11-058800 |
| [15] |
ANDERSON AC, ANDERSON DE, BREGOLI L, et al. Promotion of tissue inflammation by the immune receptor TIM-3 expressed on innate immune cells[J]. Science, 2007, 318(5853): 1141-1143. DOI:10.1126/science.1148536 |
| [16] |
KHADEMI M, ILLÉS Z, GIELEN AW, et al. T Cell Ig- and mucin-domain-containing molecule-3(TIM-3)and TIM-1 molecules are differentially expressed on human Th1 and Th2 cells and in cerebrospinal fluid-derived mononuclear cells in multiple sclerosis[J]. J Immunol, 2004, 172(11): 7169-7176. DOI:10.4049/jimmunol.172.11.7169 |
| [17] |
GRABMEIER-PFISTERSHAMMER K, STECHER C, ZETTL M, et al. Antibodies targeting BTLA or TIM-3 enhance HIV-1 specific T cell responses in combination with PD-1 blockade[J]. Clin Immunol, 2017, 183: 167-173. DOI:10.1016/j.clim.2017.09.002 |
| [18] |
GEFEN T, CASTRO I, MUHAREMAGIC D, et al. A TIM-3 oligonucleotide aptamer enhances T cell functions and potentiates tumor immunity in mice[J]. Mol Ther, 2017, 25(10): 2280-2288. DOI:10.1016/j.ymthe.2017.06.023 |
| [19] |
YAN J, ZHANG Y, ZHANG JP, et al. Tim-3 expression defines regulatory T cells in human tumors[J]. PLoS One, 2013, 8(3): e58006. DOI:10.1371/journal.pone.0058006 |
| [20] |
JONES RB, NDHLOVU LC, BARBOUR JD, et al. TIM-3 expression defines a novel population of dysfunctional T cells with highly elevated frequencies in progressive HIV-1 infection[J]. J Exp Med, 2008, 205(12): 2763-2779. DOI:10.1084/jem.20081398 |
| [21] |
JU Y, HOU N, ZHANG XN, et al. Blockade of TIM-3 pathway ameliorates interferon-γ production from hepatic CD8+T cells in a mouse model of hepatitis B virus infection[J]. Cell Mol Immunol, 2009, 6(1): 35. DOI:10.1038/cmi.2009.5 |
| [22] |
WU W, SHI Y, LI SP, et al. Blockade of TIM-3 signaling restores the virus-specific CD8+T-cell response in patients with chronic hepatitis B[J]. Eur J Immunol, 2012, 42(5): 1180-1191. DOI:10.1002/eji.201141852 |
| [23] |
陈晓菲, 戴姝艳. 宫颈癌血清NO、Gal-9的表达及其与细胞凋亡的相关性[J]. 现代肿瘤医学, 2018, 26(3): 430-436. |
 2020, Vol. 49
2020, Vol. 49