文章信息
- 陆国秀, 郝珊瑚, 王治国, 张国旭
- LU Guoxiu, HAO Shanhu, WANG Zhiguo, ZHANG Guoxu
- 18F-FDG、18F-NaF PET/CT及心脏CT血管成像联合显像对2型糖尿病冠状动脉疾病的诊断及评估
- 18F-FDG and 18F-NaF PET/CT with cardiac computed tomography angiography in type 2 diabetes mellitus with coronary atherosclerotic heart disease
- 中国医科大学学报, 2020, 49(11): 1002-1006
- Journal of China Medical University, 2020, 49(11): 1002-1006
-
文章历史
- 收稿日期:2020-03-04
- 网络出版时间:2020-10-28 15:01
2型糖尿病(type 2 diabetes mellitus,T2DM)已成为严重影响老年人生活质量和寿命的常见疾病[1],糖尿病可以引起多种并发症,包括心血管疾病、肾病、视网膜病、周围神经、自主神经病变和脑病等[2]。T2DM与冠状动脉疾病密切相关,动脉斑块作为冠状动脉的慢性炎症性疾病,是导致严重心脑血管事件的重要危险因素[3]。目前常用诊断动脉斑块的影像学方法有磁共振成像血管造影、心脏CT血管成像(computed tomography angiography,CTA)及正电子发射计算机断层成像(positron emission tomography/ computer tomography,PET/CT)等[4-6]。但是由于病情发展缓慢,通常仅在急性发作或进展期被检出。能否利用斑块的组织病理学特性,寻找无创性斑块检测方法成为现代影像学发展的目标之一。
国内外关于18F-脱氧葡萄糖(18F-flurodeoxyglucos,18F-FDG)、18F-氟化钠(18F-sodium fluoride,18F-NaF)PET/CT联合CTA显像在2型糖尿病(T2DM)伴冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CAD)的研究相对较少。本研究拟通过比较18F-FDG、18F-NaF PET/CT、CTA显像,分析冠状动脉相关参数、最大标准化摄取值(the maximum standardized uptake value,SUVmax)及靶/本底比(target to background ratios,TBR)在T2DM伴CAD患者中的联合检测价值及其临床意义,提高对心血管风险的早期诊断及评估,以降低病死率。
1 材料与方法 1.1 研究对象选择2016年1月至2019年6月就诊于北部战区总医院心血管内科临床拟诊冠状动脉疾病的住院患者578例。纳入标准:(1)参照《中国2型糖尿病防治指南(2013年版)》 [7]诊断为T2DM;(2)根据临床症状、心电图、冠状动脉影像学和心肌损伤标志物等指标,应用世界卫生组织的分型和诊断标准确定CAD的患者[8];(3)患者无增强CT及PET/CT检查禁忌证;(4)患者同意上述检查并签署知情同意书。排除标准:(1)患者年龄 < 18岁;(2)怀孕或哺乳期妇女;(3)严重心律失常;(4)碘造影剂过敏;(5)血肌酐 > 1.5 mg/dL;(6)冠状动脉血管手术史,射血分数 < 35%,或心功能Ⅲ~Ⅳ级。最终选择T2DM伴CAD患者74例;按照除T2DM以外上述纳入标准连续纳入34例CAD患者,其中男55例,女53例,年龄33~78岁,平均年龄为(58.71±11.75)岁。所有入选患者均接受CTA、18F-FDG及18F-NaF PET/CT显像。此项临床研究获得本院伦理委员会批准(编号2016R11),所有入选患者均签署知情同意书。患者基本临床情况见表 1。
| Item | CAD group(n = 34) | CAD+T2DM group(n = 74) | t | P |
| Age(x±s,year) | 59.8±11.7 | 58.2±11.8 | 0.691 | 0.491 |
| Male [n(%)] | 20(58.8) | 35(47.3) | 1.244 | 0.265 |
| Risk factors [n(%)] | ||||
| Smoker | 15(44.1) | 27(42.2) | 0.034 | 0.854 |
| Hypertension | 18(52.9) | 38(51.4) | 0.024 | 0.878 |
| Heredity | 8(23.5) | 19(25.7) | 0.057 | 0.811 |
| Hypercholesterolemia | 14(41.2) | 24(32.4) | 0.781 | 0.377 |
| Involved coronary artery [n(%)] | ||||
| RCA | 17(50.0) | 24(32.4) | 3.025 | 0.082 |
| LAD | 16(47.1) | 35(47.3) | 0.001 | 0.982 |
| LCX | 15(44.1) | 42(56.8) | 1.493 | 0.222 |
| Laboratory | ||||
| Troponin T(x±s,U/L) | 12.1±1.9 | 11.7±2.0 | 1.011 | 0.314 |
| Creatine kinase(x±s,U/L) | 72.4±14.4 | 74.1±11.6 | 0.621 | 0.537 |
| RCA,right coronary artery;LAD,left anterior descending artery;LCA,left circumflex artery. | ||||
1.2 研究方法 1.2.1 CTA检查
CTA检查采用西门子双源CT(Definition),检查前给予患者β受体阻滞剂,应用低剂量非对比扫描获得血管钙化分析,随后行碘对比剂增强扫描(350 mgI/mL,65~130 mL)。冠状动脉钙化分析分别由具有5年及8年诊断经验的2名放射科医生进行,采用半自动分析软件(NetraMD,ScImage,Los Altos,CA,USA),分析冠状动脉钙化积分(coronary calcium score,CCS)、总钙化体积(total calcified volume,TPV)、无钙化体积(non-calcifiedplaques volume,NCP)和低衰减斑块体积(low attenuation plaque volume,LAP),CT值< 30 Hu。
1.2.2 18F-FDG和18F-NaF的合成及PET/CT检查18F-FDG和18F-NaF均采用GE MINItrace回旋加速器自主合成,18F-FDG及18F-NaF放化纯度均 > 99%。采用Discovery VCT PET/CTPET扫描仪,18F-FDG PET/CT扫描受检者禁食8 h以上,给药前常规检测血糖并控制在7.2 mmol/L以下;18F -NaF PET/CT受检者扫描前血糖水平无明显限制。
按体质量注入5.18 MBq/kg18F-FDG或18F-NaF,静卧60 min后按心脏扫描程序方式行三维采集;CT扫描参数为120 kV、180 m As,10个门控周期,进床速度为5 mm/圈,矩阵256×256,旋转时间为0.75 s,螺距1.0。采用CT进行非均匀透射衰减校正图像重建,数据经Ramla三维方法重建获得衰减校正影像。PET数据经低剂量CT进行衰减校正、迭代法重建后和CT图像一同传送到GE Xeleris工作站进行同机图像融合,分析及测量左前降支、左回旋支及右冠状动脉图像钙化情况、SUVmax及TBR,TBR以1.25为分界点,TBR≥1.25为摄取阳性,TBR < 1.25为摄取阴性[9]。采用心脏分析软件对图像进行预处理和统计学分析。以血管内超声检查结果作为斑块分析的金标准[10]。
1.3 统计学分析采用SPSS 17.0进行统计学分析。计量资料以x±s表示,组间比较采用t检验;计数资料进行χ2检验;CCS、TPV、NPV、LAP、SUVmax及TBR之间的相关性分析采用Pearson相关系数法,P < 0.05为差异有统计学意义。
2 结果 2.1 CTA结果分析CTA结果显示,T2DM伴CAD冠脉受累血管节段数(2.00±0.76)较单纯CAD组(1.65±0.73)多,差异有统计学意义(t = 2.269,P = 0.025)。T2DM伴CAD患者血管狭窄程度(74.34%±8.76%)较单纯CAD组(67.38%±13.58%)程度加重,差异有统计学意义(t = 3.196,P = 0.002)。2组患者CCS、TPV、NPV、LAP差异均有统计学意义,见表 2。
| Item | CAD group(n =34) | CAD+T2DM group(n =74) | t | P |
| Segments(n) | 1.65±0.73 | 2.00±0.76 | 2.269 | 0.025 |
| stent(%) | 74.34±8.76 | 67.38±13.58 | 3.196 | 0.002 |
| CCS | 178.44±89.29 | 229.05±100.86 | 2.508 | 0.014 |
| TPV(mm3) | 1 633.12±429.19 | 1 880.82±425.29 | 2.803 | 0.006 |
| NCP(mm3) | 933.39±130.62 | 1 034.92±213.09 | 2.529 | 0.013 |
| LAP(mm3) | 15.25±0.71 | 19.80±5.38 | 4.271 | 0.001 |
2.2 冠状动脉粥样病变血管的PET/CT影像分析
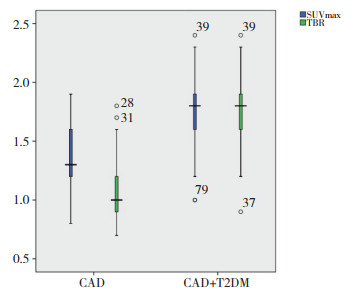
冠状动脉粥样斑块的18F-FDG、18F-NaF显像,以血管内超声(intravenous ultrasound,IVUS)结果作为金标准,18F-NaF对冠状动脉粥样硬化的灵敏度较18F-FDG高,差异有统计学意义(χ2=74,P = 0.007),见表 3;CAD+T2DM组SUVmax(1.34±0.29)较CAD组(1.75±0.28)高,差异有统计学意义(t = 6.933,P < 0.001);CAD+T2DM组TBR(1.09±0.27)较CAD组(1.79±0.24)高,差异有统计学意义(t = 13.371,P < 0.001),见图 1。
| Group | 18F-FDG | 18F-NaF | |||||||
| SE | SP | PPV | NPV | SE | SP | PPV | NPV | ||
| CAD | 73.7 | 53.3 | 66.7 | 61.5 | 80.9 | 53.8 | 73.9 | 63.6 | |
| CAD+T2DM | 81.1 | 54.9 | 82.0 | 62.9 | 87.7 | 59.3 | 81.9 | 69.6 | |
| SE,sensitivity;SP,specificity;PPV,positive predictive value;NPV,negative predictive value. | |||||||||
|
| 图 1 冠状动脉粥样斑块SUVmax、TBR摄取值 Fig.1 SUVmax, TBR in coronary porridge-like lesions |
2.3 CTA与PET/CT显像各参数相关性分析
SUVmax与血管狭窄程度(r = 0.385,P = 0.001)、TPV(r = 0.200,P = 0.038)、LAP(r = 0.201,P = 0.037)及TBR(r = 0.687,P < 0.001)均呈正相关,而TBR还与TPV(r = 0.361,P < 0.001)、NCP(r = 0.292,P = 0.002)及LAP(r = 0.334,P < 0.001)呈正相关。
3 讨论研究[11]表明,T2DM造成的高血糖环境会严重损伤脑和心血管系统,对于冠状动脉的损伤尤为严重。而T2DM所导致的易损动脉粥样硬化斑块破裂,以及随后的血栓形成是心肌梗塞形成的主要原因之一。因此,识别易损斑块对于风险分层和提供适当的治疗十分重要[12]。根据特定的细胞和生化动态变化,量化易损斑块具有重要决定意义,应用放射性同位素标记的分子探针技术进行冠脉斑块显像成为进几年研究的热点之一。
目前对于冠状动脉粥样硬化的研究,常使用18F-FDG及18F-NaF分别作为炎症和微钙化的标志物。本研究发现,18F-FDG及18F-NaF PET/CT在单纯冠状动脉性疾病中显像效能相当,而对于T2DM伴冠状动脉粥样硬化疾病中,18F-NaF PET/CT显像的灵敏度及特异度均优于18F-FDG PET/CT显像,差异有统计学意义。这可能与两者的显像原理不同有关[13-14]。
在主动脉和颈动脉中的研究[15-17]表明,18F-FDG是血管炎症和低氧炎症成像良好的示踪剂,在能量代谢增加的细胞中高度积聚。但18F-FDG在冠状动脉成像中却较少使用这一示踪剂,其原因可能是在冠状动脉疾病中,很大一部分患者合并糖尿病,使得这部分患者在行18F-FDG PET/CT显像过程中显像效果受到不同程度的影响[18]。而18F-NaF不会被邻近的心肌摄取,因此在冠状动脉显像中表现出更好的对比度和显像效能,从而能够较好地提供冠状动脉斑块丰富的生物学信息[19]。
本研究进一步发现在T2DM伴CAD患者中,18F-FDGPET/CT及18F-NaFPET/CT两者显像获得的SUVmax、TBR之间存在显像剂摄取差异,进一步反映了2组细胞代谢水平的微观差异,而这种代谢差异可能来自于不同物质的代谢通道途径。研究进一步表明,18F-NaF可能摄取机制为冠状动脉中18F-NaF特异性与血管壁中的羟磷灰石结晶结合,这种结合与有效表面积密切相关。钙化早期阶段非常微小且持续时间很长。这可能表明18F-FDG及18F-NaF PET/CT显像,能够基于炎性细胞浸润的葡萄糖代谢及羟磷灰石的微观摄取,提供关于动脉斑块形成中不同条件的定性及定量化信息[20]。
本研究同时发现SUVmax、TBR与冠脉钙化积分等参数相关。这表明高风险斑块在炎症形成的同时,还具有一定程度的微钙化,导致斑块破裂和心血管事件发生的风险明显增加[21]。有学者[22]提出18F-NaF可作为动脉斑块中的微钙化(活动性钙化)显示,从而提供了新的检测手段,在识别破裂和高风险的冠状动脉斑块中具有重要意义,可以减慢病情的进展和提高治疗疗效。
本研究不足之处在于为单中心研究,样本量较少,需进一步加大样本量并多中心推广;本研究没有完全揭示动脉斑块的动态变化规律及其可能机制。
总之,应用多模态联合显像,通过18F-NaF和18F-FDG分子探针的联合PET/CT显像,对冠状动脉斑块具有较高的诊断及评估价值;18F-NaF可能较18F-FDG更适合于T2DM伴CAD冠状动脉斑块的评价,能更敏感地反映细胞的代谢情况;冠状动脉斑块的能量代谢在一定程度上反映了斑块的活性,可为冠状动脉粥样硬化性心脏病患者冠状动脉斑块的早期甄别提供可靠的无创性检查手段。
| [1] |
BRADLEY D. Type 2 diabetes in the elderly:challenges in a unique patient population[J]. J Geriatr Med Gerontol, 2016, 2(2): 14-28. DOI:10.23937/2469-5858/1510014 |
| [2] |
DUARTE AI, MOREIRA PI, OLIVEIRA CR. Insulin in central nervous system:more than just a peripheral hormone[J]. J Aging Res, 2012, 2012: 384017. DOI:10.1155/2012/384017 |
| [3] |
MOZAFFARIAN D, BENJAMIN EJ, GO AS, et al. Heart disease and stroke statistics:2015 update:a report from the American Heart Association[J]. Circulation, 2015, 131(4): e29-e322. DOI:10.1161/CIR.0000000000000152 |
| [4] |
SANCHEZROA PM, REES JIS, BARTLEY L, et al. Systemic atherosclerotic plaque vulnerability in patients with coronary artery disease with a single whole body[FDG] PET-CT scan[J]. Asia Ocean J Nucl Med Biol, 2020, 8(1): 18-26. DOI:10.22038/aojnmb.2019.40696.1273 |
| [5] |
FAYAD ZA, ROBSON PM. 18F-sodium fluoride PET imaging passes an important milestone toward noninvasive prediction of clinical events[J]. J Am Coll Cardiol, 2020, 75(24): 3075-3077. DOI:10.1016/j.jacc.2020.04.047 |
| [6] |
KWIECINSKI J, TZOLOS E, ADAMSON PD, et al. Coronary 18 F-sodium fluoride uptake predicts outcomes in patients with coronary artery disease[J]. J Am Coll Cardiol, 2020, 75(24): 3061-3074. DOI:10.1016/j.jacc.2020.04.046 |
| [7] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华糖尿病杂志, 2014, 6(7): 447-498. DOI:10.3760/cma.j.issn.1674-5809.2014.07.004 |
| [8] |
GEPNER AD, YOUNG R, DELANEY JA, et al. Comparison of carotid plaque score and coronary artery calcium score for predicting cardiovascular disease events:the multi-ethnic study of atherosclerosis[J]. J Am Heart Assoc, 2017, 6(2): e005179. DOI:10.1161/JAHA.116.005179 |
| [9] |
KWIECINSKI J, DEY D, CADET S, et al. Predictors of 18F-sodium fluoride uptake in patients with stable coronary artery disease and adverse plaque features on computed tomography angiography[J]. Eur Heart J Cardiovasc Imaging, 2020, 21(1): 58-66. DOI:10.1093/ehjci/jez152 |
| [10] |
KOMIYAMA H, TAKANO H, NAKAMURA S, et al. Geographical predisposition influences on the distribution and tissue characterisation of eccentric coronary plaques in non-branching coronary arteries:cross-sectional study of coronary plaques analysed by intravascular ultrasound[J]. Cardiovasc Ultrasound, 2016, 14(1): 1-7. DOI:10.1186/s12947-016-0090-3 |
| [11] |
KIM HG. Cognitive dysfunctions in individuals with diabetes mellitus[J]. Yeungnam Univ J Med, 2019, 36(3): 183-191. DOI:10.12701/yujm.2019.00255 |
| [12] |
SILVA MARQUES J, PINTO FJ. The vulnerable plaque:current concepts and future perspectives on coronary morphology, composition and wall stress imaging[J]. Revista Portuguesa De Cardiol, 2014, 33(2): 101-110. DOI:10.1016/j.repc.2013.07.017 |
| [13] |
PAWADE TA, CARTLIDGE TRG, JENKINS WSA, et al. Optimization and reproducibility of aortic valve 18F-fluoride positron emission tomography in patients with aortic stenosis[J]. Circ Cardiovasc Imaging, 2016, 9(10): e005131. DOI:10.1161/circimaging.116.005131 |
| [14] |
JUNG JJ, JADBABAIE F, SADEGHI MM. Molecular imaging of calcific aortic valve disease[J]. J Nucl Cardiol, 2018, 25(4): 1148-1155. DOI:10.1007/s12350-017-1158-7 |
| [15] |
BINDERUP T, DUIVENVOORDEN R, FAY F, et al. Imagingassisted nanoimmunotherapy for atherosclerosis in multiple species[J]. Sci Transl Med, 2019, 11(506): eaaw7736. DOI:10.1126/scitranslmed.aaw7736 |
| [16] |
TARKIN JM, JOSHI FR, RUDD JHF. PET imaging of inflammation in atherosclerosis[J]. Nat Rev Cardiol, 2014, 11(8): 443. DOI:10.1038/nrcardio.2014.80 |
| [17] |
LENSEN KJDF, VOSKUYL AE, COMANS EFI, et al. Should vascular wall 18F-FDG uptake be adjusted for the extent of atherosclerotic burden?[J]. Int J Cardiovasc Imaging, 2020, 36(3): 545-551. DOI:10.1007/s10554-019-01744-0 |
| [18] |
MASSERA D, TRIVIERI MG, ANDREWS JPM, et al. Disease activity in mitral annular calcification[J]. Circ Cardiovasc Imaging, 2019, 12(2): e008513. DOI:10.1161/CIRCIMAGING.118.008513 |
| [19] |
IRKLE A, VESEY AT, LEWIS DY, et al. Identifying active vascular microcalcification by 18F-sodium fluoride positron emission tomography[J]. Nat Commun, 6(1): 7495. DOI:10.1038/ncomms8495 |
| [20] |
ISHIWATA Y, KANETA T, NAWATA S, et al. Quantification of temporal changes in calcium score in active atherosclerotic plaque in major vessels by 18F-sodium fluoride PET/CT[J]. Eur J Nucl Med Mol Imaging, 2017, 44(9): 1529-1537. DOI:10.1007/s00259-017-3680-x |
| [21] |
LI X, HEBER D, CAL-GONZALEZ J, et al. Association between osteogenesis and inflammation during the progression of calcified plaque evaluated by 18F-fluoride and 18F-FDG[J]. J Nucl Med, 2017, 58(6): 968-974. DOI:10.2967/jnumed.116.182790 |
| [22] |
RAGGI P, PRANDINI N, LIGABUE G, et al. Molecular imaging of vascular calcification with 18F-sodium-fluoride in patients infected with human immunodeficiency virus[J]. Int J Mol Sci, 2019, 20(5): 1183. DOI:10.3390/ijms20051183 |
 2020, Vol. 49
2020, Vol. 49