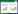文章信息
- 龙哲, 王旭, 侯伟建, 杨丹
- LONG Zhe, WANG Xu, HOU Weijian, YANG Dan
- 工频电磁场对小鼠海马神经元细胞系HT22增殖、凋亡及磷酸化JNK、ERK表达的影响
- Effects of Power-Frequency Electromagnetic Fields on Proliferation, Apoptosis and Phosphorylation of JNK and ERK in Mouse Hippocampal Neurons
- 中国医科大学学报, 2019, 48(9): 782-785, 790
- Journal of China Medical University, 2019, 48(9): 782-785, 790
-
文章历史
- 收稿日期:2018-10-11
- 网络出版时间:2019-09-09 9:06
2. 中国医科大学公共基础学院生物医学工程教研室, 沈阳 110122;
3. 东北大学信息科学与工程学院, 沈阳 110819;
4. 中国医科大学公共基础学院组织工程学教研室, 沈阳 110122;
5. 东北大学智能工业数据解析与优化教育部重点实验室, 沈阳 110819
2. Department of Biomedical Engineering, School of Fundamental Sciences, China Medical University, Shenyang 110122, China;
3. School of Information Science & Engineering, Northeastern University, Shenyang 110819, China;
4. Department of Tissue Engineering, School of Fundamental Sciences, China Medical University, Shenyang 110122, China;
5. Key Laboratory of Data Analytics and Optimization for Smart Industry, Northeastern University, Ministry of Education, Shenyang 110819, China
随着科技的发展,生活环境中电磁场分布日益复杂,电磁场对生命健康的影响越来越受到关注。近年来流行病学研究[1-3]发现,电磁场曝露可能诱发多种疾病,并且与电磁场类型、曝露的强度和时间均有关系。极低频电磁场可诱导小鼠脑和肝细胞凋亡[4]。低频交变电磁场影响大鼠骨髓间充质干细胞增殖及分化[5]。低频脉冲电磁场通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路促进成肌细胞增殖作用[6]。
MAPK家族是将信号从细胞表面转导至细胞核的重要传递者,c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和细胞外信号调节激酶(extracellular signal regulated kinase,ERK)是MAPK家族的主要成员。当机体受外界刺激,细胞内JNK和ERK蛋白磷酸化水平发生改变,参与增殖、分化、代谢和氧化应激等细胞活动[7-9]。50 Hz极低频电磁场曝露的人黑素细胞,能够抑制JNK和ERK磷酸化水平,促进黑色素的产生[10]。人表皮细胞HaCaT经中波紫外线照射后,JNK和ERK磷酸化水平上升,MAPK信号通路产生活化效应[11]。
本研究通过对HT22细胞进行3种强度工频电磁场短时曝露,观察不同强度电磁场曝露对细胞的增殖、凋亡及JNK和ERK磷酸化水平的影响,进而为工频电磁场安全阈值的确立提供实验依据。
1 材料与方法 1.1 材料小鼠海马神经元细胞系HT22购自北京北纳创联生物技术研究院。DMEM-H培养基购自美国HyClone公司;胰蛋白酶、胎牛血清购自美国Gibico公司;细胞增殖检测试剂盒购自美国Biovision公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京诺唯赞公司;p-JNK抗体、p-ERK抗体、辣根过氧化物酶标记山羊抗兔二抗IgG(H+L)购自美国Cell Signaling Technology公司。
1.2 方法 1.2.1 细胞培养小鼠海马神经元细胞系HT22采用含10%胎牛血清的DMEM-H培养基,在37℃、5% CO2条件下培养。采用对数生长期的细胞进行实验。
1.2.2 工频电磁场刺激利用工频电磁场发生器(东北大学电子科学与信息光学研究所自行研制),将HT22细胞随机分成4组,其中1组为对照组,不作任何处理,其余3组为实验组,分别曝露于强度为10、20、30 mT的工频电磁场中,20 min/d,连续3 d。
1.2.3 细胞增殖检测将经曝露的各组HT22细胞分别接种于96孔板中,密度为5×103/孔,37℃、5% CO2孵育24、48、72 h后,每孔加入MTS试剂20 μL,孵育2 h,利用全自动酶标仪测量490 nm处各孔的OD值。
1.2.4 细胞凋亡检测收集经曝露的各组HT22细胞,PBS漂洗后,计数5×105个,离心,加入500 μL Binding buffer重悬细胞后,加入5 μL Annexin V-FITC,混匀,再加入10 μL PI染液,再次混匀,室温避光染色10 min,用流式细胞仪进行检测。
1.2.5 Western blotting检测收集经曝露的各组HT22细胞,加入适量RIPA裂解液离心提取总蛋白,用Bradford法检测蛋白浓度。各组取30 μg蛋白经SDS-PAGE凝胶电泳分离后,转至PVDF膜上,5%牛血清白蛋白封闭2 h,加入一抗4℃过夜,TBST漂洗3次,每次5 min,加入辣根过氧化物酶标记山羊抗兔二抗IgG(H+L)孵育2 h,TBST漂洗3次,每次5 min,利用ECL成像系统进行显影。
1.3 统计学分析采用SPSS 18.0软件进行统计分析。数据用x±s表示,组间比较采用方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 不同强度电磁场曝露后对HT22细胞形态的影响大部分HT22细胞形态舒展,贴壁分布均匀。经电磁场曝露后细胞生长迅速,细胞增多,细胞排列密集。见图 1。
|
| A, control group; B, 10 mT group; C, 20 mT group; D, 30 mT group. 图 1 HT22细胞经不同强度电磁场曝露后3 d的形态变化×200 Fig.1 Morphology of HT22 cells with and without exposure to magnetic fields for three days ×200 |
2.2 不同强度电磁场曝露后对HT22细胞增殖的影响
MTS结果显示,HT22细胞经不同强度电磁场曝露后,均明显促进细胞增殖。电磁场曝露后24 h,细胞生长活力最强,之后随时间延长,增殖活力降低,但仍显著高于对照组。20 mT组促进生长增殖效果最显著,差异有统计学意义(P < 0.01)。电磁场强度和细胞生长增殖率呈非线性依赖关系。见表 1。
| Group | 24 h | 48 h | 72 h |
| Control | 100.00±0.00 | 100.00±0.00 | 100.00±0.00 |
| 10 mT | 134.69±1.121) | 130.82±0.981) | 126.64±0.861) |
| 20 mT | 151.34±1.301) | 145.66±1.091) | 140.96±0.651) |
| 30 mT | 127.41±0.321) | 123.41±0.821) | 120.56±0.561) |
| 1)P < 0.01 vs control group. | |||
2.3 不同强度电磁场曝露后对HT22细胞凋亡的影响
Annexin V-FITC/PI双染后,流式细胞仪检测不同强度工频电磁场曝露后HT22细胞凋亡的变化。与对照组相比,10 mT组凋亡率为2.32%±0.04%,20 mT组凋亡率为2.55%±0.06%,30 mT组凋亡率为2.17%±0.03%。随着曝露电磁场强度增加,各实验组细胞凋亡率未见明显变化。工频电磁场10 mT、20 mT和30 mT均未诱导HT22细胞凋亡。
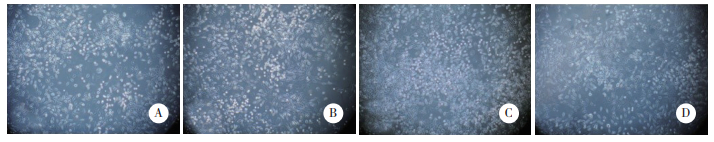
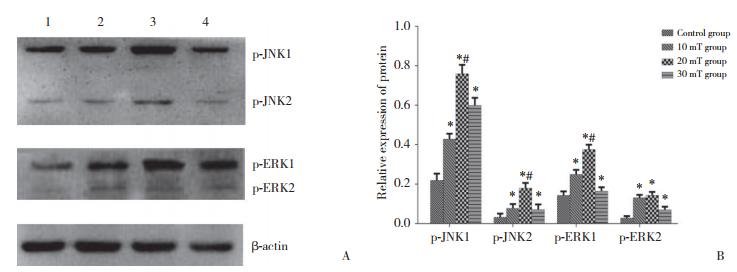
2.4 不同强度电磁场曝露后对HT22细胞p-JNK与p-ERK表达的影响Western blotting结果显示,不同强度电磁场曝露后HT22细胞p-JNK与p-ERK表达均明显升高。见图 2。
|
| A, p-JNK, p-ERK, and β-actin protein expression. 1, control group; 2, 10 mT group; 3, 20 mT group; 4, 30 mT group. B, relative expression of p-JNK and p-ERK. *P < 0.05 vs control group; #P < 0.05 vs 10 mT group. 图 2 Western blotting检测p-JNK和p-ERK表达水平 Fig.2 Western blotting analysis of p-JNK and p-ERK expression |
3 讨论
近年来,电磁场的安全性受到研究人员的广泛关注,国际肿瘤研究中心机构将工频电磁场分类为“怀疑对人体致癌的”。但是,国际非电离辐射防护委员会发表的《限制时变电场和磁场曝露的导则》中认为工频电磁场与生物体之间的作用机制尚不明确,对癌症发生缺乏已确定的因果关系。电磁场作为一种外加的物理因子,作用于细胞的机制非常复杂,已有的研究表明,磁场类型、曝露方式、曝露时间的不同对细胞的增殖、凋亡、信号通路等影响各不相同[12-13]。研究[14]表明,5 mT强度脉冲电磁场可以增强人脐静脉内皮细胞的增殖能力,促进血管内皮细胞增殖。但是也有研究[15]表明,1.10~4.10 mT强度的固定频率脉冲电磁场对小鼠成骨样细胞MC3T3-E1的增殖能力无明显影响。本研究利用工频电磁场0、10、20、30 mT曝露HT22细胞,观察到10、20、30 mT明显促进HT22细胞的增殖,这与汤翔宇等[16]报道的结果(BMSC细胞)类似。在3种强度作用下,20 mT强度电磁场曝露对HT22细胞增殖促进作用最强。
JNK和ERK作为MAPK的主要成员,可被电离辐射、生长因子、渗透压、细胞因子等多种外界刺激激活,并在细胞增殖、凋亡和分化等过程中起到关键作用[17]。王蕾等[18]采用化学动力学方程构建与电磁场敏感ERK相关的MAPK信号模型,得出电磁场可以激活ERK通路。本研究结果表明,工频电磁场10、20、30 mT曝露HT22细胞可以使其JNK、ERK磷酸化水平增高,这与孙文钧等[19]研究中0.4 mT和0.8 mT工频电磁场可以激活JNK、使其磷酸化报道结果类似。
MAPK是一种存在于大多数细胞中的胞内丝氨酸/苏氨酸蛋白激酶。MAPK信号途径使真核细胞能够将细胞外信号转导至细胞内,引起细胞反应,并通过影响基因的转录和调控,影响细胞的生物学行为(如增殖、分化、转化、凋亡等)。JNK受到外界刺激后被活化转到细胞核内,使其下游底物氨基末端激酶蛋白等磷酸化,参与多种外界刺激的应激反应,与细胞增殖凋亡密切相关;ERK广泛存在于各种组织中,活化后可将信号转导入细胞核,其活性增高与持续时间的长短决定对刺激的反应形式,对细胞增殖、生长和分化等方面有重要的调节作用[20]。补骨脂素可以通过剂量依赖方式刺激成骨细胞增殖,并且增加p-JNK和p-ERK的表达,特异性的抑制JNK和ERK的磷酸化可以有效地抑制补骨脂素对成骨细胞的增殖作用[21]。醋酸艾塞那肽可以通过激活JNK和ERK的磷酸化,促进大鼠脂肪来源干细胞的增殖[22]。
综上所述,本研究认为10 mT、20 mT和30 mT这3种强度工频电磁场曝露可能通过调控ERK和JNK的活化促进HT22细胞增殖。但是由于生物多样性和电磁场复杂度的原因,工频电磁场曝露通过调控ERK和JNK的活化促进细胞增殖还需要更多的实验结果证明。
| [1] |
AKBARNEJAD Z, ESMAEILPOUR K, SHABANI M, et al. Spatial memory recovery in Alzheimer's rat model by electromagnetic field exposure[J]. Int J Neurosci, 2018, 128(8): 691-696. DOI:10.1080/00207454.2017.1411353 |
| [2] |
PARK RM, SCHULTE PA, BOWMAN JD, et al. Potential occupational risks for neurodegenerative diseases[J]. Am J Ind Med, 2005, 48(1): 63-77. DOI:10.1002/ajim.20178 |
| [3] |
AHLBOM A, DAY N, FEYCHTING M, et al. A pooled analysis of magnetic fields and childhood leukaemia[J]. Br J Cancer, 2000, 83(5): 692-698. DOI:10.1054/bjoc.2000.1376 |
| [4] |
刘赟, 洪蓉, 喻云梅, 等. 极低频电磁场对小鼠脑和肝细胞凋亡及细胞周期的影响[J]. 中华劳动卫生职业病杂志, 2003, 21(5): 339-341. DOI:10.3760/cma.j.issn.1001-9391.2003.05.007 |
| [5] |
程国政, 李志锋, 周建, 等. 不同强度低频正弦交变电磁场对大鼠骨髓间充质干细胞成骨性分化的影响[J]. 中国骨质疏松杂志, 2010, 16(8): 558-562. DOI:10.3969/j.issn.1006-7108.2010.08.004 |
| [6] |
XU HX, ZHANG J, LEI YT, et al. Low frequency pulsed electromagnetic field promotes C2C12 myoblasts proliferation via activation of MAPK/ERK pathway[J]. Biochem Biophys Res Commun, 2016, 479(1): 97-102. DOI:10.1016/j.bbrc.2016.09.044 |
| [7] |
RUBINFELD H, SEGER R. The ERK cascade:a prototype of MAPK signaling[J]. Mol Biotechnol, 2005, 31(2): 151-174. DOI:10.1385/MB:31:2:151 |
| [8] |
KIM EK, CHOI EJ. Compromised MAPK signaling in human diseases:an update[J]. Arch Toxicol, 2015, 89(6): 867-882. DOI:10.1007/s00204-015-1472-2 |
| [9] |
YOON S, SEGER R. The extracellular signal-regulated kinase:multiple substrates regulate diverse cellular functions[J]. Growth Factors, 2006, 24(1): 21-44. DOI:10.1080/02699050500284218 |
| [10] |
KIM YM, CHO SE, KIM SC, et al. Effects of extremely low frequency electromagnetic fields on melanogenesis through p-ERK and p-SAPK/JNK pathways in human melanocytes[J]. Int J Mol Sci, 2017, 18(10): E2120. DOI:10.3390/ijms18102120 |
| [11] |
徐倩倩, 陈旭, 李莉, 等. 中波紫外线对体外培养HaCaT细胞MAPK信号通路的影响[J]. 中华皮肤科杂志, 2015, 48(6): 391-394. DOI:10.3760/cma.j.issn.0412-4030.2015.06.007 |
| [12] |
宋国丽, 周翠红, 张宇, 等. 静磁场对骨髓间充质干细胞增殖及骨向分化的影响[J]. 中国康复理论与实践, 2014, 20(4): 322-326. DOI:10.3969/j.issn.1006-9771.2014.04.005 |
| [13] |
LEW WZ, HUANG YC, HUANG KY, et al. Static magnetic fields enhance dental pulp stem cell proliferation by activating the p38 mitogen-activated protein kinase pathway as its putative mechanism[J]. J Tissue Eng Regen Med, 2018, 12(1): 19-29. DOI:10.1002/term.2333 |
| [14] |
LI RL, HUANG JJ, SHI YQ, et al. Pulsed electromagnetic field improves postnatal neovascularization in response to hindlimb ischemia[J]. Am J Transl Res, 2015, 7(3): 430-444. |
| [15] |
陈善堂, 李胜发, 邢祯全. 不同强度低频脉冲电磁场对小鼠MC3T3-E1成骨样细胞增殖、分化及矿化影响[J]. 临床和实验医学杂志, 2017, 16(23): 2296-2300. DOI:10.3969/j.issn.1671-4695.2017.23.003 |
| [16] |
汤翔宇, 付涛, 刘阳, 等. 1.0 mT低频交变电磁场对大鼠骨髓间充质干细胞增殖及成骨分化的影响[J]. 中华物理医学与康复杂志, 2017, 39(8): 566-571. DOI:10.3760/cma.j.issn.0254-1424.2017.08.002 |
| [17] |
ZHOU YY, LI Y, JIANG WQ, et al. MAPK/JNK signalling:a potential autophagy regulation pathway[J]. Biosci Rep, 2015, 35(3): e00199. DOI:10.1042/BSR20140141 |
| [18] |
王蕾, 庞迪, 耿读艳, 等. 基于MAPK通路模型的电磁非热生物效应机制研究[J]. 中国科技论文, 2015, 10(24): 2853-2855. DOI:10.3969/j.issn.2095-2783.2015.24.008 |
| [19] |
孙文均, 余应年, 付一提, 等. 工频磁场对应激活化蛋白激酶及上游激酶磷酸化和活力的影响[J]. 中华劳动卫生职业病杂志, 2002, 20(4): 256-259. DOI:10.3760/cma.j.issn.1001-9391.2002.04.006 |
| [20] |
SUN Y, LIU WZ, LIU T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35(6): 600-604. DOI:10.3109/10799893.2015.1030412 |
| [21] |
LI F, LI Q, HUANG X, et al. Psoralen stimulates osteoblast proliferation through the activation of nuclear factor-κB-mitogen-activated protein kinase signaling[J]. Exp Ther Med, 2017, 14(3): 2385-2391. DOI:10.3892/etm.2017.4771 |
| [22] |
周浩, 杨俊杰, 辛婷, 等. Exendin-4通过JNK和ERK信号通路增强大鼠脂肪来源干细胞的增殖[J]. 现代生物医学进展, 2014, 14(30): 5801-5805. DOI:10.13241/j.cnki.pmb.2014.30.001 |
 2019, Vol. 48
2019, Vol. 48