文章信息
- 陈建康, 严瑜, 潘晓莉, 周密, 张文泉, 杨洁, 朱鹏立
- CHEN Jiankang, YAN Yu, PAN Xiaoli, ZHOU Mi, ZHANG Wenquan, YANG Jie, ZHU Pengli
- 膜联蛋白A1及其模拟肽Ac2-26对高糖诱导大鼠心肌细胞炎症反应的影响
- Effect of Annexin A1 and Mimetic Peptide Ac2-26 on Inflammatory Response in Cardiac Myocytes Induced by High Glucose in Rats
- 中国医科大学学报, 2019, 48(8): 730-733
- Journal of China Medical University, 2019, 48(8): 730-733
-
文章历史
- 收稿日期:2018-11-23
- 网络出版时间:2019-07-15 10:45
2型糖尿病病程长,易导致心、脑、肾、血管等器官发生并发症。糖尿病心肌病变是主要并发症之一,以心力衰竭为主要表现,严重可导致患者死亡。糖尿病心肌病变机制尚未明确,目前多认为与氧化应激、炎症反应、细胞死亡、自噬等有关[1]。炎症反应是糖尿病导致心肌病变的重要原因之一,已有研究[1-3]证实炎症反应可以使氧化应激活性氧簇(reactive oxygen species,ROS)增加,促进粒细胞、单核细胞等炎症细胞的聚集和迁移,增加炎症复合物形成,刺激炎性细胞因子[肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)等]分泌,增加转化生长因子-β1(transforming growth factor-β1,TGF-β1)表达,从而导致心肌细胞损伤,进一步造成心肌重塑,形成糖尿病心肌病变。目前,一些研究[2-6]表明通过抑制炎症反应可改善糖尿病心肌病变。
已有研究[7-8]表明膜联蛋白A1是重要的抗炎物质,它通过抑制磷脂酶A2(phospholipase A2,PLA2)来减少炎症反应复合物形成;抑制炎性细胞因子(TNF-α、IL-1β等)分泌,改善炎症反应。模拟肽Ac2-26是膜联蛋白A1的小分子片段,由体外获得,具有与膜联蛋白A1相似生物学效应[9]。本课题组前期研究[10]发现膜联蛋白A1改善糖尿病大鼠心功能可能与炎症反应有关。本研究通过体外研究探讨膜联蛋白A1及模拟肽Ac2-26对高糖诱导的大鼠心肌细胞炎症反应的影响。
1.1 材料与方法 1.1 实验动物、仪器及试剂出生3 d内的清洁级SD大鼠购于福建省医学科学研究院动物中心[动物质量许可证号:SYXK(闽)2017-0011],雌雄不限。主要仪器和试剂:TP800型实时荧光定量PCR仪(日本TaKaRa公司)、超净工作台(常州普天仪器制造有限公司)、CO2培养箱(德国科峻公司)、流式细胞仪(美国贝克曼库尔特有限公司)、DMEM培养基(美国Gibco公司)、总RNA抽提试剂盒(上海飞捷生物技术有限公司)、逆转录试剂盒(大连宝生物工程有限公司);兔抗大鼠TNF-α、IL-1β(南京建成生物工程研究所),模拟肽Ac2-26(美国Santa Cruz公司)。
1.2 方法 1.2.1 心肌细胞制备取6只大鼠置于超净工作台上,取其心室肌组织,4 ℃D-Hanks液洗净,用细组织剪刀剪碎心室肌组织,0.1%胰蛋白酶消化为单细胞悬液,细胞差速贴壁1.5 h后,用含100 mL/L胎牛血清DMEM培养液使未贴壁心肌细胞稀释成5×10-5/L,应用0.1 mmol/Brdu抑制培养基中非心肌细胞增殖,然后将心肌细胞接种在6孔板中,每孔为2 mL,置于37 ℃细胞培养箱中继续孵育48 h,换成无血清培养液对心肌细胞进行处理。
1.2.2 实验分组及干预根据预实验结果,Ac2-26浓度以0.1 mg/mL作为标准剂量干预。将分离的大鼠原代心肌细胞培养48 h后换液,在倒置显微镜下观察心肌细胞长势,待其细胞长至90%融合时,将细胞随机分组:正常对照组[葡萄糖(5.5 mmol/L)DMEM培养基进行培养]、正常干预组[葡萄糖(5.5 mmol/L)DMEM培养基、Ac2-26(0.1 mg/mL)进行培养]、高糖模型组[葡萄糖(30 mmol/L)DMEM培养基进行培养)]、高糖治疗组[葡萄糖(30 mmol/L)DMEM培养基、Ac2-26(0.1 mg/mL)进行培养]。各组细胞均继续培养48 h后收集细胞。
1.2.3 TNF-α、IL-1β检测收集各组细胞上清液,按照试剂盒步骤采用ELISA法测定TNF-α、IL-1β水平。
1.2.4 实时PCR检测膜联蛋白A1及PLA2 mRNA表达原代心肌细胞培养结束后,各培养皿用PBS洗2遍,裂解细胞,提取总RNA及cDNA,按Trizol法提取总RNA,参照说明书对膜联蛋白A1及PLA2进行逆转录和PCR扩增,膜联蛋白A1正反引物序列分别为5’-TCGCAATGAAGGACGATAG-3’和5’-ATATCCTCTTACAGTC-3’,扩增长度分别为307 bp、318 bp,PLA2正反引物序列分别为5’-TCTGTCCAATGACGGAGTC-3’和5’-CTAGTCCAGATTTCTGCCCGTACG-3’,扩增长度分别为296 bp、301 bp,使用1.5%的琼脂糖凝胶电泳检测,凝胶拍照系统自动拍照,最后对图像进行分析。
1.3 统计学分析采用SPSS 19.0软件进行统计分析,所有数据采用x±s表示,组间比较采用t检验或单因素方差分析,P < 0.05为差异有统计学意义。
2 结果结果显示,与正常对照组比较,正常干预组膜联蛋白A1、PLA2 mRNA表达,TNF-α、IL-1β水平下降,但差异无统计学意义(P > 0.05)。与正常对照组比较,高糖模型组膜联蛋白A1及PLA2 mRNA表达,TNF-α、IL-1β水平显著上升,差异有统计学意义(P < 0.01)。与高糖模型组比较,高糖治疗组PLA2 mRNA表达,TNF-α、IL-1β水平明显下降,差异有统计学意义(P < 0.01);而膜联蛋白A1 mRNA表达下降,但差异无统计学意义(P > 0.05)。见图 1,表 1、2。
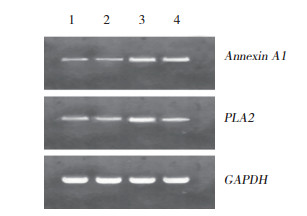
|
| 1, control group; 2, normal intervene group; 3, high glucose group; 4, high glucose treatment group. 图 1 各组膜联蛋白A1及PLA2 mRNA表达 Fig.1 Expression of Annexin A1 and PLA2 mRNA in each group |
| Group | n | Annexin A1 mRNA | PLA2 mRNA |
| Control | 5 | 15.29±1.34 | 18.88±2.23 |
| Normal intervene | 5 | 14.09±1.23 | 17.09±2.01 |
| High glucose | 5 | 38.24±3.241) | 65.38±5.631) |
| High glucose treatment | 5 | 35.12±3.15 | 22.68±2.532) |
| 1)P < 0.01 compared with control group;2)P < 0.01 compared with high glucose group. | |||
| Group | n | TNF-α | IL-1β |
| Control | 5 | 23.18±5.05 | 15.38±3.53 |
| Normal intervene | 5 | 21.28±4.65 | 14.68±3.33 |
| High glucose | 5 | 123.28±8.351) | 96.78±7.531) |
| High glucose treatment | 5 | 33.28±6.252) | 28.38±3.832) |
| 1)P < 0.01 compared with control group;2)P < 0.01 compared with high glucose group. | |||
3 讨论
研究[11]显示,糖尿病可以诱发心力衰竭发作或者促进其发展,糖尿病心肌病是非缺血性心肌病的重要病因。既往研究[12]表明糖尿病病程进展中伴随着炎症反应,特别在形成并发症时炎症反应始终参与其中,糖尿病心肌病病变过程中伴随着炎症反应增强。因此通过抑制炎症反应可以改善糖尿病心肌病[2]。
膜联蛋白A1是膜联蛋白超家族中的一员,依赖钙离子与细胞膜磷脂结合,又称为依钙蛋白、磷脂酶A2抑制蛋白,大部分器官、组织均可以表达,在粒细胞/单核细胞中呈更高水平表达。膜联蛋白A1是外周系统重要的抗炎物质,改善机体炎症反应。既往对于膜联蛋白A1研究多集中在感染、肿瘤等方面,近年有些研究[13-16]表明膜联蛋白A1与心脑血管疾病(动脉粥样硬化、心肌再灌注损伤、冠状动脉粥样硬化性心脏病、脑梗死、机体脏器纤维化等)也有密切关系。模拟肽Ac2-26是膜联蛋白A1裂解的小分子片段,同样具有强大的抗炎活性,可以改善心肌梗死、抑制小胶质细胞释放炎症介质[17-18]。PLA2是炎症复合物、炎症介质合成释放的关键酶,在炎症反应过程中发挥重要作用;炎性细胞因子TNF-α、IL-1β主要由单核-巨噬细胞分泌,同样在炎症反应发挥重要作用。本研究采用高糖负荷心肌细胞,模拟糖尿病对心肌病变的影响。结果显示,与正常对照组比较,正常干预组膜联蛋白A1、PLA2 mRNA表达,TNF-α、IL-1β水平没有统计学差异(均P > 0.05),说明Ac2-26干预效果有限,同样对膜联蛋白A1影响不明显;而在高糖模型组膜联蛋白A1及PLA2 mRNA表达,TNF-α、IL-1β水平都明显上升(均P < 0.05),说明糖尿病病程中存在明显炎症反应,膜联蛋白A1抗炎作用明显增加。与高糖组比较,高糖治疗组PLA2 mRNA表达,TNF-α、IL-1β水平明显下降(均P < 0.05),提示Ac2-26改善了高糖诱导的心肌细胞的炎症反应,但膜联蛋白A1下降不明显,进一步证实了Ac2-26对膜联蛋白A1影响有限,同时膜联蛋白A1维持较高水平继续发挥抗炎作用。既往研究[14]表明膜联蛋白A1及Ac2-26在体内、体外对缺血再灌注心肌损伤均具有改善作用,本研究证实膜联蛋白A1与高糖诱导心肌细胞的炎症反应关系密切,Ac2-26能够明显减轻炎症反应。推测其机制可能是Ac2-26通过抑制PLA2表达使花生四烯酸、前列腺素、血小板活化因子等炎症活性物质分泌减少,减轻炎症反应,同时抑制PLA2表达后抑制了中性粒细胞表面整合素和脂多糖的表达,使TNF-α、IL-1β分泌减少;另外Ac2-26抑制单核细胞、巨噬细胞等趋化、聚集功能,下调炎性细胞因子TNF-α、IL-1β表达来改善炎症反应。
综上所述,膜联蛋白A1与高糖诱导心肌细胞炎症反应明显相关,模拟肽Ac2-26改善了高糖诱导的心肌细胞炎症反应,推测在体内同样可以改善糖尿病大鼠心肌病变,本研究为模拟肽Ac2-26治疗糖尿病心肌病提供了实验依据。
| [1] |
VARGA ZV, GIRICZ Z, LIAUDET L, et al. Interplay of oxidative, nitrosative/nitrative stress, inflammation, cell death and autophagy in diabetic cardiomyopathy[J]. Biochim Biophys Acta, 2015, 1852(2): 232-242. DOI:10.1016/j.bbadis.2014.06.030 |
| [2] |
AL-RASHEED NM, AL-RASHEED NM, HASAN IH, et al. Simvastatin ameliorates diabetic cardiomyopathy by attenuating oxidative stress and inflammation in rats[J]. Oxid Med Cell Longev, 2017, 2017: 1092015. DOI:10.1155/2017/1092015 |
| [3] |
BUGGER H, ABEL ED. Molecular mechanisms of diabetic cardiomyopathy[J]. Diabetologia, 2014, 57(4): 660-671. DOI:10.1007/s00125-014-3171-6 |
| [4] |
KHANNA S, SINGH GB, KHULLAR M. Nitric oxide synthases and diabetic cardiomyopathy[J]. Nitric Oxide, 2014, 43(1): 29-34. DOI:10.1016/j.niox.2014.08.004 |
| [5] |
SUN X, CHEN RC, YANG ZH, et al. Taxifolin prevents diabetic cardiomyopathy in vivo and in vitro by inhibition of oxidative stress and cell apoptosis[J]. Food Chem Toxicol, 2014, 63(1): 221-232. DOI:10.1016/j.fct.2013.11.013 |
| [6] |
DE BLASIO MJ, HUYNH K, QIN C, et al. Therapeutic targeting of oxidative stress with coenzyme Q10 counteracts exaggerated diabetic cardiomyopathy in a mouse model of diabetes with diminished PI3K (p110α) signaling[J]. Free Radic Biol Med, 2015, 87: 137-147. DOI:10.1016/j.freeradbiomed.2015.04.028 |
| [7] |
YANG YH, MORAND E, LEECH M. Annexin A1:potential for glucocorticoid sparing in RA[J]. Nat Rev Rheumatol, 2013, 9(10): 595-603. DOI:10.1038/nrrheum.2013.126 |
| [8] |
BRANCALEONE V, MITIDIERI E, FLOWER RJ, et al. Annexin A1 mediates hydrogen sulfide properties in the control of inflammation[J]. J Pharmacol Exp Ther, 2014, 351(1): 96-104. DOI:10.1124/jpet.114.217034 |
| [9] |
STUQUI B, DE PAULA-SILVA M, CARLOS CP, et al. Ac2-26 mimetic peptide of annexin A1 inhibits local and systemic inflammatory processes induced by bothrops moojeni venom and the Lys-49 phospholipase A2 in a rat model[J]. PLoS One, 2015, 10(7): e0130803. DOI:10.1371/journal.pone.0130803 |
| [10] |
陈建康, 严瑜, 潘晓莉, 等. 膜联蛋白A1对糖尿病大鼠心功能及炎症反应的影响[J]. 中国医科大学学报, 2017, 46(6): 532-535. DOI:10.12007/j.issn.0258-4646.2017.06.012 |
| [11] |
FILLMORE N, MORI J, LOPASCHUK GD. Mitochondrial fatty acid oxidation alterations in heart failure, ischaemic heart disease and diabetic cardiomyopathy[J]. Br J Pharmacol, 2014, 171(8): 2080-2090. DOI:10.1111/bph.12475 |
| [12] |
RAJESH M, BÁTKAI S, KECHRID M, et al. Cannabinoid 1 receptor promotes cardiac dysfunction, oxidative stress, inflammation, and fibrosis in diabetic cardiomyopathy[J]. Diabetes, 2012, 61(3): 716-727. DOI:10.2337/db11-0477 |
| [13] |
冯骏, 肖新莉, 刘哲, 等. 急性脑梗死患者颈动脉粥样斑块稳定性与单核细胞趋化因子4、膜联蛋白A1水平的关系[J]. 第三军医大学学报, 2011, 33(18): 1939-1942. DOI:10.16016/j.1000-5404.2011.18.023 |
| [14] |
DE JONG RJ, PAULIN N, LEMNITZER P, et al. Protective aptitude of annexin A1 in arterial neointima formation in atherosclerosis-prone mice-brief report[J]. Arterioscler Thromb Vasc Biol, 2017, 37(2): 312-315. DOI:10.1161/ATVBAHA.116.308744 |
| [15] |
TRENTIN PG, FERREIRA TP, ARANTES AC, et al. Annexin A1 mimetic peptide controls the inflammatory and fibrotic effects of silica particles in mice[J]. Br J Pharmacol, 2015, 172(12): 3058-3071. DOI:10.1111/bph.13109 |
| [16] |
QIN CX, BUXTON KD, PEPE S, et al. Reperfusion-induced myocardial dysfunction is prevented by endogenous annexin-A1 and its N-terminal-derived peptide Ac-ANX-A1(2-26)[J]. Br J Pharmacol, 2013, 168(1): 238-252. DOI:10.1111/j.1476-5381.2012.02176.x |
| [17] |
QIN C, YANG YH, MAY L, et al. Cardioprotective potential of annexin-A1 mimetics in myocardial infarction[J]. Pharmacol Ther, 2015, 148: 47-65. DOI:10.1016/j.pharmthera.2014.11.012 |
| [18] |
罗振钊, 刘璐, 马健, 等. Annexin-A1模拟肽Ac2-26抑制小胶质细胞释放炎性介质的作用研究[J]. 中华老年学杂志, 2016, 35(12): 1320-1323. DOI:10.3760/cma.j.issn.0254-9026.2016.12.017 |
 2019, Vol. 48
2019, Vol. 48