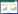文章信息
- 潘春玲, 吕雪雯, 王宏岩, 寇育荣, 潘亚萍
- PAN Chunling, LÜ Xuewen, WANG Hongyan, KOU Yurong, PAN Yanping
- 牙龈卟啉单胞菌内化牙周膜干细胞抑制成骨分化的能力
- Inhibition of Osteogenic Differentiation in Periodontal Ligament Stem Cells Invaded by Porphyromonas Gingivalis
- 中国医科大学学报, 2019, 48(8): 678-682
- Journal of China Medical University, 2019, 48(8): 678-682
-
文章历史
- 收稿日期:2019-01-03
- 网络出版时间:2019-07-15 11:03
牙周病是牙周支持组织的慢性炎症性疾病。在我国牙周病患病率呈高发趋势, 是患病率最高的口腔疾病。牙龈卟啉单胞菌(Porphyromonas gingivalis, P. gingivalis)是牙周红色复合体的组成成员, 与牙周支持组织破坏关系密切[1]。牙周膜干细胞是一类具有多项分化能力的细胞, 在牙周组织中发挥维持组织更新和修复损伤的重要作用, 已被证实是牙周组织再生的重要种子细胞[2]。目前临床上任何治疗方法获得的牙周组织再生, 尤其是骨组织的修复再生, 都非常有限。碱性磷酸酶(alkaline phosphatase, ALP)是一种非特异性水解酶, 是成骨细胞标志性因子, ALP水平的升高与局部钙化活性增高以及活跃的骨改建密切相关[3]。Runx相关的转录因子2 (Runx2)在调节干细胞分化为成骨细胞中发挥重要作用, Runx2的表达升高能够促进成骨细胞特异性基因的表达并启动矿化[4]。骨钙素(osteocalcin, OCN)是成骨细胞合成和分泌的一种非胶原骨基质蛋白, OCN具有与钙离子的高亲和力和连接羟基磷灰石的能力, 被认为是骨转换的有效标志物, 在调控骨基质矿化方面起促进作用[5]。本研究通过观察P. gingivalis ATCC 33277内化牙周膜干细胞对其骨向分化能力的影响, 检测ALP、Runx2和OCN的表达, 为应用牙周膜干细胞修复炎性微环境中破坏的牙周组织提供理论指导和治疗靶点。
1 材料与方法 1.1 细菌培养P. gingivalis ATCC 33277 (中国医科大学附属口腔医院口腔生物教研室提供)于含5%羊血、1%氯化血红素和0.1%维生素K1的胰蛋白胨大豆肉汤培养基固体培养。液体培养24 h, 离心收集细菌, PBS洗涤后, 重悬于无抗生素细胞培养基中。紫外分光光度计测量600 nm吸光度值, 调节细菌菌液浓度为1×109/mL后备用。
1.2 组织块法培养原代牙周膜细胞、有限稀释法克隆纯化牙周膜干细胞选取因正畸治疗需要拔除的前磨牙和第三磨牙30颗, 均经患者本人及监护人同意, 并签署知情同意书。患者无全身系统性疾病、家族遗传病和特殊服药史, 临床检查牙齿无牙体及根尖周病变。牙周膜干细胞培养方法参见文献[6]。收集临床上拔除的牙齿, 立即置于含PBS的离心管中, 大量PBS冲洗后, 无菌刀片刮取牙根中部的牙周膜组织, 眼科剪剪成1 mm×1 mm×1 mm的组织块, 接种于含15%血清DMEM培养基的6孔板中培养, 每周换液2次, 当细胞生长达70%~80%汇合时, 消化并调整密度为10/mL, 接种于96孔板, 每孔100 μL。过夜培养, 挑选单细胞孔标记, 待细胞形成克隆后, 消化并将多个单克隆来源的细胞悬液混合扩大培养。选取第3~7代的牙周膜干细胞用于本研究。
1.3 牙周膜干细胞免疫组化染色和生长曲线测定牙周膜干细胞生长汇合约为80%时, 胰酶消化细胞, 并进行细胞计数, 调整细胞浓度为1.5×104/mL, 加入100 μL细胞悬液至96孔板中, CO2培养箱中培养。每组5孔, 隔日换液, 连续培养10 d。每天取1板, 每孔加入10 μL CCK-8溶液, 继续在细胞培养箱内孵育4 h, 测定450 nm处的吸光度值。
制备牙周膜干细胞爬片, PBS冲洗3遍, 3% H2O2孵育10 min, PBS冲洗, 滴加鼠抗人波形蛋白单克隆抗体和鼠抗人角蛋白单克隆抗体, 37 ℃孵育2 h, 按照DAB试剂盒说明书染色, 苏木素复染, 梯度乙醇逐级脱水后二甲苯透明, 中性树胶封片, 光学显微镜下观察细胞的染色情况。
1.4 茜素红染色观察P. gingivalis ATCC 33277内化牙周膜干细胞成骨分化的能力牙周膜干细胞融合度达到80%后, 按照感染复数20:1, P. gingivalis ATCC 33277与牙周膜干细胞共同培养2 h, 换液洗去细胞外未黏附细菌, 换成含300 μg/mL庆大霉素和200 μg/mL甲硝唑的新鲜成人骨髓间质干细胞成骨诱导分化完全培养基(赛业生物科技有限公司)。每隔3 d重复上述步骤, 成骨诱导2周后, 用茜素红进行染色。设立未成骨诱导分化完全培养基培养的细胞为空白对照组, 设立成骨诱导分化完全培养基培养而未加细菌感染的细胞为阳性对照组。
1.5 P. gingivalis ATCC 33277内化牙周膜干细胞对ALP活性的影响按照ALP试剂盒(碧云天生物技术公司)操作步骤, 采用对硝基苯磷酸作为酶底物来检测ALP活性。成骨诱导培养第7和14天时弃除培养液, 裂解牙周膜干细胞, 以12 000 r/min、4 ℃离心15 min收集的细胞裂解产物, 96孔板中每孔加入50 μL底物缓冲液和50 μL裂解液, 37 ℃孵育10 min后, 加入100 μL反应终止液, 用酶标仪测量405 nm处吸光度。根据绘制的ALP标准曲线, 计算相应的ALP浓度。
1.6 P. gingivalis ATCC 33277内化牙周膜干细胞对成骨分化基因的影响成骨诱导培养第7和14天时弃除培养液, PBS冲洗3遍, Trizol裂解细胞, 提取样品总RNA, 采用PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(宝日医生物技术有限公司)将总RNA反转录成cDNA。OCN引物:上游5’-GCAATAAGGTAGTGAACAGACT CC-3’, 下游5’-CCATAGATGCGTTTGTAGGCGG-3’。Runx2引物:上游5’-CCTGAACTCTGCACCAAGTCC-3’, 下游5’-TCATCTGGCTCAGATAGGAGGG -3’。β-actin引物:上游5’-GGATTTGGTCGTATTGGG-3’, 下游5’-TCGCTCCTGGAAGATGG-3’。采用TB GreenTM Premix Ex TaqTM试剂盒(日本TaKaRa公司)实时PCR扩增(美国ABI公司), 测定OCN和Runx2基因的相对含量。
1.7 统计学分析所有数据用x±s表示, 应用SPSS 20.0软件进行统计学分析, 采用方差分析进行多组间比较。P < 0.05为差异有统计学意义。
2 结果 2.1 牙周膜干细胞的培养、纯化和鉴定牙周膜细胞大约5 d左右从组织块边缘游出, 20 d左右细胞融合度达80%, 细胞以组织块为中心呈放射状、旋涡状单层生长, 中心部较密, 外部稀疏, 细胞较大, 长梭形突起相互连接, 有限稀释克隆传代后细胞生长状态良好(图 1A)。使用CCK-8试剂盒检测牙周膜干细胞的增殖活力, 绘制的牙周膜干细胞生长曲线呈反“S”形, 1~3 d细胞生长缓慢, 4~8 d细胞快速生长, 9 d达到平台期(图 1B)。免疫组化染色后镜下可见波形蛋白染色阳性, 细胞质染成棕黄色, 细胞核染成蓝色; 角蛋白染色阴性, 细胞核染成蓝色, 具有中胚层来源的成纤维细胞的特征, 且无上皮细胞污染(图 1C、1D)。
|
| A, a limited dilution of clonal periodontal ligament stem cells (×20); B, periodontal ligament stem cell growth curve; C, periodontal ligament stem cells stained with vimentin (×40); D, periodontal ligament stem cell stained with keratin (×40). 图 1 牙周膜干细胞的培养、纯化和鉴定 Fig.1 Culture, purification, and identification of periodontal ligament stem cells |
2.2 P. gingivalis ATCC 33277内化牙周膜干细胞抑制成骨分化的能力
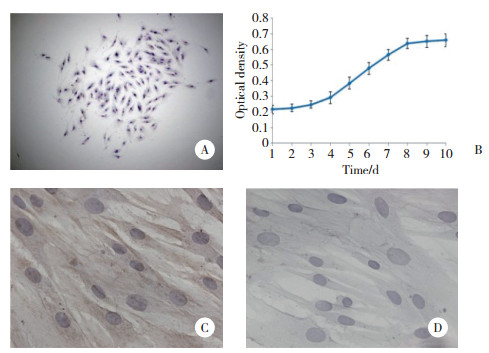
茜素红染色观察到未经成骨矿化诱导的牙周膜干细胞没有红色矿化结节的形成, 经成骨矿化诱导的阳性对照组和内化组牙周膜干细胞均可形成矿化结节。同时发现, 阳性对照组体外形成的矿化结节大而多, 而内化组形成的矿化结节少而稀疏(图 2), 表明牙周膜干细胞经过成骨诱导后可以形成矿化结节, P. gingivalis ATCC 33277内化后可以抑制牙周膜干细胞成骨分化的能力。
|
| A, absence of red mineralized nodules in the blank control group; B, several large mineralized nodules in the positive control group; C, few sparsely mineralized nodules in the invasion group. 图 2 P. gingivalis ATCC 33277内化牙周膜干细胞抑制成骨分化的能力×20 Fig.2 P. gingivalis invasion-mediated inhibition of osteogenic differentiation ability in periodontal ligament stem cells ×20 |
2.3 P. gingivalis ATCC 33277内化牙周膜干细胞降低ALP活性
未经成骨诱导的牙周膜干细胞, ALP活性在第7和14天无明显的变化。阳性对照组和内化组牙周膜干细胞随时间的延长, ALP活性升高。与空白对照组相比, 阳性对照组和内化组牙周膜干细胞ALP活性升高, 且内化组牙周膜干细胞ALP活性低于阳性对照组, 差异有统计学意义(P < 0.05) (图 3)。表明牙周膜干细胞经过成骨诱导后, ALP活性升高, P. gingivalis ATCC 33277内化后可以抑制牙周膜干细胞ALP活性。

|
| * P < 0.05 vs the blank control group; # P < 0.05 vs the positive control group. 图 3 P. gingivalis ATCC 33277内化牙周膜干细胞成骨诱导后对ALP活性的影响 Fig.3 ALP activity after osteogenic induction in periodontal ligament stem cells invaded by P. gingivalis |
2.4 P. gingivalis ATCC 33277内化牙周膜干细胞对Runx2和OCN基因表达的影响
空白对照组牙周膜干细胞Runx2基因表达在第7和14天无明显变化。与空白对照组相比, 阳性对照组和内化组牙周膜干细胞Runx2基因表达升高, 且内化组牙周膜干细胞Runx2基因表达低于阳性对照组, 差异均有统计学意义(P < 0.05)。阳性对照组和内化组牙周膜干细胞随诱导时间的延长Runx2基因表达升高, 差异有统计学意义(P < 0.05) (图 4A)。
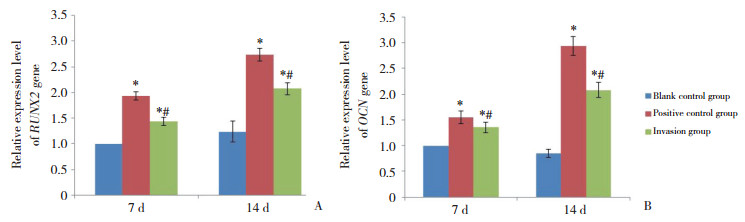
|
| A, Runx2 expression; B, OCN expression. * P < 0.05 vs the blank control group; # P < 0.05 vs the positive control group. 图 4 P. gingivalis ATCC 33277内化牙周膜干细胞对Runx2和OCN基因表达的影响 Fig.4 Runx2 and OCN expression after osteogenic induction in periodontal ligament stem cells invaded by P. gingivalis |
空白对照组牙周膜干细胞OCN基因表达在第7和14天无明显变化, 而阳性对照组和内化组牙周膜干细胞OCN基因表达升高, 与空白对照组相比差异有统计学意义(P < 0.05)。成骨诱导第7天阳性对照组和内化组OCN基因表达无统计学差异(P > 0.05);在成骨诱导第14天, 内化组OCN基因表达明显低于阳性对照组, 差异有统计学意义(P < 0.05) (图 4B)。表明牙周膜干细胞经过成骨诱导后, Runx2和OCN基因表达升高, P. gingivalis ATCC 33277内化后可以抑制牙周膜干细胞Runx2和OCN基因表达。
3 讨论牙周病是细菌感染性疾病, 其临床表现为牙周支持组织不可逆性破坏, 最终导致牙齿松动和脱落, 是成人失牙的最主要原因。牙周治疗目标是促使被炎症破坏的牙周支持组织再生和重建。2004年, SEO等[7]利用单细胞克隆技术, 成功分离、鉴定牙周膜干细胞, 其具有克隆能力、高增殖能力及形成牙骨质样结构的特性, 实现组织学上真正的牙周组织修复和再生, 成为牙周组织工程研究的种子细胞。因此, 在牙周炎症发生过程中, 探索P. gingivalis内化牙周膜干细胞对成骨分化的影响, 采取相应的对策, 将对牙周炎的损伤修复具有重要意义。
克隆形成和多向分化能力是干细胞的主要特征。本研究通过组织块培养法成功培养牙周膜细胞, 经过有限稀释在体外扩增培养后, 细胞呈集落样增长, 在形态学上与其他间充质干细胞一样, 呈现长梭形、旋涡状单层生长, 生长状态良好。牙周膜干细胞的生长曲线具有慢周期性的生物学特性, 免疫组化染色后镜下可见波形蛋白染色阳性, 角蛋白染色阴性, 具有中胚层来源的成纤维细胞的特征。通过茜素红染色观察到牙周膜干细胞体外经成骨诱导后能够分化为成骨细胞, 形成矿化结节, 证实其干细胞的特征, 为进一步的实验研究奠定基础。
近年来许多学者对P. gingivalis毒力因子对牙周膜干细胞的影响进行了深入研究, 然而关于P. gingivalis活菌对牙周膜干细胞的影响鲜有研究, 活菌感染更能真实的反映临床疾病的发生发展过程。研究[8]发现, 当P. gingivalis低感染复数长期感染人永生化口腔上皮细胞后能够促进细胞增殖, 并且具有肿瘤样特征。本研究中在20:1低感染复数下, 牙周膜干细胞的增殖能力无明显变化。此外, 研究证实P. gingivalis脂多糖能够通过Notch1信号通路, 抑制成骨细胞的骨向分化潜能[9]。当干细胞分化为成骨细胞时, Runx2、OCN、ALP均为干细胞成骨相关因子, 分别在干细胞不同成骨时期高表达[10]。Runx2是成骨细胞的特异性转录因子, 其调控成骨基因的表达并诱导成骨细胞分化和骨形成。OCN由成骨细胞合成和分泌, 主要在矿化形成期出现, 被认为是成骨细胞向矿化期分化的标志之一。在骨化和成骨过程中ALP与骨的钙化相互协调, 钙与ALP产生的磷酸结合成磷酸钙沉积于骨中。本研究表明, P. gingivalis ATCC 33277内化组牙周膜干细胞矿化结节少而稀疏, ALP活性明显低于阳性对照组, 差异有统计学意义。同时P. gingivalis ATCC 33277内化组牙周膜干细胞Runx2和OCN基因表达低于阳性对照组, 差异有统计学意义(P < 0.05)。结果表明, P. gingivalis ATCC 33277内化牙周膜干细胞后可抑制其成骨分化的能力。
近年来干细胞所处的微环境越来越受到研究者的关注, 如何改善或恢复由感染而引起的牙周膜干细胞成骨能力下降成为牙周再生的一个新思路。长期慢性感染微环境对干细胞增殖和分化的影响尚需深入的研究, 探索P. gingivalis内化牙周膜干细胞影响骨向分化的机制, 采取相应的措施, 对防治牙周炎症具有重要意义。
| [1] |
潘春玲, 刘俊超, 潘亚萍, 等. 牙龈卟啉单胞菌对人牙周膜成纤维细胞MMP-1和TIMP-1表达影响的研究[J]. 中国实用口腔科杂志, 2012, 5(4): 210-213. DOI:10.3969/j.issn.1674-1595.2012.04.005 |
| [2] |
NAGATA M, IWASAKI K, AKAZAWA K, et al. Conditioned medium from periodontal ligament stem cells enhances periodontal regeneration[J]. Tissue Eng Part A, 2017, 23(9/10): 367-377. DOI:10.1089/ten.TEA.2016.0274 |
| [3] |
LI X, ZHENG Y, ZHENG Y, et al. Circular RNA CDR1as regulates osteoblastic differentiation of periodontal ligament stem cells via the miR-7/GDF5/SMAD and p38 MAPK signaling pathway[J]. Stem Cell Res Ther, 2018, 9(1): 232. DOI:10.1186/s13287-018-0976-0 |
| [4] |
KANEKI H, GUO R, CHEN D, et al. Tumor necrosis factor promotes Runx2 degradation through up-regulation of Smurf1 and Smurf2 in osteoblasts[J]. J Biol Chem, 2006, 281(7): 4326-4333. DOI:10.1074/jbc.M509430200 |
| [5] |
BAILEY S, KARSENTY G, GUNDBERG C, et al. Osteocalcin and osteopontin influence bone morphology and mechanical properties[J]. Ann N Y Acad Sci, 2017, 1409(1): 79-84. DOI:10.1111/nyas.13470 |
| [6] |
PAN C, LIU J, WANG H, et al. Porphyromonas gingivalis can invade periodontal ligament stem cells[J]. BMC Microbiol, 2017, 17(1): 38. DOI:10.1186/s12866-017-0950-5 |
| [7] |
SEO BM, MIURA M, GRONTHOS S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004, 364(9429): 149-155. DOI:10.1016/S0140-6736(04)16627-0 |
| [8] |
GENG F, LIU J, GUO Y, et al. Persistent exposure to Porphyromonas gingivalis promotes proliferative and invasion capabilities, and tumorigenic properties of human immortalized oral epithelial cells[J]. Front Cell Infect Microbiol, 2017, 7: 57. DOI:10.3389/fcimb.2017.00057 |
| [9] |
XING Q, YE Q, FAN M, et al. Porphyromonas gingivalis lipopolysaccharide inhibits the osteoblastic differentiation of preosteoblasts by activating Notch1 signaling[J]. Cell Physiol, 2010, 225(1): 106-114. DOI:10.1002/jcp.22201 |
| [10] |
XIANG L, ZHANG X, YU H, et al. Overexpression of αCGRP promotes osteogenesis of periodontal ligament cells by regulation of YAP signaling[J]. J Cell Physiol, 2019, 234(4): 5077-5085. DOI:10.1002/jcp.27311 |
 2019, Vol. 48
2019, Vol. 48