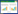文章信息
- 付雪岩, 王雅玮, 王文青, 吴刚
- FU Xueyan, WANG Yawei, WANG Wenqing, WU Gang
- RNA干扰沉默水通道蛋白3基因对人肝癌细胞SMMC-7721增殖和凋亡的影响
- Effect of Aquaporin 3 Gene Silencing on the Proliferation and Apoptosis of the Hepatocellular Carcinoma Cell Line SMMC-7721
- 中国医科大学学报, 2019, 48(7): 596-600
- Journal of China Medical University, 2019, 48(7): 596-600
-
文章历史
- 收稿日期:2018-08-28
- 网络出版时间:2019-07-15 11:09
2. 中国医科大学附属第一医院 老年外科, 沈阳 110001
2. Department of Geriatric Surgery, The First Hospital, China Medical University, Shenyang 110001, China
水通道蛋白3 (aquaporin3, AQP3)属于水通道蛋白家族(aquaporins, AQPs), 是一种位于细胞膜上的蛋白质, 在细胞膜上组成"孔道", 可控制水、甘油和其他一些小溶质分子在细胞内外的进出[1]。目前, AQP3被认为与癌症的发生发展密切相关[2]。在肝癌中, 相对于癌旁组织, AQP3在肝癌组织中表达明显升高并且与肝癌的分级、分期、转移和预后有关[3-5]。本研究中通过干扰沉默人肝癌细胞SMMC-7721的AQP3基因的表达, 检测其对细胞增殖和细胞凋亡的影响, 初步探讨AQP3与肝癌发生发展的关系, 可能为肝癌的诊断和治疗提供一个新的靶点和方向。
1 材料与方法 1.1 细胞培养肝癌细胞株SMMC-7721购于中国科学院(中国上海)。DMEM培养基中加入10%胎牛血清(fetal bovine serum, FBS)和100 U/mL青霉素和链霉素(美国hyclone公司)。在37 ℃下、5% CO2的加湿培养箱中培养细胞。
1.2 细胞转染将SMMC-7721细胞接种在6孔板中, 并培养直至达60%融合。去除6孔板中含有的血清, 采用Lipofectamine 2000 (美国invitrogen公司)分别转染siRNA-NC、siRNA-AQP3#1和siRNA-AQP3#2 (苏州吉玛制药技术有限公司), 继续培养48 h后进行相关研究。将细胞分为4组:空白对照组、siRNA-NC组、siRNA-AQP3#1组和siRNA-AQP3#2组。siRNA-AQP3#1和siRNA-AQP3#2序列如下:siRNA-AQP3#1 F, 5'-CCUUUGCCAUGUGCUUCCUTT-3'; R, 5'-AGGAAGCACAUGGCAAAGGTT-3'。siRNA-AQP3#2 F, 5'-CCCUUAUCGUGUGUGUGCUTT-3'; R, 5'-AGCACACACACGAUAAGGGTT-3'。
1.3 RNA提取和qRT-PCR参照Trizol说明书提取SMMC-7721总RNA。然后使用GoScriptTM Reverse Transcription Mix, Random Primers试剂盒(美国promega公司)反转录成cDNA。最后在ABI PRISMR 7500 (美国ABI公司) PCR仪上进行荧光实时定量PCR, cDNA扩增使用GoTaqR qPCR Master Mix (美国promega公司), 采用两步法标准PCR扩增程序:第1步(预变性) 95 ℃ 2 min 1个循环; 第2步(PCR反应) 95 ℃ 15 s, 60℃, 共40个循环。根据CT值通过公式2-ΔΔCt进行相对定量分析计算得AQP3 mRNA相对表达量。AQP3的引物及内参β-actin[10]由生工生物工程(中国上海)公司合成。AQP3 F, 5'-CCGTGACCTTTGCCATGTG-3'; R, 5'-CGAAGTGCCAGATTGCATCATAA-3'。β-actin F, 5'-CGTCATACTCCTGCTTGCTG-3'; R, 5'-GTACGCCAACACAGTGCTG-3'。
1.4 细胞增殖实验取对数生长期的细胞, 胰酶消化并收集4组细胞, 1 000 r/min离心, 去上清, 加入完全培养基, 调整细胞浓度到5×103/mL, 接种于96孔板中, 每孔100 μL, 每孔设4个复孔, 分别培养24 h、48 h、72 h后, 每孔加入10 μL CCK8试剂(中国碧云天公司), 继续在培养箱孵育1.5 h, 在酶标仪上选择450 nm波长测定每孔的吸光度值, 描绘生长曲线。对于平板克隆实验, 将细胞以1 500/孔接种在6孔板上2周。然后, 用磷酸盐缓冲盐水(phosphate buffer saline, PBS)洗涤细胞2次, 4%多聚甲醛固定, 0.5%结晶紫染色, 最后计数菌落数。
1.5 细胞凋亡检测按照凋亡试剂盒(日本Dojindo labotories公司)说明书操作, 胰酶消化并收集4组细胞, PBS洗涤2次, 并收集约5×105细胞, 1 000 r/min离心5 min后加入100 μL Annexin V缓冲液悬浮细胞, 最后分别加入PI和Annexin-V染液吹打混匀, 室温避光染色15 min加入400 μL Annexin V缓冲液, 流式细胞仪检测细胞凋亡。
1.6 Western blotting足量的4组细胞常规消化离心, 在冰上裂解, 将得到的裂解物离心, 取上清, 并用BCA法测定浓度, 样品均定量为5 μg/μL, 变性, 取50 μg蛋白经10% SDS-PAGE电泳, 70 V 80 min转移至PVDF膜。5%脱脂奶粉封闭90 min。孵育一抗(1:1 000), 4 ℃过夜孵育。次日, TBST洗膜后室温孵育二抗2 h (1:10 000), TBST清洗, 最后在ECL仪上完成发光。
1.7 统计学分析采用SPSS 20.0统计软件分析, 数据用x±s表示, 2组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 干扰沉默后AQP3表达水平的检测采用RNA干扰技术沉默AQP3基因, 实时PCR及Western blotting分析处理后的4组细胞的AQP3 mRNA及蛋白的表达水平。结果显示, siRNA-AQP3#1组(0.276 9±0.047 78)和siRNA-AQP3#2组(0.462 9±0.084 02)的AQP3 mRNA和蛋白质的表达明显下调(图 1), 且差异有统计学意义(P < 0.001, P < 0.01)。说明AQP3 siRNA转染可以有效的干扰沉默AQP3 mRNA和蛋白的表达。
|
| A, AQP3 protein; B, AQP3 mRNA. *P < 0.01 vs siRNA-NC group; #P < 0.001 vs siRNA-NC group. 图 1 干扰后AQP3 mRNA和蛋白表达水平 Fig.1 AQP3 mRNA and protein expression levels after interference |
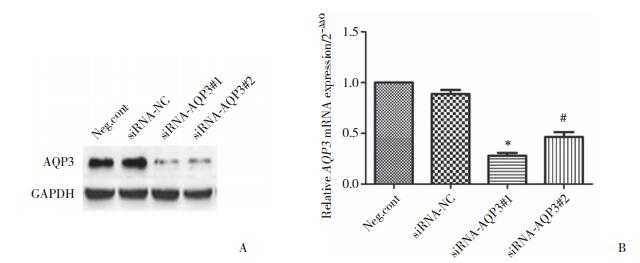
2.2 CCK-8和平板克隆实验检测细胞增殖
使用CCK-8方法对4组细胞转染后24 h、48 h、72 h的活力进行观察, 发现siRNA-AQP3#1组(59.00±4.583)和siRNA-AQP3#2组(68.33±7.024)均表现出明显的活力降低, 说明细胞增殖能力减弱。平板克隆集落形成实验也得到相似的的结果(图 2), 且差异有统计学意义(P < 0.01, P < 0.05)。
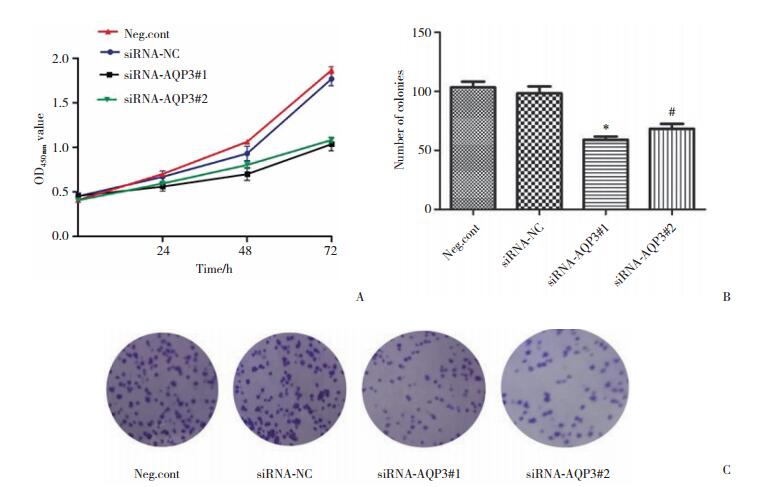
|
| A, CCK-8 assay detects the proliferation ability of each cell group; B, comparison of the cell colony numbers; C, effects of siRNAs on cell colony numbers. *P < 0.01 vs siRNA-NC group; #P < 0.05 vs siRNA-NC group. 图 2 各组处理因素对细胞增殖能力的影响 Fig.2 Effect of the treatment factors on the cell proliferation ability of each group |
2.3 流式细胞仪检测细胞凋亡
AnnexinV-FITC/PI双染法结果显示, siRNA-AQP3#1组(10.6±0.413 1)和siRNA-AQP3#2组(8.22±0.353 0)的凋亡比率明显高于其余2组(图 3), 且差异有统计学意义(P < 0.001, P < 0.01)。说明沉默AQP3能够明显促进SMMC-7721细胞的凋亡。
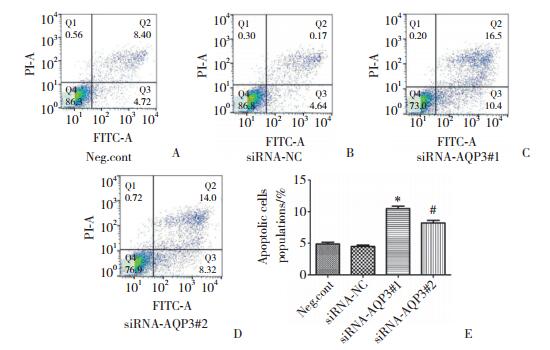
|
| A-D, FACS analysis of SMMC-7721 cells stained with Annexin V/FITC/PI; E, apoptosis rates of each cell group.*P < 0.001 vs siRNA-NC group; #P < 0.01 vs siRNA-NC group. 图 3 各组处理因素对细胞凋亡的影响 Fig.3 Effect of the treatment factors on apoptosis in each group |
3 讨论
肝细胞癌是世界上第五大常见的癌症, 并且也是癌症相关死亡的第二大原因, 大多数患者在疾病的晚期被诊断出来, 失去手术治疗机会, 且预后较差[6-7]。过去几十年, 人们一直致力于肝癌的分子机制研究, 而随着医学分子技术的发展, 众多关于肝癌发生发展的关键分子被发现及研究, 对于肝癌的诊断及治疗有着重大的意义。
AQPs是一类内在膜蛋白通道, 其促进水和小分子(如甘油)通过由渗透或溶质梯度驱动的细胞膜扩散。在哺乳动物中表达的13种同种型(AQP0~12)对水稳态和能量平衡起着至关重要的作用[8-9]。AQP3基因位于人染色体9p13.3, 其在多种上皮细胞的基底外侧质膜中表达。在胃肠道中, AQP3在胃黏膜组织、回肠和远端结肠中表达, 有助于水和甘油的转运。在呼吸道中, AQP3在上呼吸道和下呼吸道中表达, 能够促进穿过气道上皮细胞的渗透水的运输。此外, AQP3在脑、乳腺、肝脏、胰腺、卵巢、前列腺和膀胱等上皮细胞中都有表达[2]。近些年来, 随着先进的分子技术对AQPs研究的深入, 越来越多的研究证据表明, AQP3在癌症的进展和转移中起着关键作用。除了膀胱癌, AQP3在大多数癌症中都呈高表达, 具体的作用机制尚不清楚, 可能通过影响细胞增殖、迁移、上皮间质转化过程以及潜在的下游调控元件参与癌症的发生发展。例如, 在胰腺癌中, AQP3通过调节mTOR信号传导促进胰腺癌的增殖生长[10]; 在胃癌中, AQP3参与细胞的增殖、迁移和侵袭过程, 并且可能通过调节PI3K/AKT/SNAIL信号通路参与胃癌细胞的上皮间质转化过程[11]; 在乳腺癌中, AQP3通过调节H2O2转运及其下游细胞信号传导控制乳腺癌细胞的迁移过程[12]。
本研究采用RNA干扰技术沉默人肝癌细胞SMMC-7721的AQP3表达, 沉默后的mRNA和蛋白水平明显下降, 说明AQP3 siRNA起到了很好的干扰效果。此外, 沉默AQP3引起的SMMC-7721细胞增殖能力减弱, 细胞凋亡增加, 但其具体作用机制尚不清楚。随着对AQP3在肿瘤发生发展过程中作用机制的深入研究, 相信AQP3未来将作为肝癌生物治疗的新靶点, 在肝癌的早期诊断、早期治疗中发挥更为重要的作用。
| [1] |
VERKMAN VS, MITRA AK. Structure and function of aquaporin water channels[J]. Am J Physiol Renal Physiol, 2000, 278(1): 13-28. DOI:10.1152/ajprenal.2000.278.1.F13 |
| [2] |
MARLAR S, JENSEN HH, LOGIN FH, et al. Aquaporin-3 in cancer[J]. Int J Mol Sci, 2017, 18(10): 2106. DOI:10.3390/ijms18102106 |
| [3] |
GUO X, SUN T, YANG M, et al. Prognostic value of combined aquaporin 3 and aquaporin 5 overexpression in hepatocellular carcinoma[J]. Biomed Res Int, 2013, 2013: 206525. DOI:10.1155/2013/206525 |
| [4] |
CHEN XF, LI CF, LV L, et al. Expression and clinical significance of aquaglyceroporins in human hepatocellular carcinoma[J]. Mol Med Rep, 2016, 13(6): 5283-5289. DOI:10.3892/mmr.2016.5184 |
| [5] |
CHEN G, SHI Y, LIU M, et al. circHIPK3 regulates cell proliferation and migration by sponging miR-124 and regulating AQP3 expression in hepatocellular carcinoma[J]. Cell Death Dis, 2018, 9(2): 175. DOI:10.1038/s41419-017-0204-3 |
| [6] |
ARAVALLI RN, STEER CJ, CRESSMAN EN. Molecular mechanisms of hepatocellular carcinoma[J]. Hepatology, 2008, 48(6): 2047-2063. DOI:10.1002/hep.22580 |
| [7] |
PETRICK JL, BRAUNLIN M, LAVERSANNE M, et al. International trends in liver cancer incidence, overall and by histologic subtype, 1978-2007[J]. Int J Cancer, 2016, 139(7): 1534-1545. DOI:10.1002/ijc.30211 |
| [8] |
GOMES A, DA SILVA IV, RODRIGUES CMP, et al. The emerging role of microRNAs in aquaporin regulation[J]. Front Chem, 2018, 6: 238. DOI:10.3389/fchem.2018.00238 |
| [9] |
RIBATTI D, RANIERⅡ G, ANNESE T, et al. Aquaporins in cancer[J]. Biochim Biophys Acta, 2014, 1840(5): 1550-1553. DOI:10.1016/j.bbagen.2013.09.025 |
| [10] |
HUANG X, HUANG L, SHAO M. Aquaporin 3 facilitates tumor growth in pancreatic cancer by modulating mTOR signaling[J]. Biochem Biophys Res Commun, 2017, 486(4): 1097-1102. DOI:10.1016/j.bbrc.2017.03.168 |
| [11] |
CHEN J, WANG T, ZHOU YC. Aquaporin 3 promotes epithelial-mesenchymal transition in gastric cancer[J]. J Exp Clin Cancer Res, 2014, 33: 38. DOI:10.1186/1756-9966-33-38 |
| [12] |
SATOOKA H, HARA-CHIKUMA M. Aquaporin-3 controls breast cancer cell migration by regulating hydrogen peroxide transport and its downstream cell signaling[J]. Mol Cell Biol, 2016, 36(7): 1206-1218. DOI:10.1128/MCB.00971-15 |
 2019, Vol. 48
2019, Vol. 48