文章信息
- 孙大壮, 宋春青, 许勇民, 董雪松
- SUN Dazhuang, SONG Chunqing, XU Yongmin, DONG Xuesong
- 丝裂原活化蛋白激酶通路在百草枯诱导人肺Ⅱ型上皮样细胞A549凋亡中的作用
- Role of MAPK Pathways in Paraquat Induced Apoptosis in Human Lung TypeⅡAlveolar Epithelial-like A549 Cells
- 中国医科大学学报, 2019, 48(7): 577-581
- Journal of China Medical University, 2019, 48(7): 577-581
-
文章历史
- 收稿日期:2018-06-20
- 网络出版时间:2019-07-15 10:18
百草枯(paraquat, PQ), 化学名为1, 1'-二甲基-4, 4'-联吡啶阳离子盐, 是一种广泛使用的季胺类高效能除草剂, 由于其高毒性和缺乏有效的治疗措施而使患者具有极高的中毒死亡率。大多数PQ中毒患者死于急性肺损伤(acute lung injury, ALI)或进行性肺纤维化。其中, PQ中毒所致的肺泡上皮凋亡在ALI的发展过程中与后期发生肺间质纤维化中起关键作用[1-2]。到目前为止, PQ诱导肺泡上皮细胞凋亡的分子机制尚未完全了解。之前研究[3]发现PQ通过激活线粒体凋亡通路诱导人肺Ⅱ型上皮样A549细胞凋亡。最近有研究[4]发现丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)激活可能参与PQ诱导的凋亡分子机制。MAPK通路由多条并行的信号通路组成。哺乳类细胞目前已发现存在3条并行的MAPK通路:细胞外信号调节蛋白激酶(extracellular-signal regulated protein kinase, ERK)通路, c-Jun N-末端激酶(c-Jun N-terminal protein kinase, JNK)通路和P38通路[5]。近年来越来越多的研究[6-8]表明JNK和p38在各种细胞应激因子的刺激下通过磷酸化修饰激活, 然后诱导促凋亡蛋白Bax表达, 同时抑制抗凋亡蛋白Bcl-2表达, 从而导致Bax介导的线粒体凋亡途径。然而MAPK在PQ中毒中的作用及其机制并不清楚。本研究探讨PQ诱导人肺Ⅱ型上皮样细胞A549凋亡过程中MAPK的作用及其机制, 旨在为进一步研究PQ中毒治疗提供理论依据。
1 材料与方法 1.1 材料人肺Ⅱ型上皮样细胞A549 (中国医科大学实验中心), 胎牛血清(美国Gemini公司), RPMI 1640培养基(美国HyClone公司), PQ、胰蛋白酶、MTT、DMSO (美国Sigma公司), SP600125、SB203580、ECL发光液、细胞裂解液和BCA蛋白定量试剂盒(上海碧云天生物技术研究所), Caspase活性检测试剂盒(南京凯基生物技术有限公司), Annexin V-FITC细胞凋亡检测试剂盒(日本DOJINDO公司), Bcl-2、Bax、β-actin、HRP标记的山羊抗兔IgG抗体、HRP标记的山羊抗鼠IgG抗体(美国Proteintech Group公司), JNK、p-JNK、P38、p-P38抗体(美国Bioworld Technology公司)。
1.2 方法 1.2.1 细胞培养及分组细胞培养在含10%胎牛血清的RPMI-1640培养液中, 培养条件为含5%的CO2的37 ℃培养箱。(1)对照组, 细胞加入等量RPMI-1640培养液; (2) SP600125组, 细胞用含有JNK特异性抑制剂SP600125 (10 μmol/L)的培养液预处理2 h; (3) SB203580组, 细胞用含P38特异性抑制剂SB203580 (10 μmol/L)的培养液预处理2 h; (4) PQ组, 含PQ (200 μmol/L)的培养液培养细胞; (5) SP600125+PQ组, 细胞用含SP600125 (10 μmol/L)的培养液预处理2 h后, 加入含PQ (200 μmol/L)的培养液; (6) SB203580 + PQ组, 细胞使用含SB203580 (10 μmol/L)的培养液预处理2 h后, 加入含PQ (200 μmol/L)的培养液。各组细胞按分组处理后继续培养48 h。
1.2.2 细胞活性检测将细胞种植在96孔板内, 实验分组处理结束后, 每孔加入5 mg/mL MTT (20 μL)混匀, 在37 ℃、5% CO2条件下培养4 h, 吸干每孔内上清, 每孔加入DMSO 150 μL震荡, 使沉淀充分溶解。酶标仪570 nm测定吸光度值。
1.2.3 细胞凋亡率检测将细胞种植在6孔板内, 待细胞贴壁后按实验分组处理细胞。孵育完成后, 使用不含EDTA的胰蛋白酶收集细胞, 1 000 r/min离心5 min, PBS洗涤2次, 加入5 μL的Annexin V-FITC和5 μL PI室温避光孵育15 min, 流式细胞仪检测细胞凋亡率。
1.2.4 Caspases活性检测实验分组处理结束后收集各组细胞, PBS洗涤3次, 加入适量裂解缓冲液, 待细胞裂解完全, 10 000 r/min离心1 min收集上清, 使用BCA蛋白定量试剂盒检测蛋白浓度。蛋白浓度定为3 μg/μL, 吸取50 μL细胞裂解产物加入50 μL的2×缓冲液与5 µL Caspase反应底物, 37 ℃避光孵育4 h。酶标仪405 nm测定吸光度值。
1.2.5 Western blotting检测JNK、p-JNK、P38、p-P38、Bax、Bcl-2蛋白表达收集各组细胞并提取蛋白, 通过BCA试剂盒测定各组蛋白浓度。样品经12% SDS-PAGE电泳分离, 湿电转移至PVDF膜上, 膜在室温下用5%的脱脂奶粉封闭2 h, 加入TBST稀释的JNK、p-JNK、P38、p-P38、Bax、Bcl-2和β-actin抗体, 4℃过夜, 洗膜后加入TBST稀释的二抗, 室温2 h。使用ECL发光液显色, 最后进行显影, 定影。采用Image J图像分析软件进行灰度分析。
1.3 统计学分析应用SPSS 20.0统计软件进行分析, 各组数据均采用x±s表示, 组间差异采用单因素方差分析, 方差齐时组间两两差异比较采用Dunnett t检验; 方差不齐时用Dunnett's T3检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组细胞活性比较MTT法细胞活性分析结果显示, 与对照组比较, SP600125组和SB20358组细胞活性差异无统计学意义(P > 0.05);与对照组比较PQ可显著降低A549的细胞活性(P < 0.01)。与PQ组比较, SP600125+PQ组、SB203580+PQ组可显著抑制PQ导致的细胞活性下降(均P < 0.01)。可见抑制JNK MAPK通路或P38 MAPK通路可以减弱PQ的细胞毒性。见表 1。
| Group | Cell viability | Apoptosis rate | Caspase-3 activation | Caspase-9 activation |
| Control | 100.83±0.85 | 6.00±0.41 | 100.67±0.94 | 101.00±1.41 |
| SP600125 | 99.33±2.49 | 6.43±0.49 | 101.00±2.94 | 101.33±2.50 |
| SB203580 | 101.00±2.94 | 6.47±0.73 | 99.00±2.94 | 101.01±2.95 |
| PQ | 13.33±2.361) | 82.43±5.751) | 185.33±6.131) | 180.67±8.731) |
| SP600125+PQ | 24.01±2.941), 2) | 51.07±4.901), 2) | 147.67±5.191), 2) | 153.67±7.411), 2) |
| SB203580+PQ | 28.01±2.741), 2) | 39.73±2.481), 2) | 136.67±6.241), 2) | 136.67±6.241), 2) |
| 1) P < 0.01 vs control group; 2) P < 0.01 vs PQ group. | ||||
2.2 各组细胞凋亡率比较
流式细胞仪检测细胞凋亡结果显示, 与对照组比较, SP600125组和SB203580组细胞凋亡率差异无统计学意义(均P > 0.05); PQ组A549细胞凋亡率显著增高(P < 0.01)。与PQ组比较, SP600125+PQ组、SB203580+PQ组减弱PQ诱导的细胞凋亡, 对细胞提供保护作用(均P < 0.01), 见表 1、图 1。
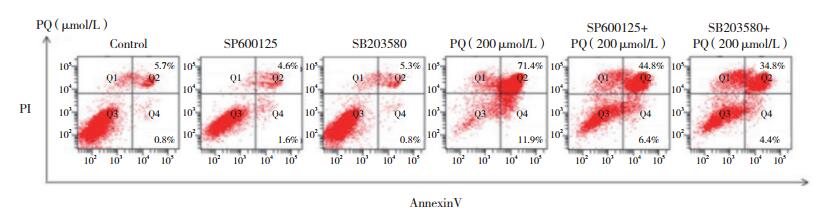
|
| 图 1 阻断MAPK通路对PQ诱导的细胞凋亡影响 Fig.1 Effect of blocking MAPK pathways on PQ-induced apoptosis |
2.3 各组细胞Caspase-3、Caspase-9活性比较
内源性凋亡途径不需要细胞表面受体, 而是依赖于参与的线粒体。当细胞受到凋亡刺激时, 细胞色素C从线粒体释放, 与Apaf1结合形成凋亡复合物, 然后激活Caspase-9。凋亡复合物与激活的Caspase-9进而激活下游的Caspase-3、Caspase-6、Caspase-7, 介导细胞发生线粒体凋亡。结果显示, 与对照组比较, SP600125组和SB203580组细胞Caspase-3和Caspase-9活性差异无统计学意义(均P > 0.05); PQ可显著增加A549细胞Caspase-3和Caspase-9活性(均P < 0.01)。与PQ组比较, SP600125+PQ组、SB203580+PQ组显著降低PQ诱导的A549细胞Caspase-3和Caspase-9活性(均P < 0.01), 见表 1。
2.4 各组细胞MAPK与线粒体凋亡信号转导通路相关蛋白表达比较A549细胞分组处理48 h后, Western blotting检测JNK、p-JNK、P38、p-P38、Bax、Bcl-2和β-actin蛋白表达。结果显示, 与对照组比较, SP600125组和SB20358组蛋白表达无统计学差异(均P > 0.05); PQ组蛋白表达有统计学差异(均P < 0.01)。与PQ组比较, SP600125+PQ组显著降低PQ诱导的A549细胞p-JNK/JNK表达、降低Bax表达并且增加Bcl-2蛋白表达; SB203580+PQ组显著降低PQ诱导的A549细胞p-P38/P38表达比例、降低Bax表达并且增加Bcl-2蛋白表达, 见表 2、图 2。
| Group | p-JNK/JNK | p-P38/P38 | Bax | Bcl-2 |
| Control | 1.00±0.14 | 1.01±0.03 | 1.00±0.04 | 1.00±0.01 |
| SP600125 | 1.30±0.13 | 1.02±0.02 | 0.93±0.02 | 1.01±0.01 |
| SB203580 | 1.16±0.11 | 1.00±0.02 | 0.94±0.06 | 1.00±0.03 |
| PQ | 2.24±0.241) | 1.64±0.181) | 5.22±0.291) | 0.33±0.061) |
| SP600125+PQ | 1.63±0.161), 3) | 1.48±0.041) | 2.29±0.162), 3) | 0.57±0.041), 3) |
| SB203580+PQ | 1.92±0.111) | 1.13±0.053) | 1.85±0.092), 3) | 0.74±0.031), 3) |
| 1) P < 0.01; 2) P < 0.05 vs control group; 3) P < 0.01 vs PQ group. | ||||
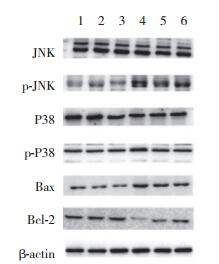
|
| 1, control group; 2, SP600125 group; 3, SB203580 group; 4, PQ group; 5, SP600125+PQ group; 6, SB203580+PQ group. 图 2 各组细胞MAPK与线粒体凋亡信号转导通路相关蛋白表达 Fig.2 Protein expression of MAPK and mitochondrial apoptosis signal transduction pathway-related proteins in each group |
3 讨论
摄入体内的PQ可通过多胺转运/摄取系统, 逆浓度梯度转运并积累至Ⅰ、Ⅱ型肺泡上皮细胞中。PQ积聚引起细胞坏死凋亡等组织病理学改变, 造成肺泡上皮显著损伤与破坏, 导致气体交换功能障碍和表面活性物质缺乏, 出现肺泡炎、ALI与肺间质纤维化等临床表现[9]。PQ诱导的肺泡上皮细胞凋亡涉及多种信号转导途径, 线粒体途径介导的凋亡发挥了重要的作用。以往研究[10]证实PQ诱导人肺Ⅱ型上皮样细胞A549凋亡通过线粒体凋亡途径, P53蛋白是凋亡过程的重要调控者。
MAPK信号通路在调控应激条件下细胞凋亡中起重要作用。研究[6-8]发现JNK与P38 MAPK在各种细胞因子刺激下通过自身磷酸化激活, 进一步介导线粒体凋亡途径。线粒体凋亡途径主要是通过Bcl-2蛋白家族中促凋亡蛋白和抑凋亡蛋白之间的蛋白相互作用来控制[11-12]。Bax在正常情况下以可溶的形式存在于细胞质中。Bax一旦被凋亡刺激物激活, 从细胞质中转移至线粒体, 导致线粒体通透性改变, 从而降低线粒体膜电位[13]。然后, 细胞色素C从线粒体中释放出来, 激活Caspase-9和Caspase-3, 最终导致细胞凋亡。
近年来, 越来越多的证据表明PQ引起细胞凋亡涉及到MAPK信号通路。最近的研究[14]发现PQ通过激活P38 MAPK信号通路延长嗜中性粒细胞寿命, 诱导活性氧产生并且增加TNF-α浓度。PENG等[15]研究发现JNK信号级联是PQ介导的黑质多巴胺能神经元凋亡机制的直接激活剂, 并提供了氧化应激和神经元凋亡之间的分子联系。一般来说, ERK1/2激活促进细胞增殖, 对抗由应激激活的JNK和P38 MAPK通路所产生的促凋亡功能[16-17]。刘振宁等[18]研究发现MAPK参与了PQ诱导SD大鼠肺损伤过程, 并在其中起重要的作用。然而MAPK信号通路在PQ诱导的肺泡上皮细胞凋亡中的作用并不清楚。本研究通过使用JNK特异性抑制剂(SP600125)预处理抑制JNK MAPK与P38特异性抑制剂(SB203580)预处理抑制P38 MAPK, 观察是否可以减弱PQ诱导的A549细胞凋亡。结果显示SP600125与SB203580均可减轻PQ诱导的A549细胞凋亡, 证明PQ诱导A549细胞凋亡通过JNK/P38介导的线粒体凋亡信号通路。
综上所述, 本研究以A549细胞作为人肺泡Ⅱ型上皮细胞模型来评估PQ诱导细胞凋亡的机制, 发现PQ通过MAPK介导的线粒体凋亡途径诱导A549细胞凋亡, 为新药的研发提供了实验和理论依据。本研究仅使用SP600125与SB203580预处理细胞观察了MAPK途径的作用, 下一步需通过基因敲除手段来进一步验证。
| [1] |
CHEN YW, YANG YT, HUNG DZ, et al. Paraquat induces lung alveolar epithelial cell apoptosis via Nrf-2-regulated mitochondrial dysfunction and ER stress[J]. Arch Toxicol, 2012, 86(10): 1547-1558. DOI:10.1007/s00204-012-0873-8 |
| [2] |
PERL M, CHUNG CS, PERL U, et al. Fas-induced pulmonary apoptosis and inflammation during indirect acute lung injury[J]. Am J Respir Crit Care Med, 2007, 176(6): 591-601. DOI:10.1164/rccm.200611-1743OC |
| [3] |
孙大壮, 王蕊, 宋春青, 等. 百草枯通过激活线粒体凋亡通路诱导人肺Ⅱ型上皮样A549细胞凋亡[J]. 中国医科大学学报, 2017, 46(11): 961-966. DOI:10.12007/j.issn.0258-4646.2017.11.001 |
| [4] |
PANG YW, SUN YQ, SUN WJ, et al. Melatonin inhibits paraquat-induced cell death in bovine preimplantation embryos[J]. J Pineal Res, 2016, 60(2): 155-166. DOI:10.1111/jpi.12297 |
| [5] |
CARGNELLO M, ROUX PP. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases[J]. Microbiol Mol Biol Rev, 2011, 75(1): 50-83. DOI:10.1128/MMBR.00031-10 |
| [6] |
KIM HS, LEE JH, PARK HS, et al. Schizandra chinensis extracts induce apoptosis in human gastric cancer cells via JNK/P38 MAPK activation and the ROS-mediated/mitochondria-dependent pathway[J]. Pharm Biol, 2015, 53(2): 212-219. DOI:10.3109/13880209.2014.913297 |
| [7] |
WANG Y, XIA CH, LUN ZQ, et al. Crosstalk between P38 MAPK and caspase-9 regulates mitochondria-mediated apoptosis induced by tetra-α-(4-carboxyphenoxy)phthalocyanine zinc photodynamic therapy in LoVo cells[J]. Oncol Rep, 2018, 39(1): 61-70. DOI:10.3892/or.2017.6071 |
| [8] |
NAVEENKUMAR SK, HEMSHEKHAR M, SUNDARAM MS, et al. Cell-free methemoglobin drives platelets to apoptosis via mitochondrial ROS-mediated activation of JNK and P38 MAP kinase[J]. Biochem Biophys Res Commun, 2017, 491(1): 183-191. DOI:10.1016/j.bbrc.2017.07.073 |
| [9] |
DINIS-OLIVEIRA RJ, DUARTE JA, SÁNCHEZ-NAVARRO A, et al. Paraquat poisonings:mechanisms of lung toxicity, clinical features and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13-71. DOI:10.1080/10408440701669959 |
| [10] |
孙大壮, 王蕊, 宋春青, 等. 百草枯经P53介导的线粒体凋亡途径诱导人肺泡Ⅱ型上皮样细胞A549凋亡[J]. 临床急诊杂志, 2017, 18(8): 561-565. DOI:10.13201/j.issn.1009-5918.2017.08.001 |
| [11] |
LLAMBI F, GREEN DR. Apoptosis and oncogenesis:give and take in the BCL-2 family[J]. Curr Opin Genet Dev, 2011, 21(1): 12-20. DOI:10.1016/j.gde.2010.12.001 |
| [12] |
ADAMS JM, CORY S. The Bcl-2 apoptotic switch in cancer development and therapy[J]. Oncogene, 2007, 26(9): 1324-1337. DOI:10.1038/sj.onc.1210220 |
| [13] |
ANTONSSON B, MONTESSUIT S, SANCHEZ B, et al. Bax is present as a high molecular weight oligomer/complex in the mitochondrial membrane of apoptotic cells[J]. J Biol Chem, 2001, 276(15): 11615-11623. DOI:10.1074/jbc.M010810200 |
| [14] |
WANG XL, LUO FL, ZHAO HG. Paraquat-induced reactive oxygen species inhibit neutrophil apoptosis via a P38 MAPK/NF-kappa B-IL-6/TNF-alpha positive-feedback circuit[J]. PLoS One, 2014, 9(4): e93837. DOI:10.1371/journal.pone.0093837 |
| [15] |
PENG J, MAO XO, STEVENSON FF, et al. The herbicide paraquat induces dopaminergic nigral apoptosis through sustained activation of the JNK pathway[J]. J Biol Chem, 2004, 279(31): 32626-32632. DOI:10.1074/jbc.M404596200 |
| [16] |
JUNTTILA MR, LI SP, WESTERMARCK J. Phosphatase-mediated crosstalk between MAPK signaling pathways in the regulation of cell survival[J]. FASEB J, 2008, 22(4): 954-965. DOI:10.1096/fj.06-7859rev |
| [17] |
MUNSHI A, RAMESH R. Mitogen-activated protein kinases and their role in radiation response[J]. Genes Cancer, 2013, 4(9/10): 401-408. DOI:10.1177/1947601913485414 |
| [18] |
刘振宁, 刘伟, 郭峰, 等. MAPK通路蛋白在百草枯中毒致急性肺损伤大鼠肺组织中的表达及意义[J]. 广东医学, 2015, 36(12): 1834-1837. DOI:10.13820/j.cnki.gdyx.20150630.005 |
 2019, Vol. 48
2019, Vol. 48