文章信息
- 王硕, 郑新宇
- WANG Shuo, ZHENG Xinyu
- 乳腺癌根治术患者化疗相关粒细胞减少与预后的关系
- Prognostic Value of Chemotherapy-Induced Neutropenia in Patients with Breast Cancer Surgery
- 中国医科大学学报, 2019, 48(6): 542-546
- Journal of China Medical University, 2019, 48(6): 542-546
-
文章历史
- 收稿日期:2018-06-23
- 网络出版时间:2019-05-27 16:58
2. 中国医科大学附属第一医院肿瘤研究所第一研究室, 沈阳 110001
2. Lab 1, Cancer Institute, The First Hospital, China Medical University, Shenyang 110001, China
化疗相关粒细胞减少(chemotherapy-induced neutropenia,CIN)是癌症患者化疗严重的血液毒性并发症[1],虽然CIN影响患者化疗周期的正常进行,粒细胞缺乏导致的发热、感染甚至可危及生命;但CIN可能对乳腺癌患者预后有着一定的影响[2-3]。近年来一项队列研究[3]显示,化疗引起的粒细胞减少提示患者预后更好,而疲惫感则提示预后不良,而化疗引起的其他不良反应(恶心呕吐、便秘、腹泻、口腔炎等)与预后无关。回顾性研究[2,4]也表明CIN患者预后更好。也有研究[5]显示CIN患者预后较好,可能与中性粒细胞提高肿瘤细胞的遗传不稳定性、促进肿瘤增殖、侵袭及血管生成有关。但也有研究[6]显示CIN与预后没有明确关系。本研究对327例乳腺癌根治术患者CIN与预后关系进行分析,从而验证CIN在乳腺癌预后中的作用。
1 材料与方法 1.1 临床资料收集2010年9月5日至2011年12月29日我院乳腺外科乳腺癌患者临床资料,包括患者年龄、病理类型、肿物大小、淋巴结转移、HER-2表达、分期、术式、化疗方案等指标。纳入标准:(1)Ⅰ~Ⅲ期乳腺癌患者;(2)接受根治性手术;(3)接受化疗或新辅助化疗并完成既定综合治疗方案。排除标准:(1)双侧乳腺癌或伴随其他肿瘤;(2)无法获得免疫组化结果;(3)骨髓功能异常;(4)激素受体阳性未行内分泌治疗;(5)具有放疗指征未行放疗。免疫组化法检测雌激素受体(estrogen receptor,ER)、孕激素受体(progestrone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2);均由我院病理科完成。ER或PR阳性率≥1%视为激素受体阳性[7],HER2(+)视为阴性,HER(+++)视为阳性,HER2(++)视为不确定[需做荧光原位杂交(fluorescence in situ hybridization,FISH)检测[7]]。
1.2 治疗方案所有患者均接受乳腺癌根治性手术,术后均接受化疗。所有患者化疗周期均为21 d。化疗药物为多西他赛(docetaxel,T;75 mg/m2)、表柔比星(epirubicin,E;80 mg/m2)、环磷酰胺(cyclophosphamide,C;1.0 g)、5-氟尿嘧啶(5-fluorouracil,F,1.0 g),卡铂[carboplatin,P;药物血药浓度-时间曲线下面积(the area under the carve,AUC)=6 mg/(mL·min)];卡培他滨(capecitabine,X;2 500 mg/m2),T、TX、TE、EC方案为4个周期,CEF、TEC、TP及TC方案为6个周期,CEF-T方案为CEF 3个周期序贯T方案3个周期,EC-T方案为EC方案4个周期序贯T方案4个周期,所有患者完成既定化疗方案周期数。根据患者不同化疗方案,将患者按单用蒽环类、单用紫杉类、紫杉类和蒽环类同时应用或序贯应用分为3组:单用蒽环类组(129例)、单用紫杉类组(50例)、紫杉类和蒽环类同时应用或序贯应用组(109例)。重组人粒细胞集落刺激因子用于粒细胞减少症及发热性粒细胞减少患者,接受紫杉类化疗患者预防性应用升白细胞药物。粒细胞计数恢复至1.5×109/L继续下一周期化疗,出现多次粒细胞减少或严重骨髓抑制时考虑减量化疗,原发肿瘤直径≥5 cm或腋窝淋巴结转移数≥4的患者均接受放疗,激素受体阳性患者均接受内分泌治疗。
1.3 粒细胞减少评价与患者随访患者每次化疗后1周及化疗前1~3 d进行血常规检测。根据美国国家癌症研究所发布的化疗药物常见不良反应事件评价标准(NCI-CTCAE 4.0)[8],中性粒细胞减少症分为:0度,≥2.0×109 /L;Ⅰ度,(1.5~1.9)×109 /L;Ⅱ度,(1.0~1.4)×109 /L;Ⅲ度,(0.5~0.9)×109 /L,Ⅳ度,< 0.5×109 /L。本研究将粒细胞低于1.9×109/L作为粒细胞减少判定标准[8]。全部患者随访至2017年8月,随访时间70~84个月,中位随访时间78个月。
1.4 统计学分析数据分析采用SPSS 19.0统计软件。计数资料比较采用χ2检验,CIN与无病生存期关系采用Kaplan-Meier生存分析,影响预后的危险因素采用Cox回归分析。所有数据采用双侧检验,检验水准:α=0.05。
2 结果 2.1 患者临床指标比较共纳入327例患者,其中162例(49.5%)发生CIN。与未发生CIN患者比较,CIN患者年龄、病理类型、肿物大小、淋巴结转移、HER-2表达、分期、术式、化疗方案无统计学差异(均P > 0.05),而ER/PR 2组比较有统计学差异(P < 0.05),激素受体阳性患者发生CIN可能性更大,见表 1。
| Characteristics | CIN group (n = 162) | No-CIN group (n = 165) | χ2 | P |
| Age (year) | 49 (43,57) | 50 (43,58) | 0.006 | 0.995 |
| Pathological type | 1.205 | 0.548 | ||
| IDC | 135 | 132 | ||
| ILC | 9 | 8 | ||
| Others | 18 | 25 | ||
| Tumour staging | 1.796 | 0.616 | ||
| T1 | 56 | 54 | ||
| T2 | 93 | 92 | ||
| T3 | 10 | 12 | ||
| T4 | 3 | 7 | ||
| Axillary metastasis | 3.240 | 0.356 | ||
| N0 | 101 | 88 | ||
| N1 | 37 | 42 | ||
| N2 | 16 | 23 | ||
| N3 | 8 | 12 | ||
| ER/PR | 4.064 | 0.044 | ||
| Positive | 107 | 91 | ||
| Negative | 55 | 74 | ||
| HER-2 | 0.974 | 0.614 | ||
| Positive | 19 | 23 | ||
| Negative | 95 | 88 | ||
| Uncertain | 48 | 54 | ||
| Stage | 1.580 | 0.454 | ||
| Ⅰ | 40 | 33 | ||
| Ⅱ | 91 | 93 | ||
| Ⅲ | 31 | 39 | ||
| Surgery | 2.359 | 0.670 | ||
| Mastectomy+ALND | 121 | 133 | ||
| Breast conserving +ALND | 14 | 10 | ||
| Mastectomy+ SLNB | 12 | 8 | ||
| Breast conserving+ SLNB | 8 | 6 | ||
| NSM+ALND/SLNB+ P (D) I | 7 | 8 | ||
| Chemothrapy regimen | 7.090 | 0.420 | ||
| CEF | 54 | 49 | ||
| CEF-T | 24 | 32 | ||
| EC | 14 | 12 | ||
| TEC/EC-T | 26 | 27 | ||
| TP/TC | 20 | 30 | ||
| TE | 11 | 9 | ||
| TX | 8 | 5 | ||
| T | 5 | 1 | ||
| Recurrence | 4.100 | 0.043 | ||
| Recurrence /death | 29 | 45 | ||
| No recurrence | 133 | 120 | ||
| IDC,invasive ductal carcinoma;ILC,invasive lobular carcinoma;ER/PR,estrogen receptor/progestrone receptor;HER-2,human epidermal growth factor receptor-2;ALND,axillary lymph node dissection;SLNB,sentinel lymph node biopsy;NSM,nipple-sparing mastectomy;P(D)I,prosthesis/ dilator implantation;C,cyclophosphamide;E,epirubicin;F,5-fluorouracil;T,docetaxel;P,carboplatin;X,capecitabine. | ||||
2.2 患者无病生存期比较 2.2.1 发生CIN与未发生CIN患者无病生存期比较:
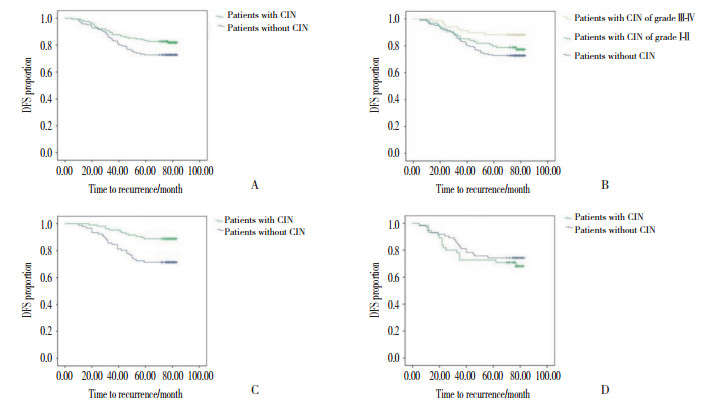
共74例(22.6%)出现复发或转移。Kaplan-Meier生存分析结果显示,发生CIN与未发生CIN患者无病生存期差异有统计学意义(χ2=4.022,P = 0.045),见图 1A。未发生CIN患者(165例)、Ⅰ~Ⅱ度CIN患者(94例)及Ⅲ~Ⅳ度CIN患者(68例)无病生存期比较差异具有统计学意义(χ2=6.281,P = 0.043)。未发生CIN患者与Ⅲ~Ⅳ度CIN患者无病生存期比较有统计学差异(χ2=6.222,P = 0.013)。而未发生CIN患者与Ⅰ~Ⅱ度CIN患者,Ⅰ~Ⅱ度CIN患者与Ⅲ~Ⅳ度CIN患者无病生存期比较无统计学差异(χ2分别为0.752,2.915,P分别为0.386、0.088),见图 1B。
|
| A,patients with CIN and without CIN;B,patients with CIN of gradeⅠ-Ⅱ,grade Ⅲ-Ⅳ,and without CIN;C,HR positive patients with CIN and without CIN;D,HR negative patients with CIN and without CIN. DFS,disease free survival. 图 1 患者Kaplan-Meier生存分析结果 Fig.1 Kaplan-Meier analysis of disease free survival of patients |
2.2.2 不同激素受体状态发生CIN与未发生CIN患者无病生存期比较:
激素受体阳性患者198例,其中CIN患者107例(54%)。激素受体阳性中CIN患者与未发生CIN患者无病生存期比较差异有统计学意义(χ2=9.951,P = 0.002),出现CIN的患者的预后明显好于未出现CIN的患者。见图 1C。激素受体阴性患者中CIN患者与未发生CIN患者无病生存期比较无统计学差异(χ2=0.504,P = 0.478),见图 1D。
2.2.3 不同化疗方案患者的无病生存期比较:结果显示,单用蒽环类组、单用紫杉类组、紫杉类和蒽环类同时应用或序贯应用组CIN患者与未发生CIN患者无病生存期比较均无统计学差异(χ2分别为0.494、0.161、2.809,P分别为0.482、0.688、0.094)。
2.3 其他临床病理学特征与预后的单因素分析结果显示,ER/PR是乳腺癌预后的保护性因素(χ2=4.169,P = 0.041),分期、肿物大小、淋巴结转移均是乳腺癌无病生存期的危险因素(χ2分别为40.731、20.532、47.731,均P < 0.001)。
2.4 Cox回归分析Cox回归分析纳入单因素分析有意义变量(CIN/CIN程度、肿物大小、淋巴结转移、激素受体表达、分期)。结果显示,CIN [Ⅰ~Ⅱ度CIN(P = 0.802,OR = 0.935,95%CI:0.552~1.583)、Ⅲ~Ⅳ度CIN(P = 0.075,OR = 0.502,95%CI:0.234~1.073)]不能作为独立的预后危险因素;ER/PR(P = 0.028,OR = 0.597,95%CI:0.377~0.945)、肿物大小(P = 0.004,OR = 1.755,95%CI:1.202~2.563),淋巴结转移(P = 0.001,OR = 1.754,95%CI:1.275~2.412)均是乳腺癌预后的独立危险因素。
3 讨论一般认为,CIN导致化疗剂量减少或治疗延误,进而影响临床治疗结果[9]。但一些研究[2,4]显示CIN患者的预后更好,这可能与化疗患者的给药剂量、身体耐受性及中性粒细胞在肿瘤中的作用有关[10]。
中性粒细胞是白细胞中含量最高的细胞,在免疫中起着多种关键的作用。传统认为中性粒细胞只在感染和伤害中起作用[11],但最近研究[12]认为中性粒细胞与肿瘤的发生发展有着密切关系。本研究结果显示与未发生CIN患者比较,CIN患者的预后更好(P = 0.044),与之前研究结果一致。亚组分析结果显示,Ⅲ~Ⅳ度CIN患者预后明显好于未发生CIN患者。分析其原因可能是由于单纯通过体表面积计算化疗剂量,使部分患者化疗剂量不足而造成复发及转移;部分患者由于化疗剂量充足甚至过多而出现粒细胞减少等不良反应所致。也可能与中性粒细胞在肿瘤中的潜在作用有关(中性粒细胞可能抑制T细胞功能使肿瘤细胞产生免疫逃避[13],促进肿瘤细胞的增殖、侵袭及血管生成[14])。因此,可以考虑根据是否发生CIN来评估患者化疗剂量是否充足及患者远期治疗效果。
本研究结果显示,在激素受体阳性患者中,发生CIN的预后明显好于未发生CIN者(P = 0.002),而在激素受体阴性患者中,发生CIN与未发生CIN患者无病生存期无统计学差异,与以往研究[15]结果一致。另外,研究[16]显示化疗药物对卵巢具有抑制作用,化疗后出现绝经的患者预后更好。而对于CIN患者,化疗药物可能对卵巢的抑制作用更强,因此激素受体阳性患者中CIN患者预后更好。
有研究[2-4]显示CIN可以作为肿瘤的独立预后因素,与本研究结果不一致。本研究COX回归分析表明,CIN并不能作为乳腺癌预后的独立危险因素,可能由于样本量小所致,提示其可能存在较大差别。虽然目前尚缺乏前瞻性研究来证实CIN是否能作为乳腺癌预后的独立危险因素,但CIN可以作为患者化疗剂量是否充足的参考指标。
本研究尚有许多不足之处:(1)样本量少,随访时间有限;(2)部分患者没有进行FISH检测,无法确定HER-2表达情况,故无法确定患者的分子分型;(3)接受新辅助化疗患者较少,未对辅助及新辅助患者进行比较;(4)可能存在选择性偏倚。
综上所述,CIN提示乳腺癌患者具有更好的预后,在激素受体阳性患者中具有更强的提示作用。未发生CIN患者的化疗剂量是否存在剂量不足,CIN是否能作为乳腺癌的独立预后因素及其能否作为化疗剂量充足的依据,尚需进一步研究来验证。
| [1] |
CRAWFORD J, DALE DC, LYMAN GH. Chemotherapy-induced neutropenia-risks, consequences, and new directions for its management[J]. Cancer, 2004, 100(2): 228-237. DOI:10.1002/cncr.11882 |
| [2] |
MA RM, CHEN CZ, ZHANG W, et al. Prognostic value of chemotherapy-induced neutropenia at the first cycle in invasive breast cancer[J]. Medicine, 2016, 95(13): e3240. DOI:10.1097/MD.0000000000003240 |
| [3] |
ABRAHAM JE, HILLER L, DORLING L, et al. A nested cohort study of 6, 248 early breast cancer patients treated in neoadjuvant and adjuvant chemotherapy trials investigating the prognostic value of chemotherapy-related toxicities[J]. BMC Med, 2015, 13: 306. DOI:10.1186/s12916-015-0547-5 |
| [4] |
OTAKE A, TSUJI D, TAKU K, et al. Chemotherapy-induced neutropenia as a prognostic factor in patients with metastatic pancreatic cancer treated with gemcitabine[J]. Eur J Clin Pharmacol, 2017, 73(8): 1033-1039. DOI:10.1007/s00228-017-2260-0 |
| [5] |
WU CF, ANDZINSKI L, KASNITZ N, et al. The lack of type I interferon induces neutrophil-mediated pre-metastatic niche formation in the mouse lung[J]. Int J Cancer, 2015, 137(4): 837-847. DOI:10.1002/ijc.29444 |
| [6] |
BRUNETTO AT, CARDEN CP, MYERSON J, et al. Modest reductions in dose intensity and drug-induced neutropenia have no major impact on survival of patients with non-small cell lung cancer treated with platinum-doublet chemotherapy[J]. J Thorac Oncol, 2010, 5(9): 1397-1403. DOI:10.1097/Jto.0b013e3181eba7f9 |
| [7] |
GOETZ MP, GRADISHAR WJ, ANDERSON BO, et al. Breast cancer, version 3[J]. J Natl Compr Netw, 2019, 17(2): 118-126. DOI:10.6004/jnccn.2019.0009 |
| [8] |
U.S.DEPARTMENT OF HEALTH AND HUMAN SERVICES. Common terminology criteria for adverse events (CTCAE) version 4.0[M/OL]. (2010-06-14)[2019-04-12]. http://www.meddramsso.com.
|
| [9] |
EXTERMANN M, REICH RR, SEHOVIC M. Chemotoxicity recurrence in older patients:risk factors and effectiveness of preventive strategies-a prospective study[J]. Cancer, 2015, 121(17): 2984-2992. DOI:10.1002/cncr.29423 |
| [10] |
LOTE H, SHARP A, REDANA S, et al. Febrile neutropenia rates according to body mass index and dose capping in women receiving chemotherapy for early breast cancer[J]. Clin Oncol, 2016, 28(9): 597-603. DOI:10.1016/j.clon.2016.02.003 |
| [11] |
KOLACZKOWSKA E, KUBES P. Neutrophil recruitment and function in health and inflammation[J]. Nat Rev Immunol, 2013, 13(3): 159-175. DOI:10.1038/nri3399 |
| [12] |
COFFELT SB, WELLENSTEIN MD, DE VISSER KE. Neutrophils in cancer:neutral no more[J]. Nat Rev Cancer, 2016, 16(7): 431-446. DOI:10.1038/nrc.2016.52 |
| [13] |
CASBON AJ, REYNAUD D, PARK C, et al. Invasive breast cancer reprograms early myeloid differentiation in the bone marrow to generate immunosuppressive neutrophils[J]. Proceed Nat Acad Sci USA, 2015, 112(6): E566-E575. DOI:10.1073/pnas.1424927112 |
| [14] |
HANAHAN D, WEINBERG RA. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [15] |
USARY J, ZHAO W, DARR D, et al. Predicting drug responsiveness in human cancers using genetically engineered mice[J]. Clin Cancer Res, 2013, 19(17): 4889-4899. DOI:10.1158/1078-0432.CCR-13-0522 |
| [16] |
ZHA QB, TANG JH, LI XJ, et al. Prognostic value of chemotherapy-induced amenorrhea in breast cancer:a meta-analysis[J]. Asian Pacific J Cancer Prev, 2015, 16(14): 5939-5944. DOI:10.7314/APJCP.2015.16.14.5939 |
 2019, Vol. 48
2019, Vol. 48