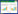文章信息
- 杨旸, 王一喆, 郑春雷, 侯科佐, 王晓楠, 胡雪君
- YANG Yang, WANG Yizhe, ZHENG Chunlei, HOU Kezuo, WANG Xiaonan, HU Xuejun
- 抑制AKT通路对埃克替尼耐药的非小细胞肺癌细胞迁移能力的影响
- Effects of AKT Pathway Inhibition on the Migration Ability of Icotinib-Resistant Non-Small -Cell Lung Cancer Cells
- 中国医科大学学报, 2019, 48(6): 502-506
- Journal of China Medical University, 2019, 48(6): 502-506
-
文章历史
- 收稿日期:2018-05-22
- 网络出版时间:2019-05-24 17:36
2. 中国医科大学附属第一医院肿瘤内科, 辽宁省抗肿瘤药物与生物治疗重点实验室, 沈阳 110001
2. Department of Medical Oncology, Key Laboratory of Anticancer Drugs and Biotherapy of Liaoning Province, The First Hospital, China Medical University, Shenyang 110001, China
研究[1-2]显示,肺癌是对人类健康威胁较大的恶性肿瘤之一,80%~85%的肺癌为非小细胞肺癌(non-small-cell lung cancer,NSCLC);NSCLC发病率及死亡率逐年攀升。NSCLC发现时往往已为晚期,失去了手术治疗机会,靶向治疗已成为晚期NSCLC治疗的主要方法之一。以吉非替尼和厄洛替尼为代表的表皮生长因子受体(epidermal growth factor receptor,EGFR)—酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)已成为EGFR突变型晚期NSCLC的一线治疗药物。EGFR-TKI类药物明显提高EGFR突变的NSCLC患者的生存率,但耐药问题是阻碍患者疗效的最大障碍[3]。肺癌的首要死因是肿瘤细胞侵袭周围组织和远处转移[4],近年来的研究[5]表明,NSCLC发生EGFR-TKI耐药后更易发生远处转移。
既往研究[6]表明接受TKI治疗的细胞耐药后往往更容易发生转移,耐药细胞迁移能力增强与其上皮细胞间质化(epithelial-mesenchymal transition,EMT)表型获得相关,近期研究[7]表明耐药细胞干性表型的增强促进其转移及侵袭,但TKI耐药细胞的转移机制目前尚不十分明确。已有研究[8]表明AKT信号通路活化在介导EGFR激酶抑制剂耐药性方面起关键作用,但其是否促进TKI耐药细胞转移并不十分清楚。埃克替尼是我国第一个拥有自主知识产权的EGFR-TKI,在晚期NLCLC治疗领域发挥良好抗肿瘤作用,目前对于埃克替尼耐药机制尚不十分清楚,2017年有研究[9]表明人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(gene of phosphate and tension homology deleted on chromsome ten,PTEN)水平降低可能与NSCLC细胞对埃克替尼敏感性降低相关,另有研究[10]表明卡斯塔斯B细胞淋巴瘤谱系B-b(casitas B cell lymphoma-b,CBL-b)低表达介导EGFR突变的NSCLC埃克替尼耐药。本研究探讨抑制AKT通路对埃克替尼耐药的NSCLC细胞迁移能力的影响。
1 材料与方法 1.1 材料RPMI1640培养基(美国Gibco公司),EGFR、p-EGFR、Akt、p-Akt(美国Cell Signaling Technology公司),β-actin抗体(美国Santa Cruz公司),LY294002(美国Cell Signaling Technology公司),埃克替尼(浙江贝达药业公司赠予,药物粉末于DEMSO中溶解,贮存浓度为10 mmol/L,-20 ℃保存)。
1.2 细胞培养人肺腺癌细胞株PC9购自中科院上海细胞库,PC9细胞株于5%CO2、37 ℃恒温箱内,在含10%胎牛血清(以色列Biological Industries公司)、1%青霉素和链霉素的RPMI1640培养液中培养,2~3 d传代1次。所有实验均采用对数生长期细胞。
1.3 耐药系建立PC9细胞持续暴露于初始浓度为0.05 μmoL/L的埃克替尼溶液中,并逐渐增加药物浓度,直到药物浓度达到10 μmoL/L。稳定存活于埃克替尼溶液(10 μmoL/L)中的细胞即为耐药细胞(PC9/IcoR)。耐药细胞培养条件:含10%胎牛血清(以色列Biological Industries公司)及1%青霉素和链霉素的RPMI1640培养基置于5%CO2、37 ℃恒温培养箱中,2~3 d传代1次。
1.4 MTT法检测细胞增殖能力取对数生长期的PC9或PC9/IcoR细胞胰酶消化,以3 000/孔接种于96孔板,置于37 ℃、5%CO2孵箱中培养,待细胞贴壁后加入不同浓度的埃克替尼(0.1、1、10、20 μmoL/L),每种药物浓度设置4个复孔,另设4个溶剂复孔作为对照,培养72 h后每孔加入20 μL MTT(5 g/L),继续培养4 h后吸弃上清,每孔加入200 μL二甲基亚砜,震荡15 min。酶标仪检测570 nm波长的吸光度值,计算抑制率。
1.5 Transwell法检测细胞迁移能力采用6.5 mm直径、10 μm厚度、8 μm孔径的聚碳酸酯多孔滤膜(24孔板Transwell小室)。将PC9或PC9/IcoR细胞(3.0×104个)悬浮于无血清RPMI1640培养液(200 μL)中,并种植在小室的上层。下室加入含2.5%血清RPMI1640培养液(500 μL)。埃克替尼、LY294002以及埃克替尼与LY294002联用的耐药细胞药物预处理4 h,分别于上室及下室加入相应浓度的药物。小室于37 ℃、5%CO2孵箱中培养24 h后,清洗并风干,小室膜用瑞士吉姆萨染色法染色固定1 h。清洗晾干后显微镜下观察照相,每个小室随机选取3个视野计数,实验至少重复3次。
1.6 Western blotting检测蛋白表达将细胞冰上裂解,超声离心后取上清,BCA法测定蛋白浓度,并进行聚丙烯酰胺凝胶电泳,湿法转印至硝酸纤维素膜上。5%脱脂牛奶封闭1 h后分别加入稀释好的1抗4 ℃环境过夜,1×PBS洗涤4次,加入二抗封闭40 min,1×PBS洗涤4次后ECL发光试剂盒显色,凝胶成像系统照相,分析灰度值。
1.7 统计学分析采用SPSS 16.0统计软件进行数据分析。所得数据均为3次独立实验结果,采用x±s表示。2组之间比较采用 t 检验,P < 0.05为差异有统计学意义。
2 结果 2.1 埃克替尼对PC9和PC9/IcoR细胞增殖能力影响结果显示,不同浓度(0、0.1、1、10、20 μmol/L)埃克替尼作用于PC9细胞72 h,PC9细胞增殖抑制率分别为0、(15.02±3.14)%、(48.13±1.41)%、(64.89±0.96)%、(78.02±2.68)%;与对照组(0 μmol/L埃克替尼)比较,PC9细胞增殖明显抑制(P < 0.05),其增殖抑制率随浓度增加而升高。不同浓度(0、0.1、1、10、20 μmol/L)埃克替尼作用于PC9/IcoR细胞72 h,PC9/IcoR细胞增殖抑制率分别为0、(2.96±0.32)%、(6.08±1.25)%、(9.19±0.83)%、(28.03±9.51)%;PC9/IcoR细胞增殖在不同浓度埃克替尼药物作用下均未受到明显影响(P > 0.05),提示PC9/IcoR细胞对埃克替尼的敏感性降低。
2.2 PC9和PC9/IcoR细胞迁移能力比较结果显示,穿过聚碳酸酯多孔滤膜的PC9细胞、PC9/IcoR细胞数量分别为132.67±14.57、234.33±22.28,2组比较差异有统计学意义(P < 0.05)。与PC9细胞比较,耐药细胞PC9/IcoR的迁移能力明显增强。见图 1。
|
| A, PC9;B, PC9/IcoR. 图 1 PC9细胞和PC9/IcoR细胞迁移能力的比较瑞氏吉姆萨法×200 Fig.1 Comparison of the migration ability between PC9 cells and PC9/IcoR cell Giemsa staining×200 |
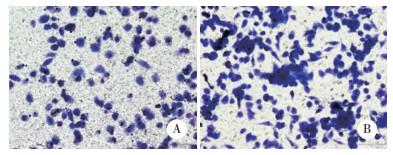
2.3 PC9和PC9/IcoR细胞中相关蛋白表达
Western blotting结果显示,与PC9细胞比较,耐药细胞PC9/IcoR中EGFR和Akt的磷酸化水平均明显升高,提示AKT通路活化可能使耐药细胞迁移能力增强(图 2)。
|
| 1, PC9;2, PC9/IcoR. 图 2 PC9细胞和PC9/IcoR细胞的蛋白表达 Fig.2 Protein expression of PC9 cells and PC9/IcoR cells |
2.4 LY294002对PC9/IcoR细胞AKT通路的影响
AKT通路抑制剂LY294002(20 μmol/L)作用于PC9/IcoR细胞24 h后,Akt磷酸化水平明显降低;LY294002与埃克替尼(20 μmol/L)联合作用24 h后,AKT通路抑制最明显(图 3)。提示20 μmol/L LY294002可显著抑制PC9/IcoR细胞的AKT活化。

|
| 图 3 抑制AKT对PC9/IcoR细胞蛋白表达影响 Fig.3 Protein expression of PC9/IcoR cells after inhibiting AKT |
2.5 抑制AKT通路对PC9/IcoR细胞迁移能力的影响
为探讨AKT活化在PC9/IcoR转移中的作用,AKT通路抑制剂LY294002(20 μmol/L)单独或与埃克替尼(10 μmol/L)联合作用PC9/IcoR细胞24 h后,Transwell法检测细胞迁移能力。结果显示,对照组(单纯PC9/IcoR细胞)、埃克替尼组(埃克替尼+PC9/IcoR细胞)、LY294002组(LY294002+PC9/IcoR细胞)、埃克替尼+ LY294002组(埃克替尼+LY294002+PC9/IcoR细胞)细胞迁移数量分别为234.05±22.61、200.33±20.08、90.45±18.88、19.67±6.42。与对照组比较,埃克替尼组对细胞迁移能力没有明显影响(P > 0.05);LY294002组可明显抑制细胞迁移能力(P < 0.05);埃克替尼+ LY294002组对细胞迁移能力的抑制作用更明显(P < 0.05)。提示AKT通路活化使PC9/IcoR细胞的迁移能力增强。见图 4。

|
| A, PC9/IcoR; B, PC9/IcoR+icotinib; C, PC9/IcoR+LY294002;D, PC9/IcoR+icotinib+LY294002. 图 4 抑制AKT对PC9/IcoR细胞迁移能力影响瑞氏吉姆萨法×200 Fig.4 Effect of AKT inhibition on the migration ablity of PC9/IcoR cells Giemsa staining×200 |
3 讨论
肿瘤转移是一个非常复杂的过程,关于耐药肿瘤细胞的转移机制至今知之甚少,可能与肿瘤微环境改变、细胞内与细胞质基质之间的相互作用、细胞间黏附缺失及肿瘤细胞耐药后干性表型增强有关[11-13]。NSCLC接受EGFR-TKI治疗后发生获得性耐药的细胞系转移及侵袭能力均增强,而且更易获得EMT表型[14]。本研究结果显示,与PC9亲本细胞比较,PC9/IcoR耐药细胞迁移能力明显增强,提示肿瘤细胞的侵袭及远处转移是埃克替尼耐药的特征之一。
PI3K/AKT通路在细胞生长、分化、增殖和转移中发挥不可替代的作用。研究[15]表明,AKT通路活化促进肿瘤细胞侵袭和转移。已有研究[16]显示PI3K/Akt信号通路在乳腺癌和胰腺癌等多种肿瘤的侵袭和转移中均被活化。PI3K/Akt信号通路抑制剂可以抑制肿瘤细胞的转移和侵袭。AKT通路在不同类型的TKI,包括EGFR-TKI的阻力中发挥至关重要的作用。MET扩增、HGF产生和PIK3CA突变均可以阻断TKI类介导的AKT抑制,进而产生EGFR-TKI耐药。在NSCLC中,PI3K/AKT通路异常活化是EGFR-TKI获得性耐药的原因之一[17],在肝癌中PI3K/AKT通路活化介导索拉非尼耐药[18]。单独使用AKT通路抑制剂或与吉非替尼联用已证明可以在体外和体内克服HGF介导的吉非替尼耐药[19]。本研究结果显示,与PC9亲本细胞系比较,PC9/IcoR耐药细胞系中EGFR、AKT等蛋白活化水平明显升高,这一现象与耐药细胞系迁移能力增强变化趋势一致,提示AKT活化可能与迁移相关。用PI3K/AKT通路抑制剂LY294002作用于PC9/IcoR耐药细胞系后,AKT通路活性被抑制同时耐药细胞迁移能力明显降低,且AKT通路抑制剂LY294002联用埃克替尼后PC9/IcoR细胞系迁移能力几乎完全抑制。这些结果均说明阻断AKT信号通路可以逆转埃克替尼耐药细胞的迁移。
综上所述,AKT活化促进PC9/IcoR耐药细胞迁移,抑制AKT通路活性可以抑制埃克替尼耐药的NSCLC细胞的迁移。本研究仅从促进耐药细胞迁移角度阐述AKT通路的作用,并未探讨AKT通路活化对PC9/IcoR耐药细胞增殖、凋亡等方面的作用。关于AKT信号通路在埃克替尼耐药的NSCLC中促进迁移的具体机制、AKT通路对耐药细胞增殖、凋亡等方面的影响以及抑制AKT通路能否逆转埃克替尼耐药将在今后的研究中进一步论证。
| [1] |
SIEGEL R, MA J, ZOU Z, et al. Cancer statistics[J]. CA Cancer J Clin, 2014, 64(1): 9-29. DOI:10.3322/CAAC.21208 |
| [2] |
RECK M, HEIGENER DF, MOK T, et al. Management of non-small-cell lung cancer:recent developments[J]. Lancet, 2013, 382(9893): 709-719. DOI:10.1016/S0140-6736(13),61502-0 |
| [3] |
TAN CS, GILLIGAN D, PACEY S. Treatment approaches for EGFR-inhibitor-resistant patients with non-small-cell lung cancer[J]. Lancet Oncol, 2015, 16(9): 00246-6. DOI:10.1016/S1470-2045(15)00246-6 |
| [4] |
GUPTA GP, MASSAGUE J. Cancer metastasis:building a framework[J]. Cell, 2006, 127(4): 679-695. DOI:10.1016/j.cell.2006.11.001 |
| [5] |
TANG ZH, JIANG XM, GUO X, et al. Characterization of osimertinib (AZD9291) -resistant non-small cell lung cancer NCI-H1975/OSIR cell line[J]. Oncotarget, 2016, 7(49): 81598-81610. DOI:10.18632/oncotarget.13150 |
| [6] |
LI L, GU X, YUE J, et al. Acquisition of EGFR TKI resistance and EMT phenotype is linked with activation of IGF1R/NF-κB pathway in EGFR-mutant NSCLC[J]. Oncotarget, 2017, 8(54): 92240-92253. DOI:10.18632/oncotarget.21170 |
| [7] |
ZHANG F, WANG J, WANG X, et al. CD146-mediated acquisition of stemness phenotype enhances tumour invasion and metastasis after EGFR-TKI resistance in lung cancer[J]. Clin Respir J, 2019, 13(1): 23-33. DOI:10.1111/crj.12976 |
| [8] |
WANG L, DONG X, REN Y, et al. Targeting EHMT2 reverses EGFR-TKI resistance in NSCLC by epigenetically regulating the PTEN/AKT signaling pathway[J]. Cell Death Dis, 2018, 9(2): 129. DOI:10.1038/s41419-017-0120-6 |
| [9] |
ZHAI Y, ZHANG Y, NAN K, et al. Reduced expression levels of PTEN are associated with decreased sensitivity of HCC827 cells to icotinib[J]. Oncol Lett, 2017, 13(5): 3233-3238. DOI:10.3892/ol.2017.5829 |
| [10] |
ZHANG T, ZHENG C, HOU K, et al. Suppressed expression of Cbl-b by NF-κB mediates icotinib resistance in EGFR-mutant non-small-cell lung cancer[J]. Cell Biol Int, 2019, 43(2): 98-107. DOI:10.1002/cbin.11026 |
| [11] |
CHIANG AC, MASSAGUÉ J. Molecular basis of metastasis[J]. N Engl J Med, 2008, 359(26): 2814-2823. DOI:10.1056/NEJMra0805239 |
| [12] |
PRIETO-GARCÍA E, DÍAZ-GARCÍA CV, GARCÍA-RUIZ L, et al. Epithelial-to-mesenchymal transition in tumor progression[J]. Med Oncol, 2017, 34(7): 122. DOI:10.1007/s12032-017-0980-8 |
| [13] |
CHIOU SH, WANG ML, CHOU YT, et al. Coexpression of Oct4 and Nanog enhances malignancy in lung adenocarcinoma by inducing cancer stem cell-like properties and epithelial-mesenchymal transdifferentiation[J]. Cancer Res, 2010, 70(24): 10433-10444. DOI:10.1158/0008-5472.CAN-10-2638 |
| [14] |
BYERS LA, DIAO L, WANG J, et al. An epithelial-mesenchymal transition gene signature predicts resistance to EGFR and PI3K inhibitors and identifies Axl as a therapeutic target for overcoming EGFR inhibitor resistance[J]. Clin Cancer Res, 2013, 19(1): 279-290. DOI:10.1158/1078-0432.CCR-12-1558 |
| [15] |
KING D, YEOMANSON D, BRYANT HE. PI3King the lock:targeting the PI3K/Akt/mTOR pathway as a novel therapeutic strategy in neuroblastoma[J]. J Pediatr Hematol Oncol, 2015, 37(4): 245-251. DOI:10.1097/MPH.0000000000000329 |
| [16] |
YOELI-LERNER M, YIU GK, RABINOVITZ I, et al. Akt blocks breast cancer cell motility and invasion through the transcription factor NFAT[J]. Mol Cell, 2005, 20(4): 539-550. DOI:10.1016/j.molcel.2005.10.033 |
| [17] |
HUANG LH, FU LW. Mechanisms of resistance to EGFR tyrosine kinase inhibitors[J]. Acta Pharm Sini B, 2015, 5(5): 390-401. DOI:10.1016/j.apsb.2015.07.001 |
| [18] |
CHEN KF, CHEN HL, TAI WT, et al. Activation of phosphatidylinositol 3-kinase/Akt signaling pathway mediates acquired resistance to sorafenib in hepatocellular carcinoma cells[J]. J Pharmacol Exp Ther, 2011, 337(1): 155-161. DOI:10.1124/jpet.110.175786 |
| [19] |
DONEV IS, WANG W, YAMADA T, et al. Transient PI3K inhibition induces apoptosis and overcomes HGF-mediated resistance to EGFRTKIs in EGFR mutant lung cancer[J]. Clin Cancer Res, 2011, 17(8): 2260-2269. DOI:10.1158/1078-0432.CCR-10-1993 |
 2019, Vol. 48
2019, Vol. 48