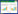文章信息
- 商家炜, 徐振华, 黄克强, 王月, 王志静, 苏荣健
- SHANG Jiawei, XU Zhenhua, HUANG Keqiang, WANG Yue, WANG Zhijing, SU Rongjian
- 抗体封闭细胞表面GRP78抑制厄洛替尼耐药性口腔舌鳞状细胞癌细胞的生长和转移
- Blockade of Cell Surface GRP78 Inhibits the Growth and Metastasis of Erlotinib-Resistant Tongue Squamous Cell Carcinoma Cells
- 中国医科大学学报, 2019, 48(6): 489-494
- Journal of China Medical University, 2019, 48(6): 489-494
-
文章历史
- 收稿日期:2018-09-11
- 网络出版时间:2019-05-27 10:25
2. 锦州医科大学附属第二临床学院口腔科, 辽宁 锦州 121001;
3. 锦州医科大学附属第一临床学院病理科, 辽宁 锦州 121001;
4. 锦州医科大学生命科学研究院, 辽宁 锦州 121001
2. Department of Stomatology, The Second Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China;
3. Department of Pathology, The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China;
4. Institution of Life Science, Jinzhou Medical University, Jinzhou 121001, China
口腔舌鳞状细胞癌(以下简称鳞癌)是口腔颌面部一种常见的恶性肿瘤[1]。由于表皮生长因子受体(epithelial growth factor receptor,EGFR)在口腔肿瘤的发生和进展中起重要作用,以EGFR为靶点的靶向药物如厄洛替尼和吉非替尼用于口腔癌的治疗[2]。虽然取得了一定疗效,但治疗效果并不明显[3]。获得性耐药是厄洛替尼治疗口腔癌效果不佳的重要原因,限制了其临床应用。因此,对厄洛替尼的耐药机制展开研究,探寻新的治疗方法,对于改善口腔癌患者的临床疗效具有重要意义[4]。
近年来随着对葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)研究的不断深入,人们发现肿瘤细胞表面也存在GRP78的表达[5]。细胞表面GRP78作为一种多功能蛋白质,对肿瘤细胞的生长、侵袭和转移等多种生物学特性具有调节作用[6]。有文献[7]报道,细胞表面GRP78通过激活MEK/ERK信号通路促进肿瘤细胞增殖,应用GRP78特异性抗体处理肿瘤细胞,可以有效抑制肿瘤细胞的增殖。本课题组前期研究[8]结果显示,GRP78在肝癌细胞表面过表达,促进肝癌细胞的侵袭。
本研究以厄洛替尼耐药性细胞TCA-8113-ER细胞为实验对象,检测GRP78在耐药性细胞表面的表达。并应用GRP78特异性抗体处理TCA-8113-ER细胞,观察抗体封闭对TCA-8113-ER细胞生长、侵袭和转移的影响,并探讨其是否可以增加TCA-8113-ER细胞对厄洛替尼的反应性,为提高厄洛替尼在口腔癌中的疗效提供新的线索。
1 材料与方法 1.1 材料厄洛替尼耐药性舌鳞癌细胞TCA-8113-ER细胞由锦州医科大学附属第二医院口腔科黄克强教授惠赠,GRP78特异性抗体购于美国Santa Cruz公司。厄洛替尼购于美国Shelleck公司。c-MET、Akt、STAT3和磷酸化c-MET、Akt、STAT3抗体购于美国Cell Signaling公司。AV/PI试剂盒购于中国Biotools公司。Transwell培养板购于美国Corning公司。Matrigel胶购于美国BD公司。HRP标记二抗购自中山公司。Odyssey IRDye800二抗购自北京西美杰科技有限公司。ECL发光试剂购自碧云天公司。
1.2 方法 1.2.1细胞培养:TCA-8113细胞和TCA-8113-ER细胞培养在含10%胎牛血清、1%青霉素和链霉素的DMEM培养基中,37 ℃、5%CO2环境下培养。2~3 d更换1次培养液。
1.2.2MTT实验:将TCA-81130-ER细胞接种于96孔板中(5 000/孔),继续培养12 h使细胞完全贴壁。12 h后,分别加入终浓度为1、2、4、8 µg/mL的GRP78特异性抗体处理细胞48 h。48 h后取出培养板,每孔加入20 µL MTT溶液(5 mg/mL),继续培养3~4 h。终止培养,弃去培养液,每孔加入150 µL DMSO溶解沉淀,于580 nm测定吸光度值,细胞活力值以处理组细胞吸光度值/对照组细胞吸光度值的百分数表示。为了检测GRP78特异性抗体对TCA-8113-ER细胞对厄洛替尼反应性的影响,GRP78特异性抗体(2 µg/mL)处理细胞24 h后,加入厄洛替尼(10 µmol/L)继续处理48 h,检测联合应用GRP78特异性抗体和厄洛替尼对TCA-8113-ER细胞活力的影响。实验分组:对照组(DMSO处理),厄洛替尼处理组,抗体处理组(GRP78特异性抗体处理),联合处理组(GRP78特异性抗体和厄洛替尼联合处理)。
1.2.3克隆形成实验:将TCA-81130-ER细胞接种于6孔板中(5 000/孔),继续培养24 h,使细胞完全贴壁、伸展。每孔加入GRP78特异性抗体(2 µg/mL)处理细胞,每3 d更换1次培养液,重新加入GRP78特异性抗体(2 µg/mL)继续处理细胞。2周后终止培养,用0.1%的结晶紫对细胞进行染色,倒置显微镜观察细胞生长情况并拍照,并应用DMSO溶解结晶紫,于490 nm测定吸光度值。
1.2.4Transwell实验:实验前应用Matrigel胶包裹上层小室聚碳酸酯膜(8 µmol/L)。将TCA-8113-ER细胞用无血清培养液悬浮接种于24孔Transwell培养板的上层小室内(10 000/孔),同时加入GRP78特异性抗体(2 µg/mL),下层小室内加入完全培养液。培养24 h后,取出上层小室,用酒精棉球擦拭上层小室内表面,上层小室外表面为迁移细胞。0.1%结晶紫染色,倒置显微镜下随机选取5个视野,计数每高倍视野上层小室外表面细胞数,以穿过细胞数代表细胞的侵袭能力。对照组用同型IgG处理。
1.2.5创口愈合实验:将6孔板的底面应用10%纤黏连蛋白包被。待细胞融合成单层后,用灭菌的100 µL移液器头划痕,PBS漂洗3次,洗去悬浮细胞。加入1 mL含有2 µg/mL GRP78特异性抗体的无血清培养液,继续培养。24 h后取出培养板,倒置显微镜下观察创口愈合情况。对照组用同型IgG处理。
1.2.6流式细胞术分析:将TCA-8113-ER细胞接种于6孔板中,待细胞密度达到90%时,对细胞进行处理。分为对照组(溶剂处理)、厄洛替尼处理组(采用厄洛替尼处理,终浓度10 µg/mL)、抗体处理组(GRP78特异性抗体,终浓度2 µg/mL)、联合处理组(GRP78特异性抗体处理24 h后,用厄洛替尼继续处理48 h,浓度同前)4组。AV/PI染色,流式细胞术分析细胞凋亡情况。
1.2.7Western blotting:将GRP78特异性抗体处理的TCA-8113-ER细胞用RIPA缓冲液(1% NP-40、0.5%脱氧胆酸钠、1% SDS、0.1% PMSF)裂解,BCA法定量,SDS-PAGE电泳,转膜,1%胎牛血清蛋白封闭,一抗(1:1 000稀释)4 ℃杂交过夜,PBST洗膜后加入HRP标记的二抗室温温育1 h,ECL显色。
1.2.8in-cell western实验:将TCA-8113-ER细胞接种于96孔板,待细胞生长至90%左右用4%甲醛固定,5% BSA封闭1.5 h,一抗(1:200稀释)4 ℃杂交过夜,PBST清洗后加入Odyssey IRDye800二抗室温避光温育1 h,Odyssey近红外双荧光系统扫描。
1.3 统计学分析采用SPPS 17.0软件进行统计分析,多组样品间的比较采用单因素方差分析,2组样品间的比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 GRP78特异性抗体抑制TCA-8113-ER细胞的生长in-cell western实验结果(图 1A)显示,GRP78在厄洛替尼耐药性舌鳞癌细胞TCA-8113-ER细胞表面高水平表达。MTT实验结果显示,各浓度的GRP78特异性抗体均对TCA-8113-ER细胞的生长具有抑制作用,当抗体浓度达到2 µg/mL时明显抑制细胞生长(P < 0.05),继续增加抗体浓度,抑制作用增加不明显(资料未显示)。克隆形成实验结果(图 1B)显示,应用GRP78特异性抗体(2 µg/mL)处理细胞,可以明显抑制细胞生长,差异有统计学意义(P < 0.05)。

|
| A, cell surface GRP78 expression in TCA-8113-ER cells analyzed by in-cell western assay; B, long term effect of GRP78-specific antibody on TCA-8113-ER cell growth assessed by colony formation assay. 图 1 GRP78特异性抗体抑制厄洛替尼耐药性舌鳞癌细胞的生长 Fig.1 GRP78-specific antibody inhibits the growth of erlotinib-resistant tongue squamous cell carcinoma cells |
2.2 GRP78特异性抗体抑制TCA-8113-ER细胞的侵袭和转移
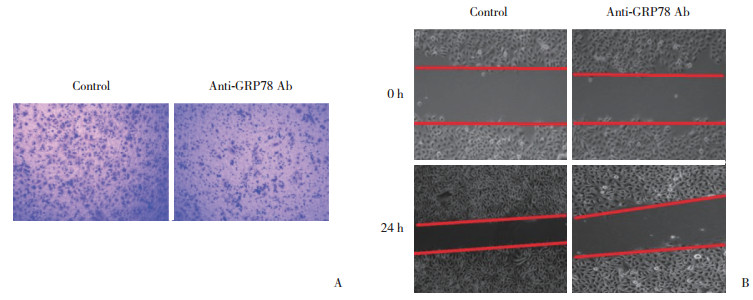
Transwell实验结果(图 2A)表明,对照组每低倍视野中细胞数约为20个,抗体处理组为73个,GRP78特异性抗体可以明显抑制TCA-8113-ER细胞的侵袭(P < 0.05)。创口愈合实验结果(图 2B)显示,对照组创口愈合率为34%,抗体处理组为63%,GRP78特异性抗体对TCA-8113-ER细胞的迁移具有抑制作用(P < 0.05)。
|
| A, effect of GRP78-specific antibody on the invasiveness of TCA-8113-ER cells evaluated by transwell analysis; B, effect of GRP78-specific antibody on the migration of TCA-8113-ER cells evaluated by scratch wound healing assay. 图 2 GRP78特异性抗体抑制厄洛替尼耐药性舌鳞癌细胞的侵袭和迁移×100 Fig.2 GRP78-specific antibody inhibits the invasiveness and migration of erlotinib-resistant tongue squamous cell carcinoma cells ×100 |
2.3 GRP78特异性抗体增强TCA-8113-ER细胞对厄洛替尼的反应性
MTT实验结果(图 3A)表明,与对照组相比,厄洛替尼处理组细胞活力为0.85,抗体处理组为0.68,联合处理组为0.39,与单独应用GRP78特异性抗体(2 µg/mL)或厄洛替尼相比,二者联合应用可以在短期内抑制TCA-8113-ER细胞的生长,差异有统计学意义(P < 0.05)。克隆形成实验结果(图 3B)显示,联合应用GRP78特异性抗体(2 µg/mL)和厄洛替尼(10 µmol/L)处理细胞,可以在一个较长时期内明显抑制TCA-8113-ER细胞生长,差异有统计学意义(P < 0.05)。

|
| A, short term effect of GRP78-specific antibody on the efficacy of erlotinib treatment assessed by MTT assay; B, long term effect of GRP78-specific antibody on the efficacy of erlotinib treatment assessed by colony formation assay. *P < 0.05 vs erlotinib group; #P < 0.05 vs anti-GRP78 Ab group. 图 3 GRP78特异性抗体增强厄洛替尼耐药性舌鳞癌细胞对药物的反应性 Fig.3 GRP78-specific antibody suppresses the drug resistance of erlotinib-resistant tongue squamous cell carcinoma cells |
2.4 GRP78特异性抗体促进TCA-8113-ER细胞凋亡
流式细胞术分析结果(图 4)显示,与对照组相比,厄洛替尼处理组细胞凋亡率为15.1%,抗体处理组为21.3%,联合处理组为43.2%,与单独应用厄洛替尼和GRP78特异性抗体相比,二者联合应用可以明显促进细胞凋亡。

|
| 图 4 GRP78特异性抗体促进厄洛替尼耐药性舌鳞癌细胞细胞凋亡 Fig.4 GRP78 antibody promotes the apoptosis of erlotinib-resistant tongue squamous cell carcinoma cells |
2.5 GRP78特异性抗体抑制c-MET、AKT和STAT3
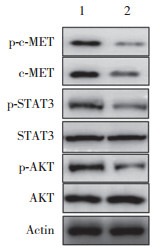
Western blotting结果(图 5)显示,在GRP78特异性抗体处理的TCA-8113-ER细胞中,c-MET、p-c-MET、p-AKT和p-STAT3的表达水平明显低于未处理细胞,AKT和STAT3的表达变化不明显。
|
| 1, control group; 2, anti-GRP78 Ab group. 图 5 GRP78特异性抗体抑制c-MET、STAT3和AKT的磷酸化和表达 Fig.5 Inhibition of the phosphorylation states and expression levels of c-MET, STAT3, and AKT by GRP78-specific antibody |
3 讨论
舌鳞癌细胞对EGFR抑制物抵抗,极大制约了以EGFR为靶点的治疗方法在临床上的应用。因此,增加舌鳞癌细胞对EGFR为靶点的治疗药物的反应性是一个急需解决的问题。
细胞表面GRP78可以发挥受体样作用,对细胞的增殖、侵袭、转移和耐药性形成等生物学特性发挥关键的调节作用,是肿瘤治疗的一个潜在靶点[9]。研究[10]显示应用抗体封闭细胞表面GRP78对肺癌、前列腺癌等肿瘤细胞增殖具有明显的抑制作用。本研究结果显示,GRP78在厄洛替尼耐药性舌鳞癌细胞表面高水平表达,这一结果提示细胞表面GRP78可能与舌鳞癌对EGFR抑制物的耐药性形成有关。本研究应用GRP78特异性抗体处理TCA-8113-ER细胞,发现抗体封闭可以明显抑制其增殖,增加其对厄洛替尼的反应性,这些结果提示GRP78特异性抗体对厄洛替尼耐药性舌鳞癌可能具有治疗作用。
本研究进一步观察了GRP78特异性抗体对TCA-8113-ER细胞侵袭和转移的影响,结果显示,GRP78特异性抗体处理可以抑制TCA-8113-ER细胞的侵袭和迁移,进一步证实了GRP78特异性抗体对厄洛替尼耐药性舌鳞癌具有治疗作用。
最后,本研究探讨了GRP78特异性抗体抑制厄洛替尼耐药性舌鳞癌细胞增殖、侵袭和转移的分子机制。许多研究[11]证实c-MET在肿瘤的增殖、侵袭和转移过程中发挥关键的调节作用。本研究检测了GRP78特异性抗体是否抑制c-MET信号通路,结果发现GRP78特异性抗体明显抑制c-MET的磷酸化和表达,进一步研究发现GRP78特异性抗体可以抑制c-MET下游分子STAT3的磷酸化,而对其表达没有影响[12]。
综上所述,抑制细胞表面GRP78可以抑制厄洛替尼耐药性舌鳞癌细胞的增殖、侵袭和转移,增强其对厄洛替尼的敏感性,为提高临床上以EGFR为靶点的治疗方案的疗效提供了新的线索。但本研究的实验结果局限于细胞水平,尚需在实验动物水平进一步进行验证。另外,本研究结果显示c-MET信号通路抑制与细胞对厄洛替尼的敏感性有关,但尚缺乏直接证据。以后的工作中将继续展开深入的研究,以期进一步证实细胞表面GRP78作为对EGFR抑制物耐药的舌鳞癌细胞的治疗价值和潜在的机制。
| [1] |
WARNAKULASURIYA S. Global epidemiology of oral and oropharyngeal cancer[J]. Oral Oncol, 2009, 45(4/5): 309-316. DOI:10.1016/j.oraloncology.2008.06.002 |
| [2] |
SANO D, MYERS JN. Metastasis of squamous cell carcinoma of the oral tongue[J]. Cancer Metastasis Rev, 2007, 26(3/4): 645-662. DOI:10.1007/s10555-007-9082-y |
| [3] |
WANGSA D, CHOWDHURY SA, RYOTT M, et al. Phylogenetic analysis of multiple FISH markers in oral tongue squamous cell carcinoma suggests that a diverse distribution of copy number changes is associated with poor prognosis[J]. Int J Cancer, 2016, 138(1): 98-109. DOI:10.1002/ijc.29691.2015.8.28 |
| [4] |
HUANG K, LIU D. Targeting non-canonical autophagy overcomes erlotinib resistance in tongue cancer[J]. Tumour, 2016, 37(7): 9625-9633. DOI:10.1007/s13277-015-4689-z.2016.1.21 |
| [5] |
VENUGOPAL S, CHEN M, LIAO W, et al. Isthmin is a novel vascular permeability inducer that functions through cell-surface GRP78-mediated Src activation[J]. Cardiovasc Res, 2015, 107(1): 131-142. DOI:10.1093/cvr/cvv142.2015.5.6 |
| [6] |
KAMIL M, HAQUE E, IRFAN S, et al. ER chaperone GRP78 regulates autophagy by modulation of p53 localization[J]. Front Biosci (Elite Ed), 2017, 9: 54-66. |
| [7] |
LOUESSARD M, BARDOU I, LEMARCHAND E, et al. Activation of cell surface GRP78 decreases endoplasmic reticulum stress and neuronal death[J]. Cell Death Differ, 2017, 24(9): 1518-1529. DOI:10.1038/cdd.2017.35.2017.6.23 |
| [8] |
MACHIHARA K, TANAKA H, HAYASHI Y, et al. Questiomycin A stimulates sorafenib-induced cell death via suppression of glucose-regulated protein 78[J]. Biochem Biophys Res Commun, 2017, 492(1): 33-40. DOI:10.1016/j.bbrc.2017.08.042.2017.8.12 |
| [9] |
YIN Y, CHEN C, CHEN J, et al. Cell surface GRP78 facilitates hepatoma cells proliferation and migration by activating IGF-IR[J]. Cell Signal, 2017, 35: 154-162. DOI:10.1016/j.cellsig.2017.04.003.2017.4.4 |
| [10] |
KELBER JA, PANOPOULOS AD, SHANI G, et al. Blockade of Cripto binding to cell surface GRP78 inhibits oncogenic Cripto signaling via MAPK/PI3K and Smad2/3 pathways[J]. Oncogene, 2009, 28(24): 2324-2336. DOI:10.1038/onc.2009.97.2009.5.4 |
| [11] |
DING X, JI J, JIANG J, et al. HGF-mediated crosstalk between cancer-associated fibroblasts and MET-unamplified gastric cancer cells activates coordinated tumorigenesis and metastasis[J]. Cell Death Dis, 2018, 9(9): 867. DOI:10.1038/s41419-018-0922-1 |
| [12] |
RUI L, GU Y, HE W, et al. Secreted GRP78 activates EGFR-SRC-STAT3 signaling and confers the resistance to sorafeinib in HCC cells[J]. Oncotarget, 2017, 8(12): 19354-19364. DOI:10.18632/oncotarget.15223 |
 2019, Vol. 48
2019, Vol. 48