文章信息
- 高培蓉, 张震
- 超声联合CT诊断家族性甲状腺微小乳头状癌的价值
- The Value of the Combination of Ultrasound and Computed Tomography in the Diagnosis of Familial Papillary Thyroid Microcarcinoma
- 中国医科大学学报, 2019, 48(5): 472-475
- Journal of China Medical University, 2019, 48(5): 472-475
-
文章历史
- 收稿日期:2018-11-06
- 网络出版时间:2019-05-13 9:54
甲状腺乳头状癌是最常见的甲状腺癌,约占甲状腺癌80%以上[1],其中最常见的亚型为甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)。PTMC是指直径≤1.0 cm的甲状腺乳头状癌,在所有新发的甲状腺乳头状癌中约有50%为PTMC,其中女性发病率显著高于男性。
家族性甲状腺乳头状癌是指一级亲属中有2例或2例以上甲状腺乳头状癌的患者[2],其发病率约占甲状腺恶性肿瘤的5%~15%。家族性PTMC的致病原因与散发性PTMC相同,只是具有一定的家族聚集现象,其中主要由遗传和环境两大因素导致[3]。此外,长期的高碘饮食、促甲状腺激素的刺激作用、性激素水平失调等也发挥一定的作用。但家族性PTMC更具侵袭性,局部复发和颈部淋巴结转移也较单病灶甲状腺微小癌更为常见,影像学恶性特征更为隐匿,对术式和预后有较大影响。
在PTMC的影像学检查方法中,超声诊断PTMC的准确率、灵敏度和特异度分别为94.62%、92.11%和96.36%[4],并且因其具有无创性、经济性、无辐射等优点而最为常用。形态不规则、低回声、纵横比 > 1及砂粒样微钙化对PTMC的诊断具有较高的价值[5]。64排CT能够明显提高PTMC颈部淋巴结转移的检出率,高频超声联合64排螺旋CT的诊断准确率明显高于单用任何一种[6],因此这2种影像学检查在诊断PTMC时最为常用。本文通过回顾性分析同一家族内3例PTMC中的影像学表现,探讨PTMC家族史对预判甲状腺结节良恶性的价值,为进一步提高家族性PTMC的诊断率提供参考和依据。
1 材料与方法 1.1 患者一般情况收集2017年2月于我院体检发现并入院治疗的3例家族性PTMC患者的病历资料。3例患者分别为母亲(病例1)、女儿(病例2)和儿子(病例3),男:女=1:2,年龄39~63岁,平均年龄(47.6±10.9)岁。3例患者均长期居住于辽宁省海城市。患者术前均进行超声和CT检查。
1.2 PTMC诊断标准 1.2.1 超声诊断标准超声诊断甲状腺结节的标准参考甲状腺影像报告与数据系统(thyroid imaging reporting and data system,TI-RADS)分级,TI-RADS是在乳腺影像报告与数据系统分级基础上提出的,根据结节的大小、形态、边界、内部回声、后方回声、血供等进行分类。我院分级标准参考詹维伟等[7]建立的TI-RADS分级诊断标准。1级:正常甲状腺;2级:良性结节,恶性风险0%;3级:良性可能性大,恶性风险≤5%;4级:可疑结节,包括4a级(低度恶性风险 > 5%~20%,具有1个恶性特征)、4b级(中度恶性风险 > 20%~50%,具有2个恶性特征)、4c级(高度恶性风险 > 50%~90%,具有3~4个恶性特征);5级:恶性风险 > 90%,具有5~6个恶性特征或结节发现时已有颈部淋巴结转移;6级:恶性结节,已得到病理证实。我院临床工作中把TI-RADS 2、3、4a级评判为偏良性病变,TI-RADS 4b、4c、5级评判为偏恶性病变。
1.2.2 CT诊断标准边缘模糊的实性结节、钙化(尤其是砂粒样微钙化)、强化明显(仍低于邻近甲状腺组织),增强后显示病灶范围减小、中心结节状强化及周边密度较低,包膜侵犯,可能出现多发病灶及淋巴结转移,以上1种或多种征象提示甲状腺癌。
2 结果 2.1 二维超声3例患者术前超声检查(图 1)均观察到实性低回声或稍低回声结节。均位于腺体中部,2例位于左侧,1例位于右侧。边缘清晰2例,欠清晰1例,伴有不同程度的不典型微钙化及粗大钙化。1例病灶纵横比 > 1,2例病灶纵横比 < 1。TI-RADS分级为4a 1例,4b 2例。见表 1。

|
| A,病例1;B,病例2;C,病例3. 图 1 3例家族性PTMC患者的超声图像 |
| 超声表现 | 病例1 | 病例2 | 病例3 |
| 部位 | 左叶中部偏峡部 | 右叶中部偏后 | 左叶上极中部血管后方 |
| 大小(mm) | 10.6×6.5×8.2 | 12.6×7.6×8.0 | 5.1×5.6×4.6 |
| 结构与回声 | 实性低回声 | 实性稍低回声 | 实性低回声 |
| 纵横比 | <1(6.5 mm/8.2 mm) | <1(7.6 mm/8.0 mm) | >1(5.6 mm/4.6 mm) |
| 边缘 | 尚清晰 | 欠清楚 | 尚清晰 |
| 微钙化 | 不典型微钙化 | 彗尾样钙化及不典型微钙化 | 粗大钙化及微钙化堆积,密度较大 |
| 血流 | 少许点条样血流 | 边缘及内部可见多处条状血流显示 | 散在点条样血流显示 |
| TI-RADS分级 | 4b | 4a | 4b |
2.2 平扫与增强CT
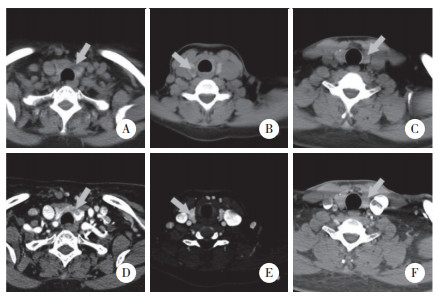
3例患者术前CT检查(图 2)均观察到甲状腺类圆形低密度影,2例边缘模糊伴弱强化,1例边缘清晰伴明显强化。1例显示点状钙化,其余2例未显示钙化。2例提示恶性,1例提示良性。
|
| A,病例1平扫CT;B,病例2平扫CT;C,病例3平扫CT;D,病例1增强CT;E,病例2增强CT;F,病例3增强CT. 图 2 3例家族性PTMC患者的平扫及增强CT |
2.3 术式及病理
3例患者均进行患侧全切伴患侧Ⅵ区淋巴结清扫术。病例2术中发现伴有LR6(1/5)淋巴结转移,故同时行对侧部分切除术。术后病理(图 3)显示肿瘤直径均≤1.0 cm,且均证实为PTMC。见表 2。

|
| A,病例1,甲状腺左叶肿物,局灶癌细胞呈乳头状,核呈毛玻璃样,核沟可见;B,病例2,甲状腺右叶肿物,局部异型细胞呈乳头状排列,细胞排列较拥挤,核大,呈毛玻璃样;C,病例3,甲状腺左叶肿物,癌细胞呈乳头状排列,细胞排列较拥挤,核大,核轮廓粗糙,呈毛玻璃样. 图 3 3例家族性PTMC患者的病理结果HE染色×100 |
| 术式及病理 | 病例1 | 病例2 | 病例3 |
| 病理标本大小(mm) | 10.0 | 8.0 | 4.0 |
| 手术方式 | 甲状腺左叶及峡部全切、左侧Ⅵ区淋巴结清扫术 | 甲状腺右叶及峡部全切、右侧Ⅵ区淋巴结清扫术 | 甲状腺右叶部分切、左叶及峡部全切、左侧Ⅵ区淋巴结清扫术 |
| 病理结果 | (左叶肿物1)微小乳头状癌,(左叶肿物2)结节性甲状腺肿 | (右叶)结节性甲状腺肿伴微小乳头状癌,(右叶)结节性甲状腺肿,(右叶)结节性甲状腺肿伴微小乳头状癌,LR6(1/5)淋巴结转移癌 | (左叶肿物1)微小乳头状癌,(左叶肿物2)结节性甲状腺肿 |
| 术后诊断 | PTMC(T1aN0M0,Ⅰ期,低危组)伴结节性甲状腺肿 | PTMC(T1aN1aM0,Ⅰ期,中危组)伴结节性甲状腺肿 | PTMC(T1aN0M0,Ⅰ期,低危组)伴结节性甲状腺肿 |
3 讨论
本文3例家族性PTMC患者的影像学特点为实性低回声结节,纵横比 > 1,砂砾样微钙化,形态不规则,边界不清等。
PTMC病理学特征与内部回声具有相关性,本组3例PTMC患者均表现为低回声是由于癌细胞体积较大,分化程度低,间质成分重叠少,透声较好,在声像图中无法形成强烈的反射界面。纵横比 > 1是一种与肿瘤生长方式相关的指标,在肿瘤早期,前后方向的癌细胞大多增殖较左右方向更活跃,导致肿瘤前后径大于左右径。微钙化指直径 < 1 mm的钙化,是由于癌组织生长过快,营养供应不足导致细胞凋亡、坏死所产生的钙盐沉积。有研究[8]发现,PTMC中微钙化率高达78.43%,微钙化诊断PTMC特异性高于90%。形态不规则、边界不清晰则是由于癌组织向周围组织迁移、侵袭的能力不同,形成癌组织与周围组织的过渡带。
本组3例PTMC患者术前超声及CT检查中,2例超声诊断为TI-RADS 4b级,为中度可疑恶性。对应的CT表现为结节状低密度影,边界模糊,增强扫描强化欠均匀,呈弱强化,其内点状钙化等特点,提示怀疑恶性。超声和CT均发现2例恶性结节影像学特征性表现,诊断较为精准,术后病理证实2例均为PTMC。
1例PTMC术前误诊,超声诊断为TI-RADS 4a级,即低度可疑恶性,并且CT检查强化明显,诊断为腺瘤样结节,2种检查均提示为良性。术后病理证实为PTMC伴颈部中央区淋巴结转移。误诊的可能原因:(1)结节内部伴彗尾状微钙化,彗尾状微钙化是甲状腺良性结节在超声图像中的特征表现;(2)结节后方无衰减,说明结节硬度较小,与恶性结节特征不相符;(3)结节边缘及内部可见多处条状血流,CT增强扫描强化明显,在2017年美国TI-RADS分级标准中,彩色血流未被纳入诊断标准;(4)PTMC多与桥本氏甲状腺炎、结节性甲状腺肿同时存在,在超声检测中常存在声像重叠现象;(5)检查者没有足够重视患者的家族史,单从结节本身的特性判断其良恶性质,从而降低可疑结节的恶性程度;(6)超声和CT诊断小结节本身存在难度,PTMC体积过小,诊断更加困难;(7)家族性PTMC影像学特征更加隐匿,诊断更加困难。因此,有必要对家族性PTMC影像学特征进行补充。
3例病例包括母亲及其子、女,符合MUSHOLT[2]提出的家族性PTMC的诊断。其中1例误诊病例在术前就已发生颈部淋巴结转移,提示家族性甲状腺癌比散发性甲状腺癌具有更强的侵袭性,更容易出现早期淋巴结转移和复发[9]。相比母亲确诊PTMC时的年龄,子女的确诊年龄明显提前。且母亲与女儿甲状腺为单发结节,儿子为多发结节,这与PARK等[10]和高健等[11]研究结果一致,即家族性非髓样甲状腺癌患者第二代比第一代确诊年龄更早,且更容易出现多癌灶及中央区淋巴结转移。这提示在PTMC影像学诊断中应该重视家族史的询问及筛查,临床工作中对类似患者的术式选择也具有指导意义。
因此,家族史或可以作为超声及CT判断甲状腺恶性结节的一项指标,以提高具有家族史PTMC患者的检出率,为家族性PTMC患者的早期诊断和治疗提供依据。当患者具有PTMC家族史、结节本身没有恶性特征而提示TI-RADS 3级时,可考虑升级为TI-RADS 4a级;当结节本身有一项恶性特征而符合TI-RADS 4a级的诊断时,可考虑升级为TI-RADS 4b级,以此类推。
大量临床病例证实,甲状腺乳头状癌淋巴结转移不影响患者的存活率,但转移淋巴结可显著增加术后的局部复发率。本组3例患者目前仍在随访,至今未发现复发和淋巴结转移,预后良好,说明家族性PTMC可用单例PTMC的术式进行替代治疗。
综上所述,由于家族性PTMC更具隐匿性和侵袭性,在影像学诊断PTMC时,需结合患者的家族史等“隐性”特征,将其纳入TI-RADS分级的恶性风险评估中,TI-RADS分级为3级及以下的患者如无症状无须治疗,超声定期复查即可,TI-RADS分级4级及以上的患者,需结合超声造影或甲状腺细针穿刺术等检查以明确诊断,尽可能避免误诊和漏诊,进一步提高家族性PTMC的早期诊断率,这对家族性PTMC的术式和预后也具有一定的指导意义。
| [1] |
LEE J, SONG Y, SOH EY, et al. Central lymph node metastasis is an important prognostic factor in patients with papillary thyroid microcarcinoma[J]. J Korean Med Sci, 2014, 29(1): 48-52. DOI:10.3346/jkms.2014.29.1.48 |
| [2] |
MUSHOLT TJ, MUSHOLT PB, PETRICH T, et al. Familial papillary thyroid carcinoma:genetics, criteria for diagnosis, clinical features, and surgical treatment[J]. World J Surg, 2000, 24(11): 1409-1417. DOI:10.1007/s002680010233 |
| [3] |
KLEIN HESSELINK EN, LINKS TP. Radioiodine treatment and thyroid hormone suppression therapy for differentiated thyroid carcinoma:adverse effects support the trend toward less aggressive treatment for low-risk patients[J]. Eur Thyroid J, 2015, 4(2): 82-92. DOI:10.1159/000432397 |
| [4] |
刘永玲, 周艳丽, 白麟鹏, 等. 甲状腺微小乳头状癌超声诊断价值与临床病理对照[J]. 当代医学, 2017, 23(23): 125-127. DOI:10.3969/j.issn.1009-4393.2017.23.054 |
| [5] |
GU WJ, YAN HX, LUO YK, et al. Characterization of papillary thyroid microcarcinomas using sonographic features in malignant papillary thyroid cancer:a retrospective analysis[J]. Medicine(Baltimore), 2015, 94(21): e841. DOI:10.1097/md.0000000000000841 |
| [6] |
曹萌, 刘军, 姚永忠. 64排螺旋CT联合高频彩超在甲状腺微小乳头状癌诊断中的临床应用[J]. 中国煤炭工业医学杂志, 2015, 18(5): 784-787. DOI:10.11723/mtgyyx1007-9564201505029 |
| [7] |
詹维伟, 王文涵. 甲状腺结节的超声诊断价值[J]. 中国普外基础与临床杂志, 2014, 21(9): 1061-1065. DOI:10.7507/1007-9424.20140256 |
| [8] |
杨柳芳, 翁丽明, 黄晓明. 超声诊断甲状腺微小乳头状癌与微小结节性甲状腺肿的价值[J]. 医疗装备, 2018, 31(4): 45-46. DOI:10.3969/j.issn.1002-2376.2018.04.032 |
| [9] |
WANG X, CHENG W, LI J, et al. Endocrine tumours:familial nonmedullary thyroid carcinoma is a more aggressive disease:a systematic review and meta-analysis[J]. Eur J Endocrinol, 2015, 172(6): R253-R262. DOI:10.1530/eje-14-0960 |
| [10] |
PARK YJ, AHN HY, CHOI HS, et al. The long-term outcomes of the second generation of familial nonmedullary thyroid carcinoma are more aggressive than sporadic cases[J]. Thyroid, 2012, 22(4): 356-362. DOI:10.1089/thy.2011.0163 |
| [11] |
高健, 于洋, 李小龙, 等. 家族性甲状腺非髓样癌的临床特征分析[J]. 中华肿瘤杂志, 2014, 36(3): 202-206. DOI:10.3760/cma.j.issn.0253-3766.2014.03.010 |
 2019, Vol. 48
2019, Vol. 48