文章信息
- 巴方, 陈学云, 刘洪亮
- BA Fang, CHEN Xueyun, LIU Hongliang
- 白藜芦醇通过影响细胞外信号调节蛋白激酶信号通路对创伤性脑损伤后的神经保护作用
- Neuroprotective Effect of Resveratrol via the Extracellular Signal-Regulated Kinase Signaling Pathway after Traumatic Brain Injury
- 中国医科大学学报, 2019, 48(5): 402-405
- Journal of China Medical University, 2019, 48(5): 402-405
-
文章历史
- 收稿日期:2018-08-29
- 网络出版时间:2019-05-13 11:30
创伤性脑损伤是一种比较常见的神经损伤,其致死、致残率较高,给患者、家庭和社会造成极大的痛苦和经济负担。严重的脑损伤不仅可以引起直接和即时的神经元损伤,还可能导致长期和逐渐演变的后遗症,如神经胶质细胞过度活化和某些信号分子通路的活化,最终阻碍神经功能的恢复[1]。近年来发现,白藜芦醇具有脑保护作用,但其具体作用机制尚不清晰。本课题组前期研究[2]结果显示,白藜芦醇对小鼠创伤性脑损伤后的神经保护作用与改善损伤导致的星形胶质细胞活化表达有关。细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路家族中的重要成员之一。中枢神经损伤时,MAPK家族信号通路被激活,表达上调。研究[3]发现,ERK信号通路作为MAPK家族的重要成员之一,在损伤后迅速发生活化,而且这种活化可以持续一段时间,抑制ERK信号通路的持续活化,可以使损伤结果发生决定性改变。并且研究[4]显示,脑损伤后ERK信号通路的活化表达参与星形胶质细胞的增殖活化过程,但白藜芦醇对脑损伤后ERK信号通路在星形胶质细胞中活化表达的影响,即白藜芦醇对脑损伤后的神经保护作用机制是否与ERK信号通路在星形胶质细胞中的活化有关,尚不清楚。本研究通过建立小鼠创伤性脑损伤模型,给予白藜芦醇治疗后,观察其对脑损伤的神经保护作用,并进一步检测白藜芦醇对ERK信号通路在星形胶质细胞中活化表达的影响,探讨其神经保护的作用机制。
1 材料与方法 1.1 实验动物选取96只8周龄雄性昆明小鼠,SPF级,体质量25~30 g,购于中国医科大学实验动物中心,使用许可证号SYXK(辽)2013-0007。将小鼠随机分为假手术组(n = 16)、DMSO组(n = 40)和白藜芦醇预处理组(n = 40)。
1.2 创伤性脑损伤模型的建立小鼠黑质纹状体通路损伤模型的制备参考KAWANO等[5]的方法。简述之,经10%水合氯醛(30 mg/kg)腹腔注射麻醉后,将小鼠固定于脑立体定位仪上。消毒,头皮切开,暴露颅骨,去除表面的硬脑膜,在前囟点右后方1.5 mm、右侧颅骨中线外侧0.5 mm处,用骨钻在颅骨钻一适合刀口大小的缺口,暴露大脑。将已固定好的宽度约2.0 mm的切刀调整至大脑表面位置,缓慢进刀至距离大脑表面深度为5.5 mm,停留大约3~5 s,缓慢拔出刀片,止血缝合。假手术组仅暴露颅骨。
1.3 给药处理及取材假手术组不做任何给药处理。将白藜芦醇溶解于DMSO中,并用0.1 mmol/L的PBS稀释,最终制备浓度为0.3 μg/μL(其中DMSO浓度 < 1%),白藜芦醇预处理组损伤前1 d侧脑室给药3 µL。DMSO组在损伤前1 d侧脑室给予相同剂量含PBS的DMSO溶液。
损伤后4 d进行取材。10%水合氯醛腹腔麻醉(30 mg/kg),固定四肢,消毒后打开腹腔,剪破膈肌,暴露心脏,经左心室插管,先以常温的含有肝素的生理盐水将血液冲洗干净,然后用4%冰冷的多聚甲醛进行灌注。待固定后断头取脑组织,经冰冷的4%多聚甲醛后固定后,用30%蔗糖溶液预处理。用冰冻切片机在-25 ℃条件下制成10 µm厚水平位脑组织切片,以备FJC染色使用。部分动物在生理盐水灌注后不经多聚甲醛固定,直接取新鲜脑组织-80℃保存,以备Western blotting检测。
1.4 FJC染色FJC染色是近年来新兴的一种神经元染色方法,这种染料对损伤变性的神经元有很高的亲和力,标记后可以对损伤神经元进行定性定量分析。简述之,取-20 ℃保存的冰冻切片室温复温15~30 min左右,浸泡在蒸馏水中2 min,转浸入含1% NaOH的80%乙醇中5 min,然后在70%乙醇中浸洗2 min,经蒸馏水浸洗2 min后在0.06%高锰酸钾中反应10 min;蒸馏水浸洗2 min;用0.1%乙酸配制0.000 1% Fluoro-Jade C工作液,现配现用,反应20 min;蒸馏水浸洗3 min;将切片烘干,二甲苯透明后,用PBS或者抗荧光淬灭剂进行封片。荧光显微镜下观察并拍照保存。
FJC染色用于检测纹状体神经元细胞的凋亡情况。在10个不重叠切片中,在920 µm×860 µm的面积内计数FJC阳性细胞总数,FJC阳性细胞数(µm-2)=FJC阳性细胞总数/面积。
1.5 免疫组织化学荧光染色组织切片取出后室温复温15~30 min,0.01 mol/L PBS漂洗3次,每次5 min。0.2% Triton进行透膜处理10 min,PBS漂洗,5%牛血清白蛋白在37 ℃下封闭30 min,加入GFAP抗体(1:500)和p-ERK抗体(1:100)4 ℃孵育过夜。第2天取出室温复温30 min,PBS漂洗3次,每次5 min。配制荧光二抗cy3溶液(1:200),避光37 ℃恒温条件下孵育1 h,PBS漂洗3次,每次10 min,注意避光。抗荧光淬灭剂封片并晾干后,荧光显微镜下观察拍照。GFAP阳性细胞表达红色荧光,所得图片应用Photoshop软件进行处理。
免疫组织化学荧光染色用于检测ERK信号通路在星形胶质细胞中的活化表达情况。在10个不重叠切片中,在920 µm×860 µm的面积内计数p-ERK和GFAP共表达阳性细胞总数,p-ERK和GFAP共表达阳性细胞数(µm-2)=p-ERK和GFAP共表达阳性细胞总数/面积。
1.6 统计学分析数据用
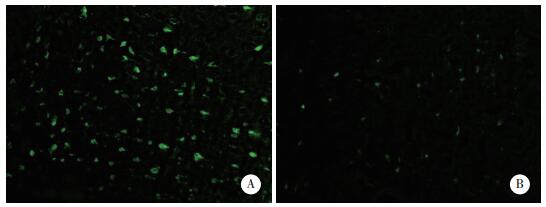
为了探究白藜芦醇对脑损伤后纹状体神经元的影响,对黑质纹状体通路损伤后4 d的小鼠大脑做水平位切片,进行FJC染色。对一定面积的FJC阳性细胞(图片中的绿色荧光信号)进行计数。结果显示,假手术组FJC染色几乎没有阳性细胞表达(图片未显示);损伤后,DMSO组和白藜芦醇预处理组FJC阳性细胞数分别为(39.2±6.9)和(26.4±5.0)/µm2,与DMSO组相比,白藜芦醇预处理组FJC阳性细胞数明显减少(P = 0.006)。见图 1。
|
| A, DMSO group; B, resveratrol pretreatment group. 图 1 脑损伤后DMSO组和白藜芦醇预处理组纹状体神经元的凋亡×20 Fig.1 Striatal neuronal apoptosis in DMSO and resveratrol pretreatment groups after brain injury ×20 |
2.2 白藜芦醇对脑损伤后ERK信号通路活化的影响
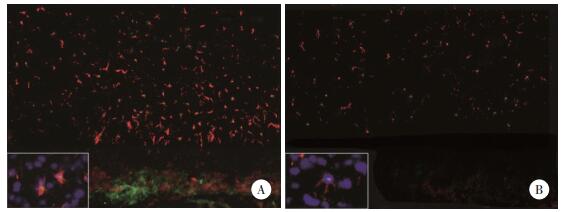
为了进一步探究白藜芦醇对脑损伤后神经保护的作用机制,检测脑损伤后白藜芦醇对ERK信号通路在星形胶质细胞中活化表达的影响。结果显示,假手术组p-ERK染色几乎没有阳性细胞表达(图片未显示);脑损伤后p-ERK可定位表达在星形胶质细胞中,DMSO组和白藜芦醇预处理组p-ERK和GFAP(星形胶质细胞标志蛋白)共表达阳性细胞数分别为(27.4±6.2)和(16.5±4.9)/µm2,与DMSO组相比,白藜芦醇预处理组中p-ERK和GFAP共表达阳性细胞数明显减少(P < 0.01),见图 2。其中p-ERK阳性细胞为绿色荧光信号,GFAP阳性细胞为红色荧光信号,DAPI染色为蓝色荧光信号。
|
| A, DMSO group; B, resveratrol pretreatment group. 图 2 脑损伤周围p-ERK和GFAP的免疫荧光染色×20 Fig.2 Immunofluorescence staining for p-ERK and GFAP around the lesion site ×20 |
3 讨论
创伤性脑损伤后数小时可以观察到巨噬细胞、小胶质细胞迁移到损伤区,产生大量毒性细胞因子和氧自由基,导致继发的兴奋性毒性脑损伤。随着研究的不断深入,人们发现中枢神经损伤后比周围神经难以修复,原因之一是中枢神经有不利于神经再生的微环境,尤其是胶质细胞在阻碍神经损伤修复的过程中扮演了重要角色[6-7]。因此,损伤后胶质细胞的变化与中枢神经可塑性之间的关系尤为重要。本课题组前期研究[8]发现,损伤后星形胶质细胞发生增殖活化,并在周围形成胶质界膜,从而阻碍了损伤后神经轴突的修复和再生。星形胶质细胞形成的胶质瘢痕被认为是中枢神经系统损伤后阻碍神经元再生的物理屏障,星形胶质细胞过度增殖活化产生多种促炎性细胞因子,如白细胞介素-1β、白细胞介素-6和肿瘤坏死因子-α,这些炎性细胞因子的过量表达通过正反馈作用进一步加剧了胶质细胞的活化,并加重神经元损伤,抑制其修复和再生[9-10]。
研究[11]发现,脑损伤后MAPK家族的主要成员ERK发生活化并高表达,而抑制ERK信号通路的高表达可以改善脑损伤造成的神经损伤。虽然已经证实了ERK信号通路的活化参与各种体外和体内损伤的模型,但其活化在星形胶质细胞活化中的作用尚无明确的定位。本课题组前期研究[4]结果证实,脑损伤后ERK信号通路参与星形胶质细胞和小胶质细胞的增殖活化表达,且抑制ERK信号通路在2种胶质细胞中的活化,可以改善星形胶质细胞和小胶质细胞的增殖活化表达,并对损伤后神经功能恢复具有一定的促进作用。
虽然已有文献报道了在体外细胞培养实验中白藜芦醇的神经保护作用与ERK信号通路活化有关,但在体内两者的相互关联及作用鲜有报道[12]。本研究应用白藜芦醇预处理,可以减少FJC染色阳性细胞数,从而达到抑制纹状体神经元凋亡的效果;检测脑损伤后ERK信号通路在星形胶质细胞中的活化表达,为进一步探究白藜芦醇在脑损伤中的神经保护作用机制提供了理论依据。但白藜芦醇通过何种途径影响ERK信号通路的活化表达,有待进一步的研究。
| [1] |
LI D, LIU N, ZHAO HH, et al. Interactions between Sirt1 and MAPKs regulate astrocyte activation induced by brain injury in vitro and in vivo[J]. J Neuroinflammation, 2017, 14(1): 67. DOI:10.1186/s12974-017-0841-6 |
| [2] |
MARTINEZ-LUCAS P, MORENO-CUESTA J, GARCIA-OLMO DC, et al. Relationship between the Arg72Pro polymorphism of p53 and outcome for patients with traumatic brain injury[J]. Intensive Care Med, 2005, 31(9): 1168-1173. DOI:10.1007/s00134-005-2715-0 |
| [3] |
LI D, TONG L, KAWANO H, et al. Regulation and role of ERK phosphorylation in glial cells following a nigrostriatal pathway injury[J]. Brain Res, 2016, 1648(Pt A): 90-100. DOI:10.1016/j.brainres.2016.07.008 |
| [4] |
LI D, LIU N, ZHAO L, et al. Protective effect of resveratrol against nigrostriatal pathway injury in striatum via JNK pathway[J]. Brain Res, 2017, 1654(Pt A): 1-8. DOI:10.1016/j.brainres.2016.10.013 |
| [5] |
KAWANO H, LI HP, SANGO K, et al. Inhibition of collagen synthesis overrides the age-related failure of regeneration of nigrostriatal dopaminergic axons[J]. J Neurosci Res, 2005, 80(2): 191-202. DOI:10.1002/jnr.20441 |
| [6] |
CREGG JM, DEPAUL MA, FILOUS AR, et al. Functional regeneration beyond the glial scar[J]. Exp Neurol, 2014, 253: 197-207. DOI:10.1016/j.expneurol.2013.12.024 |
| [7] |
LI D, TONG L, KAWANO H, et al. Protective effects of batroxobin on a nigrostriatal pathway injury in mice[J]. Brain Res Bull, 2016, 127: 195-201. DOI:10.1016/j.brainresbull.2016.09.014 |
| [8] |
CHEN CC, HUNG TH, LEE CY, et al. Berberine protects against neuronal damage via suppression of glia-mediated inflammation in traumatic brain injury[J]. PloS One, 2014, 9(12): e115694. DOI:10.1371/journal.pone.0115694 |
| [9] |
STICOZZI C, BELMONTE G, MEINI A, et al. IL-1β induces GFAP expression in vitro and in vivo and protects neurons from traumatic injury-associated apoptosis in rat brain striatum via NFκB/Ca2+-calmodulin/ERK mitogen-activated protein kinase signaling pathway[J]. Neuroscience, 2013, 252: 367-383. DOI:10.1016/j.neuroscience.2013.07.061 |
| [10] |
ARMSTEAD WM, RILEY J, CINES DB, et al. tPA contributes to impairment of ATP and Ca sensitive K channel mediated cerebrovasodilation after hypoxia/ischemia through upregulation of ERK MAPK[J]. Brain Res, 2011, 1376: 88-93. DOI:10.1016/j.brainres.2010.12.052 |
| [11] |
MORRIS-BLANCO KC, COHAN CH, NEUMANN JT, et al. Protein kinase C epsilon regulates mitochondrial pools of Nampt and NAD following resveratrol and ischemic preconditioning in the rat cortex[J]. J Cereb Blood Flow Metab, 2014, 34(6): 1024-1032. DOI:10.1038/jcbfm.2014.51 |
| [12] |
PARK SJ, AHMAD F, PHILP A, et al. Resveratrol ameliorates aging-related metabolic phenotypes by inhibiting cAMP phosphodiesterases[J]. Cell, 2012, 148(3): 421-433. DOI:10.1016/j.cell.2012.01.017 |
 2019, Vol. 48
2019, Vol. 48