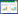文章信息
- 王子文, 刘兆玉
- WANG Ziwen, LIU Zhaoyu
- miR-510通过打靶c-MYC抑制肝细胞癌的发展
- miR-510 Inhibits the Development of Hepatocellular Carcinoma by Targeting c-MYC
- 中国医科大学学报, 2019, 48(4): 300-304
- Journal of China Medical University, 2019, 48(4): 300-304
-
文章历史
- 收稿日期:2018-06-28
- 网络出版时间:2019-04-15 11:27
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的原发性肿瘤,是全世界范围内癌症相关死亡的主要原因之一。目前手术切除和肝脏移植是治疗HCC最为有效的方式,但这仅限于早期肿瘤,而且肝脏移植受肝捐赠者的限制导致可操作性不强[1-2]。针对RAF/VEGFR/PDGFR通路的多激酶抑制剂Sorafenib是目前美国食品和药物管理局(Food and Drug Administration,FDA)批准的唯一用于肝癌治疗的药物,然而它在改善患者存活时间方面的功效还比较有限[3]。因此,寻找新的能够识别HCC的治疗靶点极其必要。
微小RNA(microRNA,miRNA)是进化保守的非编码小RNA,通过与靶基因的3’UTR区结合,导致mRNA的降解或mRNA翻译的抑制,从而调控基因的转录和翻译。miRNA已被证明是多种肿瘤的关键调节因子,根据其靶基因的生物学功能,可以发挥致癌基因或抑癌基因的作用[4]。研究表明,多种miRNA在肝癌标本中存在异常表达,并通过调节细胞增殖、生存和侵袭性等调节肝细胞癌的进程。因此,推测某些miRNA可能成为治疗HCC的潜在的新靶点[5-6]。miR-510已经被证明在多种肿瘤中存在异常表达的现象,但是目前尚未见其在HCC中表达情况的报道。
c-MYC癌基因的过度表达是HCC中的常见事件,研究证明c-MYC可以通过调节AKT/mTOR和RAS/MAPK等信号通路促进HCC的进程。本研究拟探讨miR-510在HCC中的表达情况及其与c-MYC的关系,旨在研究miR-510对HCC的调节作用。
1 材料与方法 1.1 材料HCC衍生内皮细胞HepG2(中科院典藏细胞库);DMEM培养基、胎牛血清(天津市灏洋生物制品科技有限责任公司);miR-510拟似物、miR-510抑制物(广州锐博生物科技有限公司);CCK-8试剂盒、台盼蓝[生工生物工程(上海)股份有限公司];c-MYC、GAPDH及相应二抗(Santa Cruz Biotechnology公司,美国)。
1.2 方法 1.2.1 标本来源选取我院由2014年至2018年收治的30位HCC患者作为研究对象。患者年龄47~73岁,平均60.12岁,男21例,女性9例。在获得患者知情同意后,留取肝癌组织及癌旁组织,并保存于液氮中备用。
1.2.2 芯片筛选委托沈阳汇佰生物有限公司对肝癌组织及癌旁组织进行miRNA分析。采用Mynasy试剂盒(QiAGEN,上海尚耀生物技术有限公司)从冷冻组织中提取总RNA,用于NTROR miRNA平台检测。所有样品制备和杂交均按照说明书进行操作。
1.2.3 实时PCR用Qiazol reagent和Mynasi-Mini试剂盒(QiAGEN,上海尚耀生物技术有限公司)从冷冻组织中分离总RNA。使用TaqMan microRNA反转录试剂盒(QiAGEN,上海尚耀生物技术有限公司)合成特定miRNA的cDNA,并进行实时PCR。miR-510的正向引物序列为5’-CTTCCATACTCAGGAGAGTGGC-3’,反向引物序列为5’-TATCGTTGTACTCCAGACCAAGAC-3’。U6用于内参对照,正向引物5’-CGCGCTTCGGCAGCACATATACT-3’,反向引物5’-AC GCTTCACGAATTTGCGTGTC-3’。c-MYC正向引物5’-TGCTGCCAAGAGGGTCAAGT-3’,反向引物5’-TC AGCCAAGGTTGTG-3’;GAPDH正向引物5’-CGGAG TCAACGGATTTGGTCGTAT-3’,反向引物5’-AGCCT TCTCCATGGTGGTGAAGAC-3’。反应条件为95 ℃ 10 min,95 ℃ 10 s、60℃ 20 s、72℃ 20 s 40个循环。所有实验重复3次。
1.2.4 细胞培养用含10 %胎牛血清的DMEM培养基,在37 ℃、5%CO2条件下培养人HCC细胞系HepG2。
1.2.5 荧光素酶报告实验在96孔板中培养HepG2细胞至贴壁后,使用lipo2000转染50 ng pluc-3’UTR(c-MYC WT,即野生型,及c-MYC MUT,即突变了c-MYC与miR-510结合位点的突变型)、10 ng Renilla luciferase plasmid和5 pmol miR-510拟似物或阴性对照转染。孵育48 h后,使用双荧光素酶报告基因检测系统(PROMEGA,北京索莱宝科技有限公司)检测荧光素酶活性。
1.2.6 CCK-8实验在96孔板中接种1×103个转染细胞,分别于接种后0、12、24、36和48 h添加CCK-8(10 μL/孔)。37 ℃孵育2 h后,在450 nm处检测吸光度。
1.2.7 Transwell实验在24孔板中转染细胞24 h后,将5×104个细胞悬浮在200 μL无血清DMEM培养基中,接种至Transwell上室中。加入600 μL含有10%胎牛血清的DMEM。在5%CO2、37 ℃孵箱中孵育8 h后,用含有0.4%台盼蓝和20%甲醇的染料溶液染色固定细胞,200倍显微镜下观察。
1.2.8 Western blotting细胞转染24 h后,裂解细胞,提取蛋白,用10% SDS-PAGE分离蛋白,转移至硝酸纤维素膜,5%脱脂奶粉封闭1 h,c-MYC(1:1 000)或GAPDH(1:10 000)抗体4 ℃孵育过夜,洗膜,对应二抗室温孵育2 h,再次洗膜,ECL发光。
1.3 统计学分析采用SPSS 17.0软件进行统计学分析。采用t检验,比较肝癌组织与癌旁组织的miRNA分布情况。P < 0.05为差异有统计学意义。
2 结果 2.1 miR-510在HCC中低表达芯片分析结果显示,有10种miRNA在HCC中异常表达,其中miR-510在癌组织中的表达远远低于在癌旁组织中的表达,下降约76.27倍,差异有统计学意义(P < 0.001),见图 1。

|
| 图 1 多种miRNA在肝细胞癌与癌旁组织中存在差异性表达 Fig.1 Differential expression of miRNAs in hepatocellular carcinoma and adjacent tissue |
实时PCR结果显示,miR-510的表达在HCC癌组织中显著下调,与对照组相比差异有统计学意义(P = 0.019),见图 2。
|
| * P < 0.05 vs adjacent tissue. 图 2 miR-510在HCC癌组织与癌旁组织中的表达 Fig.2 The expression of miR-510 in hepatocellular carcinoma and adjacent tissue |
2.2 miR-510靶向作用于c-MYC
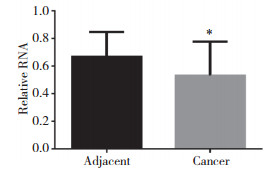
miRDB软件预测分析发现,miR-510与c-MYC具有结合位点。报告基因实验指出,miR-510能够抑制c-MYC的活性,但是如果突变了两者的结合位点,则该抑制作用消失,结果见图 3。
|
| A, there were binding sites between miR-510 and c-MYC; B, miR-510 can direct target c-MYC. ** P < 0.05 vs control. 图 3 miR-510可以直接打靶c-MYC Fig.3 miR-510 can directly target c-MYC |
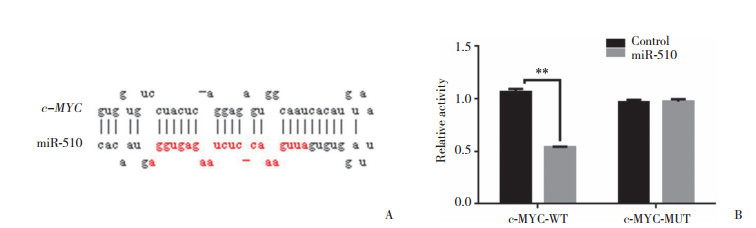
Western blotting结果显示,HepG2细胞中miR-510过表达可以显著抑制c-MYC的表达,而当miR-510受到抑制后c-MYC的表达水平上升,见图 4。
|
| A, the expression of c-MYC was inhibited by miR-510; B, the expression of c-MYC was promoted after miR-510 was inhibited. 图 4 Western blotting检测miR-510对HepG2细胞中c-MYC蛋白表达的影响 Fig.4 The expression of c-MYC in HepG2 after treated by miR-510 or miR-510 inhibitor detected by Western blotting |
2.3 miR-510对HepG2增殖和迁移的影响
MTT结果显示,miR-510过表达后,HepG2细胞的增殖受到显著抑制;反之,miR-510表达下调则能够促进HepG2细胞的增殖,见图 5。
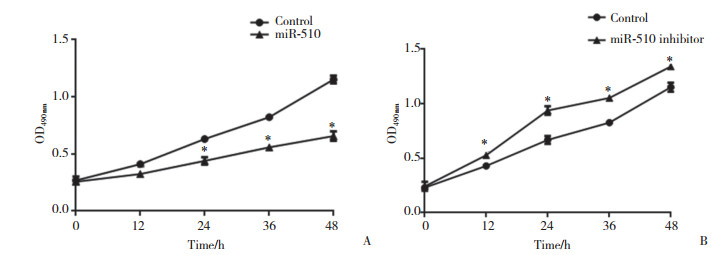
|
| A, the proliferation of HepG2 cells was inhibited by miR-510; B, the proliferation of HepG2 cells was promoted after miR-510 was inhibited. * P < 0.05 vs control. 图 5 miR-510对HepG2细胞增殖的影响 Fig.5 Effect of miR-510 on the proliferation of HepG2 cells |
Transwell结果显示,miR-510过表达可抑制HepG2的迁移,miR-510表达下调则能促进HepG2细胞的迁移,见图 6。
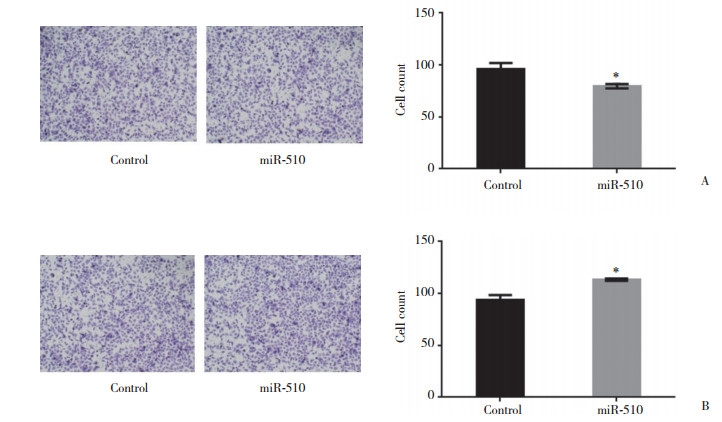
|
| A, the migration of HepG2 was inhibited by miR-510; B, the migration of HepG2 was promoted after miR-510 was inhibited. * P < 0.05 vs control. 图 6 miR-510对HepG2细胞迁移的影响 ×200 Fig.6 Effect of miR-510 on migration of HepG2 ×200 |
3 讨论
越来越多的证据表明,各种肿瘤抑制因子的丢失和细胞生长信号的异常调控,如ERK/MAPK、Wnt/β-catenin和c-MYC/Akt/ras等通路的异常,都与肝肿瘤发生有关[7-8],但HCC的分子发病机制目前仍知之甚少。
近年来,miRNA的异常调控已被认为与肝癌发生发展密切相关。在肝癌中已经发现多种miRNA存在异常表达的现象,这些miRNA调控的靶基因可能是致癌基因或者抑癌基因,因此不同miRNA在肝癌中发挥的作用也不尽相同[9]。miR-29、miR-21和miR-221可以通过影响肝癌细胞中癌基因的表达,调节某些信号通路的过度激活,从而参与调节肿瘤细胞的生长、凋亡、迁移和侵袭[10-11]。本研究通过基因芯片技术分析了HCC与癌旁组织中miRNA的表达情况,结果发现8个差异性表达明显的miRNA,其中miR-510在HCC中下调的现象最为显著。
研究[12]发现miR-510可以抑制肾细胞癌及胃癌的发生发展。虽然在乳腺癌中miR-510发挥癌基因还是抑癌基因的作用目前仍存在争议[13]。但是本研究在30对肝癌和癌旁组织中发现,miR-510的下调显著,而且miR-510可以与癌基因c-MYC的3’UTR区域靶向结合,因此推断miR-510在HCC中可能发挥抑癌基因的作用。
本研究发现,miR-510在肝癌组织中的表达低于癌旁组织,且miR-510与c-MYC具有结合位点。在HCC细胞中miR-510可以通过靶向作用抑制c-MYC的生物学活性与蛋白表达。本研究还发现,miR-510过表达可以发挥抑制HCC增殖和迁移的作用,而当miR-510表达下调时,肝癌细胞的增殖和迁移能力则得到促进。
本研究通过生物学软件预测发现,miR-510可以打靶HCC中高表达的c-MYC,且miR-510的表达与c-MYC的表达呈负相关。
本研究分别通过荧光素酶报告基因实验和Western blotting实验证明了miR-510过表达可以抑制c-MYC的表达,当miR-510表达下调时,c-MYC的表达水平增高。
c-MYC在HCC的生长与迁移中发挥重要作用,miR-510也被证明可以通过影响多种信号通路的转导作用抑制多种肿瘤细胞的生长和迁移。本研究随后在HepG2细胞中分别过表达miR-510或抑制miR-510表达,并通过MTT和Transwell实验检测了miR-510对于细胞增殖和迁移的影响。结果表明,miR-510可以抑制HepG2的增殖和迁移。
综上所述,本研究发现miR-510可以通过抑制c-MYC蛋白的表达来实现抑制HCC细胞增殖和迁移的作用,为HCC的治疗提供了新的方向。
| [1] |
LI C, MIAO R, ZHANG J, et al. Long non-coding RNA KCNQ1OT1 mediates the growth of hepatocellular carcinoma by functioning as a competing endogenous RNA of miR-504[J]. Int J Oncol, 2018, 4313: 1603-1612. DOI:10.3892/ijo.2018.4313 |
| [2] |
WU J, ZHOU X, FAN Y, et al. Long non-coding RNA 00312 downregulates cyclin B1 and inhibits hepatocellular carcinoma cell proliferation in vitro and in vivo[J]. Biochem Biophys Res Commun, 2018, 497(1): 173-180. DOI:10.1016/j.bbrc.2018.02.049 |
| [3] |
FARBER BA, LALAZAR G, SIMON EP, et al. Non coding RNA analysis in fibrolamellar hepatocellular carcinoma[J]. Oncotarget, 2017, 9(12): 10211-10227. DOI:10.18632/oncotarget.23325 |
| [4] |
HALGAND B, DESTERKE C, RIVIERE L, et al. Hepatitis B Virus pregenomic rna in hepatocellular carcinoma:a nosological and prognostic determinant[J]. Hepatology, 2018, 67(1): 86-96. DOI:10.1002/hep.29463 |
| [5] |
JIANG W, WEN D, GONG L, et al. Circular RNA hsa_circ_0000673 promotes hepatocellular carcinoma malignance by decreasing miR-767-3p targeting SET[J]. Biochem Biophys Res Commun, 2018, 500(2): 211-216. DOI:10.1016/j.bbrc.2018.04.041 |
| [6] |
WANG H, MA P, LIU P, et al. Small nucleolar RNA U2_19 promotes hepatocellular carcinoma progression by regulating Wnt/beta-catenin signaling[J]. Biochem Biophys Res Commun, 2018, 500(2): 351-356. DOI:10.1016/j.bbrc.2018.04.074 |
| [7] |
BIRGANI MT, HAJJARI M, SHAHRISA A, et al. Long non-coding RNA SNHG6 as a potential biomarker for hepatocellular carcinoma[J]. Pathol Oncol Res, 2018, 24(2): 329-337. DOI:10.1007/s12253-017-0241-3 |
| [8] |
CHEN H, YANG F, LI X, et al. Long noncoding RNA LNC473 inhibits the ubiquitination of survivin via association with USP9X and enhances cell proliferation and invasion in hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun, 2018, 499(3): 702-710. DOI:10.1016/j.bbrc.2018.03.215 |
| [9] |
LI SG, SHI QW, YUAN LY, et al. C-Myc-dependent repression of two oncogenic miRNA clusters contributes to triptolide-induced cell death in hepatocellular carcinoma cells[J]. J Exp Clin Cancer Res, 2018, 37(1): 51. DOI:10.1186/s13046-018-0698-2 |
| [10] |
XU JH, CHANG WH, FU HW, et al. The mRNA, miRNA and lncRNA networks in hepatocellular carcinoma:an integrative transcriptomic analysis from gene expression omnibus[J]. Mol Med Rep, 2018, 17(5): 6472-6482. DOI:10.3892/mmr.2018.8694 |
| [11] |
RASHAD NM, EL-SHAL AS, SHALABY SM, et al. Serum miRNA-27a and miRNA-18b as potential predictive biomarkers of hepatitis C virus-associated hepatocellular carcinoma[J]. Mol Cell Biochem, 2018, 447(1/2): 125-136. DOI:10.1007/s11010-018-3298-8 |
| [12] |
GAJ P, ZAGOZDZON R. In silico analysis of microRNA-510 as a potential oncomir in human breast cancer[J]. Breast Cancer Res, 2014, 16(2): 403. DOI:10.1186/bcr3624 |
| [13] |
GUO QJ, MILLS JN, BANDURRAGA SG, et al. MicroRNA-510 promotes cell and tumor growth by targeting peroxiredoxin1 in breast cancer[J]. Breast Cancer Res, 2013, 15(4): R70. DOI:10.1186/bcr3464 |
 2019, Vol. 48
2019, Vol. 48