文章信息
- 刘刚, 周建平, 李新, 董明
- LIU Gang, ZHOU Jianping, LI Xin, DONG Ming
- EGCG促进AOM/DSS诱导小鼠结直肠腺瘤生成
- EGCG Promotes the Production of Colorectal Adenoma Induced by AOM/DSS in Mice
- 中国医科大学学报, 2019, 48(3): 255-259
- Journal of China Medical University, 2019, 48(3): 255-259
-
文章历史
- 收稿日期:2018-06-14
- 网络出版时间:2019-2-28 10:39
结直肠癌(colorectal cancer,CRC)是全球第三大常见癌症,每年约有120万新发病例,约有60万人死于该病[1]。炎性肠病包括克罗恩病和溃疡性结肠炎,主要以慢性肠道炎症为特征,常常导致腹痛、腹泻和便血[2]。结肠炎相关性结肠癌在炎性肠病患者中具有较高的发病率,这类肿瘤不同于无炎症结肠中散发肿瘤,其死亡率更高[3]。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是儿茶素的一种,近期有研究[4]显示EGCG具有抑制CRC细胞增殖的作用,WUBETU等[5]的一项研究显示,EGCG能够通过抑制p-AKT、Nek2蛋白活性,调节AKT通路诱导结肠癌细胞死亡,而GUAN等[6]的研究证实EGCG并无抗肿瘤作用,而且高剂量的EGCG还会促进肿瘤发生。高毒致癌物氧化偶氮甲烷(azoxymethane,AOM)联合致炎剂葡聚糖硫酸钠(dextran sulfate sodium,DSS)构建小鼠溃疡性结肠炎模型或结肠炎相关性CRC模型已有报道[7-8]。本研究通过AOM/DSS方式在短时间内诱导小鼠结直肠肿瘤生成,并给予EGCG干预,观察其对小鼠肿瘤发生的影响,进一步通过免疫组化检测AOM/DSS和AOM/DSS+EGCG处理的小鼠结直肠组织中CD31和CD68的表达,并探讨EGCG在结直肠肿瘤发生过程中的作用。
1 材料与方法 1.1 实验动物30只5周龄雌性BALB/c小鼠(北京维通利华实验动物技术有限公司)于中国医科大学实验动物部隔离检疫,适应性饲养1周。饲养环境:温度(25±2)℃;湿度(50±5)%;照明12 h、黑暗12 h交替。将小鼠随机分为对照组、AOM/DSS组和AOM/DSS+EGCG组,每组10只。
1.2 实验材料AOM(美国Sigma公司);DSS(美国MP生物医学公司);EGCG(上海麦克林生化科技有限公司);CD31抗体(英国Abcam公司);CD68抗体(美国NOVUS公司);即用型免疫组化超敏试剂盒、柠檬酸组织抗原修复液以及PBS磷酸盐缓冲液(福州迈新生物技术开发有限公司)。
1.3 实验方法 1.3.1 动物模型的建立实验起始时AOM/DSS组和AOM/DSS+EGCG组小鼠腹腔注射0.1% AOM(10 mg/kg),对照组小鼠腹腔注射生理盐水(10 mg/kg)。普通饮用水饲养1周;第2周AOM/DSS组和AOM/DSS+EGCG组小鼠给予2% DSS饮用水喂养;第3、4周AOM/DSS+EGCG组小鼠给予0.01% EGCG饮用水喂养,AOM/DSS组用普通饮用水喂养。AOM/DSS组以1周DSS+2周普通饮用水为一个循环,AOM/DSS+EGCG组小鼠以1周DSS+2周EGCG为一个循环,每组重复3个循环后继续普通饮用水喂养3周。对照组不做处理,全程普通饮用水喂养。实验起始后每天观察小鼠摄食量、饮水量、生命状态和死亡情况,每周记录小鼠体质量变化。
1.3.2 标本采集和诊断第13周末将3组小鼠以CO2法处死,解剖分离小鼠回盲部至肛门整条肠管,延纵轴剖开,观察肠黏膜损伤程度和肿瘤生成情况,记录息肉及肿瘤的数量及大小。取材大肠后置于10%福尔马林溶液中固定,常规石蜡包埋,切片,HE染色。组织学改变由专业病理学医生诊断。
1.3.3 免疫组织化学采用SP法,将组织切片常规脱蜡和水化,柠檬酸抗原组织修复液高压修复,内源性过氧化物酶阻断剂室温孵育20 min,动物非免疫血清室温孵育20 min,滴加鼠抗人CD68单克隆抗体或鼠抗人CD31抗体,4 ℃过夜后酶标二抗室温孵育1 h,链霉菌抗生素蛋白-过氧化物酶室温孵育1 h后DAB法显色,苏木素复染,盐酸乙醇分化,自来水反蓝,乙醇脱水,封片。
1.3.4 微血管密度(microvessel density,MVD)和巨噬细胞计数由CD31染成棕黄色的单个内皮细胞或内皮细胞簇,可以被认为是单独的血管。按照WEIDNER[9]报道的方法,在3个随机高倍视野中检查每个区域微血管的最大数量,取其平均值即为MVD,MVD可间接反映CD31的表达情况。CD68主要表达在巨噬细胞的细胞质中,CD68阳性的巨噬细胞呈棕褐色,在5个随机的高倍视野中计数,取其平均值作为最终巨噬细胞数,可以用巨噬细胞的数量反映CD68的表达情况。
1.4 统计学分析采用SPSS 13.0软件进行分析,计量资料的比较采用单因素方差分析,计数资料的比较采用χ2检验。P < 0.05为差异有统计学意义。
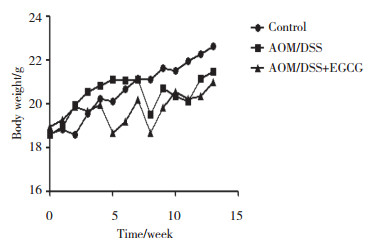
2 结果 2.1 小鼠一般情况和体质量变化对照组小鼠在整个实验过程中饮食、排便正常。AOM/DSS组与AOM/DSS+EGCG组小鼠在进入第1个循环周期后精神状态逐渐萎靡,进食较对照组少。进入第2个循环周期后,AOM/DSS+EGCG组小鼠死亡1只,解剖见肠胀气明显,应为急性肠炎伴梗阻。进入第3个循环周期,AOM/DSS+EGCG组小鼠出现血便。实验起始时对照组、AOM/DSS组、AOM/DSS+EGCG组小鼠体质量比较均无统计学差异(P > 0.05)。实验开始后每周测量小鼠体质量,对照组小鼠体质量稳定增长,AOM/DSS组与AOM/DSS+EGCG组小鼠体质量增长较慢,而且AOM/DSS+EGCG组小鼠在饮用DSS后体质量下降,停止饮用后体质量又再次升高,见图 1。实验结束时AOM/DSS组小鼠平均体质量较对照组小鼠轻(P < 0.05);AOM/DSS+EGCG组小鼠与对照组小鼠比较平均体质量有统计学差异(P < 0.01),但与AOM/DSS组小鼠比较无统计学差异(P > 0.05)。见表 1。
|
| 图 1 小鼠每周体质量变化 Fig.1 The body weight of mice was measured every week |
| Group | n | Body weight(g) | Dysplasia | Adenoma | Incidence of carcinogenesis(%) | |
| Week 0 | Week 13 | |||||
| Control | 10 | 18.61±0.50 | 22.63±1.04 | 0 | 0 | 0.00 |
| AOM/DSS | 10 | 18.57±0.45 | 21.45±1.111) | 1 | 4 | 50.001) |
| AOM/DSS+EGCG | 9 | 18.93±0.24 | 20.98±0.952) | 2 | 4 | 66.672) |
| 1)P < 0.05 vs control group; 2)P < 0.01 vs control group. | ||||||
2.2 EGCG促进AOM/DSS模型成瘤
对照组小鼠无成瘤或炎症反应;AOM/DSS组10只小鼠中5只出现结直肠非典型增生,其中4只出现腺瘤,1只出现不典型增生,癌变率为50.00%(5/10),与对照组比较癌变率的差异有统计学意义(P < 0.05);AOM/DSS+ EGCG组9只小鼠中6只出现结直肠非典型增生,其中4只出现腺瘤,癌变率为66.67%(6/9),与对照组比较癌变率的差异有统计学意义(P < 0.01),但与AOM/DSS组比较癌变率的差异无统计学意义(P > 0.05)。EGCG虽然没有明显增加小鼠结直肠腺瘤成瘤率,但AOM/DSS+ EGCG组成瘤小鼠肿瘤数量明显多于AOM/DSS组(P < 0.05)。见表 2。
| Group | n | Number of tumors | MVD for CD31 | Number of CD68+ macrophages |
| AOM/DSS | 4 | 3.75±1.71 | 12.16±3.91 | 9.50±1.69 |
| AOM/DSS+EGCG | 4 | 8.25±2.061) | 23.41±5.931) | 14.73±3.871) |
| 1) P < 0.05 vs AOM/DSS group. | ||||
2.3 小鼠结直肠组织病理比较
在第13周末处死小鼠,解剖肉眼可见对照组小鼠结直肠组织红润,无溃疡出血,无肉芽肿形成;AOM/DSS组与AOM/DSS+EGCG组小鼠结直肠组织明显充血水肿,在结肠远端和直肠部位较结肠近端具有更多的肿瘤负荷。组织学上,对照组小鼠腺体结构正常,无黏膜溃疡;AOM/DSS组小鼠的含瘤结直肠组织中观察到隐窝破坏、黏膜表面溃疡及中性粒细胞浸润;AOM/DSS+EGCG组小鼠的含瘤结直肠组织除了黏膜破坏、中性粒细胞浸润外,腺体更加紊乱,瘤细胞异型性明显。见图 2。

|
| 图 2 小鼠结直肠肉眼所见和结直肠组织病理图片 HE×100 Fig.2 Gross appearance and microscopic findings of the colons in mice HE×100 |
2.4 CD31和CD68在AOM/DSS组和AOM/DSS+EGCG组小鼠结直肠腺瘤中的表达
CD31阳性的肿瘤微血管呈棕黄色,均匀分布于结直肠腺体之间。AOM/DSS+EGCG组小鼠肿瘤中MDV值明显高于AOM/DSS组。CD68主要标记巨噬细胞的细胞膜,AOM/DSS+EGCG组小鼠其生成肿瘤间巨噬细胞数量明显高于AOM/DSS组,差异有统计学意义(P < 0.05)。见图 3、表 2。

|
| 图 3 CD31和CD68在小鼠结直肠肿瘤组织中的表达情况 CD31×200,CD68×400 Fig.3 CD31 and CD68 expression in murine colon adenoma CD31×200, CD68×400 |
3 讨论
CRC起源于结直肠的上皮细胞,是世界第三高发肿瘤。在炎性肠病患者中,溃疡性结肠炎是结直肠恶变的一个主要危险因素,已有研究[10]表明慢性炎症在结肠中的促肿瘤作用。溃疡性结肠炎到CRC的发展通过多种机制演变,主要包括氧化应激和转录激活子3信号通路的活化等[11-12]。然而,用于预防炎症肠疾病导致CRC的有效药物还未问市。因此,建立炎症相关性小鼠CRC模型,对于研究CRC进展及药物研发极具价值。用于诱导CRC的AOM/DSS模型[13]基于腹腔注射AOM,然后在饮用水中加入DSS重复喂养小鼠,其中DSS诱导结直肠明显炎症,从而促进CRC的形成。
血管生成在CRC的发展过程中起重要作用,小鼠息肉病模型已经表明息肉生长减少与新微血管形成的衰减有关[14]。典型的抗肿瘤药物贝伐单抗通过抗体与人血管内皮生长因子结合,阻断其活性来抑制血管生成,从而达到抗肿瘤的作用。有研究[15]认为可以将CD31同血管内皮生长因子一起用于评估肿瘤血管生成,将测出的MVD值作为CRC的一个预后因素。内皮细胞增生以及异常血管生成在由正常组织向腺瘤转变继而演发成恶性过程中起到推波助澜的作用,内皮细胞标志物CD31可以标记肿瘤旁微小血管。本研究通过MVD定量评估肿瘤血管生成[16]。MOHAMED等[17]对50例CRC患者的临床病理学参数进行分析,得出CD31高表达组的患者总体生存率显著低于CD31低表达组(P = 0.023)。本研究中,AOM/DSS+EGCG组的小鼠结直肠肿瘤中CD31的表达明显高于AOM/DSS组,其与肿瘤生成的数量有一定相关性。
肿瘤相关巨噬细胞在肿瘤进展中也起到重要作用,具有高水平巨噬细胞浸润肿瘤组织的患者预后较差[18]。CD68于巨噬细胞的细胞膜和细胞质中表达,在正常组织中CD68阳性细胞主要位于上皮细胞层之外,而在肿瘤组织中这些细胞可在上皮肿瘤细胞之间观察到[19]。在炎症的刺激下,不仅细胞因子和血管成长因子增多,整个机体的免疫微环境也在发生变化。巨噬细胞在炎症和癌症中也具有不可或缺的作用,激活的巨噬细胞可以产生特定的功能,既能促炎又能抗炎,这些机制依赖于巨噬细胞在特定微环境中获得的极化表型。有研究[20-21]表明M2型巨噬细胞在CRC起始的生长和转移中具有关键作用,而且M2型巨噬细胞还与肿瘤迁移/侵袭相关因子(如白细胞介素-10、肿瘤坏死因子)的异常增多有关。M2型巨噬细胞的典型特征是高度生成趋化因子,包括CCL17、CCL22或CCL24等,使调节性T细胞、嗜酸性粒细胞和嗜碱性粒细胞聚集,产生大量白细胞介素-10,导致免疫监视功能削弱,甚至促进组织重塑和血管生成。CD68作为巨噬细胞表面分子标志物,可通过其表达检测肿瘤组织中巨噬细胞数量,进而研究其与肿瘤发生发展的关系。本研究中,AOM/DSS+EGCG组小鼠的结直肠肿瘤中CD68的表达明显高于AOM/DSS组,其与肿瘤生成的数量呈正相关。
HARATIFAR等[4]发现EGCG能够抑制HT29结肠癌细胞系的增殖,还有研究[9]证实EGCG能够通过抑制AKT、ERK1/2通路诱导结肠癌细胞凋亡。然而本研究并没有证实这一点,而是发现EGCG在没有降低造模小鼠结直肠肿瘤发生率的前提下,反而增加肿瘤发生的数量。这与GUAN等[6]报道的结果相一致,他们的结果还显示高剂量的EGCG加重小鼠结直肠癌变的程度。尽管EGCG在CRC进展中的作用机制和对人类的意义有待进一步调查,但对于服用高剂量绿茶多酚补充剂的人群,尤其是结肠炎症患者,可能需要格外注意。
综上所述,AOM/DSS是构建小鼠结直肠腺瘤模型的一种短期有效方法,口服EGCG增加了AOM/DSS诱导小鼠结直肠非典型增生的发生率和肿瘤的数量。除此之外,EGCG可能通过促进结肠中慢性炎症进程和血管生成,进而促进结肠炎相关结直肠肿瘤的发生。
| [1] |
BAHRAMI A, KHAZAEI M, HASANZADEH M, et al. Therapeutic potential of targeting PI3K/AKT pathway in treatment of colorectal cancer:rational and progress[J]. J Cell Biochem, 2018, 119(3): 2460-2469. DOI:10.1002/jcb.25950 |
| [2] |
ABRAHAM C. Inflammatory bowel disease[J]. N Engl J Med, 2009, 361(21): 2066-2078. DOI:10.1056/NEJMra0804647 |
| [3] |
FEAGINS LA, SOUZA RF. Carcinogenesis in IBD:potential targets for the prevention of colorectal cancer[J]. Nat Rev Gastroenterol Hepatol, 2009, 6(5): 297-305. DOI:10.1038/nrgastro.2009.44 |
| [4] |
HARATIFAR S, MECKLING KA, CORREDIG M. Antiproliferative activity of tea catechins associated with casein micelles, using HT29 colon cancer cells[J]. J Dairy Sci, 2014, 97(2): 672-678. DOI:10.3168/jds.2013-7263 |
| [5] |
WUBETU GY, SHIMADA M, MORINE Y, et al. Epigallocatechin gallate hinders human hepatoma and colon cancer sphere formation[J]. J Gastroenterol Hepatol, 2016, 31(1): 256-264. DOI:10.1111/jgh.13069 |
| [6] |
GUAN F, LIU AB, LI G, et al. Deleterious effects of high concentrations of (-) -epigallocatechin-3-gallate and atorvastatin in mice with colon inflammation[J]. Nutr Cancer, 2012, 64(6): 847-855. DOI:10.1080/01635581.2012.695424 |
| [7] |
刘维新, 张绅, 任益, 等. 溃疡性结肠炎及溃疡性结肠炎相关性结直肠癌小鼠模型中血管生成因子的表达及其与血管新生的关系[J]. 中国医科大学学报, 2013, 42(3): 231-234. DOI:10.3969/j.issn.0258-4646.2013.03.011 |
| [8] |
JU J, KIM YJ, PARK ES. Korean solar salt ameliorates colon carcinogenesis in an AOM/DSS-induced C57BL/6 mouse model[J]. Prev Nutr Food sci, 2017, 22(2): 149-155. DOI:10.3746/pnf.2017.22.2.149 |
| [9] |
WEIDNER N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J]. Breast Cancer Res Treat, 1995, 36(2): 169-180. |
| [10] |
AXELRAD JE, LICHTIGER S. Inflammatory bowel disease and cancer:the role of inflammation, immunosuppression, and cancer treatment[J]. World J Gastroenterol, 2016, 22(20): 4794-4801. DOI:10.3748/wjg.v22.i20.4794 |
| [11] |
ROSSIN D, CALFAPIETRA S, SOTTERO B, et al. HNE and cholesterol oxidation products in colorectal inflammation and carcinogenesis[J]. Free Radic Biol Med, 2017, 111: 186-195. DOI:10.1016/j.freeradbiomed.2017.01.017 |
| [12] |
LI Y, DE HAAR C, CHEN M, et al. Disease-related expression of the IL6/STAT3/SOCS3 signaling pathway in ulcerative colitis and ulcerative colitis-related carcinogenesis[J]. Gut, 2010, 59(2): 227-235. DOI:10.1136/gut.2009.184176 |
| [13] |
TANAKA T, KOHNO H, SUZUKI R, et al. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate[J]. Cancer Sci, 2003, 94(11): 965-973. DOI:10.1111/j.1349-7006.2003.tb01386.x |
| [14] |
SENO H, OSHIMA M, ISHIKAWA TO, et al. Cyclooxygenase 2-and prostaglandin E (2) receptor EP (2) -dependent angiogenesis in Apc (Delta716) mouse intestinal polyps[J]. Cancer Res, 2002, 62(2): 506-511. |
| [15] |
SAAD RS, EL-GOHARY Y, MEMARI E, et al. Endoglin (CD105) and vascular endothelial growth factor as prognostic markers in esophageal adenocarcinoma[J]. Hum Pathol, 2005, 36(9): 955-961. DOI:10.1016/j.humpath.2005.06.019 |
| [16] |
DELIU IC, NEAGOE CD, BEZNĂ M, et al. Correlations between endothelial cell markers CD31, CD34 and CD105 in colorectal carcinoma[J]. Rom J Morphol Embryol, 2016, 57(3): 1025-1030. |
| [17] |
MOHAMED SY, MOHAMMED HL, IBRAHIM HM, et al. Role of VEGF, CD105, and CD31 in the prognosis of colorectal cancer cases[J]. J Gastrointest Cancer, 2017. DOI:10.1007/s12029-017-0014-y |
| [18] |
MANTOVANI A, SCHIOPPA T, PORTA C, et al. Role of tumor-associated macrophages in tumor progression and invasion[J]. Cancer Metastasis Rev, 2006, 25(3): 315-322. DOI:10.1007/s10555-006-9001-7 |
| [19] |
ZHANG Y, SIME W, JUHAS M, et al. Crosstalk between colon cancer cells and macrophages via inflammatory mediators and CD47 promotes tumor cell migration[J]. Eur J Cancer, 2013, 49(15): 3320-3334. DOI:10.1016/j.ejca.2013.06.005 |
| [20] |
WANG W, LI X, ZHENG D, et al. Dynamic changes and functions of macrophages and M1/M2 subpopulations during ulcerative colitis-associated carcinogenesis in an AOM/DSS mouse model[J]. Mol Med Rep, 2015, 11(4): 2397-2406. DOI:10.3892/mmr.2014.3018 |
| [21] |
ZHOU Q, XIAN M, XIANG S, et al. All-trans retinoic acid prevents osteosarcoma metastasis by inhibiting M2 polarization of tumor-associated macrophages[J]. Cancer Immunol Res, 2017, 5(7): 547-559. DOI:10.1158/2326-6066.CIR-16-0259 |
 2019, Vol. 48
2019, Vol. 48