文章信息
- 郭舜, 赵海潮, 任晓静, 任崇仁, 贺杰峰, 赵浩亮
- GUO Shun, ZHAO Haichao, REN Xiaojing, REN Chongren, HE Jiefeng, ZHAO Haoliang
- CNOT7基因敲减通过减少HepG2细胞TGF-β1分泌影响免疫微环境
- Effect of CNOT7 Gene Knockdown on the Immune Microenvironment of HepG2 Cells by Reduced TGF-β1 Secretion
- 中国医科大学学报, 2019, 48(3): 225-229
- Journal of China Medical University, 2019, 48(3): 225-229
-
文章历史
- 收稿日期:2018-10-22
- 网络出版时间:2019-2-28 10:37
2. 山西医科大学附属大医院普通外科, 太原 030001
2. Department of General Surgery, Shanxi Dayi Hospital Affiliated to Shanxi Medical University, Taiyuan 030001, China
肝细胞癌(hepatocellular carcinoma, HCC)是人类常见的恶性肿瘤之一。我国是HCC高发国家, HCC占全球病例总数和死亡人数的50%左右[1]。目前HCC的治疗模式已从单一学科治疗发展为多学科综合治疗, 其中HCC的免疫治疗已成为国内外研究的热点[2-3]。CCR4-NOT转录复合体亚基7(CCR4-NOT transcription complex subunit 7, CNOT7)是真核生物CCR4-NOT蛋白复合体的重要亚基之一[4], 参与调控多种肿瘤微环境相关蛋白的转录[5]。本课题组前期通过蛋白组学筛查, 发现其在肝癌组织中显著高表达[6]。作为免疫特惠器官, 肝脏具有独特的免疫系统, 并参与机体局部及整体水平的免疫调节。HCC免疫微环境中富含调节性T细胞(regulatory T cell, Treg)、未成熟树突状细胞等免疫抑制细胞及转化生长因子-β1(transforming growth factor-β1, TGF-β1)、白细胞介素-10(interleukin-10, IL-10)等免疫抑制因子。这种免疫抑制的微环境也成为HCC容易形成免疫逃逸的重要原因之一[7]。其中, TGF-β1作为一种多效性细胞因子, 是目前发现的肿瘤诱导产生的免疫抑制因子之一, 在HCC的免疫调节中发挥重要功能[8-9]。HCC患者体内TGF-β1水平越高, 其预后越差, 并与预后不良密切相关[8-9]。自然杀伤(natural killer, NK)细胞是固有免疫应答的参与者, 有调查结果显示肝癌患者组织中NK细胞的数量与患者生存期长短密切相关, 但是在临床研究中, 将体外扩增的NK细胞进行回输, 治疗效果并不理想, 这可能与肝癌免疫微环境有关[10]。本研究旨在探讨CNOT7基因敲减对HepG2细胞分泌TGF-β1的影响及其在HCC免疫微环境中的作用, 为HCC的免疫治疗提供一些新的思路。
1 材料与方法 1.1 主要材料及试剂HepG2细胞和NK细胞, 购自中科院细胞库; Lipofectamine 3000、opti-MEM培养基、人TGF-β1 ELISA试剂盒, 购自武汉博士德公司; 阴性对照质粒、CNOT7敲减质粒和CNOT7过表达质粒均购自上海吉凯基因生物化学技术有限公司。
1.2 HepG2细胞的培养与转染HepG2细胞培养于添加10%胎牛血清和青链霉素双抗的DMEM培养基, 于5% CO2和37℃的恒温密闭细胞培养箱中培养。规律传代3~4 d至细胞对数生长期, 按1×106/孔接种于6孔板上, 孵育12~15 h后, 使用Lipofectamine 3000进行转染。根据Lipofectamine 3000说明书将实验分为3组:阴性对照组、靶向敲减CNOT7组和过表达CNOT7组, 各组设有复孔。转染后放入37℃、5% CO2孵箱中培养6 h后, 分别更换为含10%胎牛血清的培养基。转染后48 h, 收集细胞进行转染分析, 倒置荧光显微镜下观察细胞转染效率。采用Western blotting检测3组细胞CNOT7蛋白、TGF-β1蛋白和核转录因子-κB (nuclear factor kappa B, NF-κB) p65蛋白的表达。采用ELISA法测定细胞培养上清液中TGF-β1水平。
1.3 Western blotting收集转染48 h后的各组细胞, 用0.25%的胰蛋白酶将细胞消化并离心收集后用预冷PBS洗涤2次, 溶解在含有PMSF和蛋白酶抑制剂的RIPA缓冲液中。BCA法测定蛋白浓度。每组取等量蛋白10 μg与上样缓冲液混合后, 常规行SDS-PAGE凝胶电泳, 取目的条带转膜处理, 用5%牛血清白蛋白封闭后, 分别加入1:500稀释的CNOT 7一抗、1:1 000稀释的TGF-β1一抗、1:400稀释的NF-κB p65一抗以及1:1 000稀释的β-actin一抗4℃孵育过夜。次日加入1:2 000稀释的二抗, 室温孵育1 h, TBS洗膜后用ECL检测试剂盒进行信号检测。以β-actin蛋白作为内参照, 用ImageJ软件测量蛋白条带光密度值, 最终结果表示为目的条带与内参β-actin的比值。
1.4 ELISA实验取各组细胞培养上清液, 按照试剂盒说明, 检测上清液中TGF-β1表达水平。
1.5 细胞凋亡实验将转染后3组细胞按1×106/孔接种于6孔板上, 孵育过夜。NK细胞采用CD3+包被刺激24 h活化。活化的NK细胞分别与3组细胞共培养。CSFE标记肿瘤细胞, 7-AAD标记发生凋亡的肿瘤细胞。6 h后, 流式细胞术检测肿瘤细胞对NK细胞杀伤功能的敏感性。
1.6 统计学分析采用SPSS 24.0软件进行数据分析。数据均以x±s表示, 组间比较采用t检验, P < 0.05为差异有统计学意义。
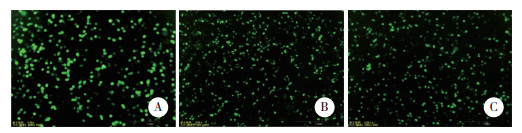
2 结果 2.1 HepG2细胞转染效率分析对HepG2细胞进行转染, 通过倒置荧光显微镜观察细胞转染效率(图 1), 各组细胞均发出明亮绿色荧光。采用Western blotting分析转染效率(图 2)。与阴性对照组相比, 靶向敲减CNOT7组CNOT7蛋白表达水平降低(t=7.975, P < 0.05), 过表达CNOT7组CNOT7蛋白表达水平升高(t=8.017, P < 0.05), 差异均有统计学意义。
|
| A, CNOT7-targeted knockdown group; B, control group; C, CNOT7 overexpression group. 图 1 倒置荧光显微镜下细胞荧光图像 ×200 Fig.1 Fluorescence microscopy images of cells ×200 |
|
| A, CNOT7 expression; B, relative expression level of CNOT7.1, control group; 2, CNOT7-targeted knockdown group; 3, CNOT7 overexpression group. *P < 0.05 vs control group. 图 2 细胞转染后HepG2细胞中CNOT7蛋白的表达 Fig.2 Expression of CNOT7 in HepG2 cells after transfection |
2.2 HepG2细胞中CNOT7对TGF-β1和NF-κb p65蛋白表达水平的影响
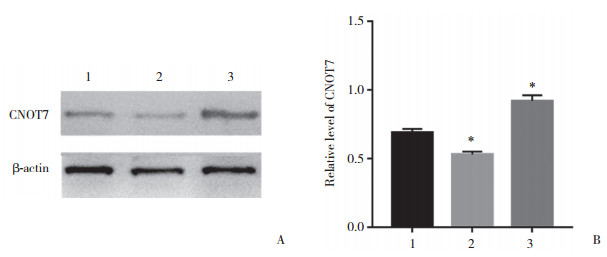
通过Western blotting分析细胞转染后HepG2细胞中TGF-β1和NF-κB p65蛋白表达变化(图 3)。结果显示, 与阴性对照组相比, 靶向敲减CNOT7组TGF-β1(t=7.374, P < 0.05)和NF-κB p65蛋白(t=4.436, P < 0.05)表达水平显著降低, 过表达CNOT7组TGF-β1(t=18.56, P < 0.05)和NF-κB p65蛋白(t=4.729, P < 0.05)表达水平显著升高, 差异均有统计学意义。
|
| A, TGF-β1 and NF-κB p65 expression levels; B, relative expression level of TGF-β1;C, relative expression level of NF-κB p65.1, control group; 2, CNOT7-targeted knockdown group; 3, CNOT7 overexpression group.*P < 0.05 vs control group. 图 3 细胞转染后HepG2细胞中TGF-β1和NF-κb p65蛋白的表达 Fig.3 Expression of TGF-β1 and NF-κB p65 in HepG2 cells after transfection |
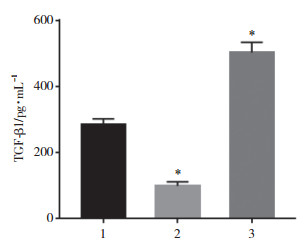
2.3 CNOT7对培养上清液中TGF-β1水平的影响
ELISA结果显示, 与阴性对照组相比, 靶向敲减CNOT7组细胞培养上清液中TGF-β1水平显著降低(t=15.136, P < 0.05), 过表达CNOT7组TGF-β1水平显著升高(t=10.514, P < 0.05), 差异均有统计学意义。见图 4。
|
| 1, control group; 2, CNOT7-targeted knockdown group; 3, CNOT7 overexpression group.*P < 0.05 vs control group. 图 4 培养上清液TGF-β1浓度 Fig.4 TGF-β1 concentration in culture supernatant |
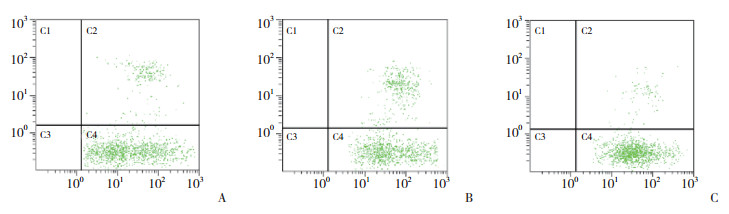
2.4 NK细胞对HepG2细胞杀伤能力的变化
流式细胞仪检测NK细胞对转染后2组细胞的杀伤能力。由图 5可见, NK细胞与转染后的HepG2细胞共培养后, 靶向敲减CNOT7组凋亡细胞比例为29.7%, 较阴性对照组14.5%显著升高, 过表达CNOT7组凋亡细胞比例为5.7%, 较阴性对照组显著降低, 差异均有统计学意义(P < 0.05)。
|
| A, control group; B, CNOT7-targeted knockdown group; C, CNOT7 overexpression group. 图 5 细胞转染后NK细胞对HepG2细胞杀伤能力的变化 Fig.5 Changes in the killing ability of NK cells toward HepG2 cells after transfection |
3 讨论
TGF-β1可有多种来源, 在HCC组织中主要由Treg细胞分泌和肿瘤细胞自身分泌。肿瘤微环境中Treg细胞的增加, 很可能主要依赖于肿瘤来源的TGF-β1[11]。肿瘤细胞分泌的TGF-β1可抑制CD8+、NK细胞的杀伤功能, 并将初始的CD4+T细胞诱导成Treg细胞; 导致肿瘤细胞周围Treg细胞富集, 分泌更多TGF-β1, 形成肿瘤局部免疫抑制的微环境[12]。研究表明, TGF-β1在细胞免疫和细胞凋亡过程中起重要作用。在肿瘤发展早期, TGF-β1对肿瘤细胞起抑制作用, 但是当肿瘤细胞对其抑制作用产生抵抗时, TGF-β1反而会促进肿瘤进展, 从而诱导肿瘤细胞迁移和侵袭, 介导免疫抑制和肿瘤局部免疫微环境的改变, 促进肿瘤细胞存活[13]。因此, 探索肿瘤细胞高分泌TGF-β1的机制并通过靶向抑制其分泌, 将有助于改善肿瘤的免疫微环境。
本研究发现CNOT7基因在HepG2细胞系中能够正向调控TGF-β1和NF-κb p65蛋白表达水平, 提示CNOT7可能通过NF-κb p65通路调控TGF-β1表达水平。此外, 本研究还发现, 敲减CNOT7后HepG2细胞外分泌的TGF-β1水平显著降低。与此同时, 与阴性对照组相比, CNOT7基因敲减后, HepG2细胞对NK细胞杀伤力的敏感性显著增加。这提示CNOT7基因表达下调部分逆转HepG2细胞对NK细胞的免疫耐受。通过检测细胞转染后NF-κB p65蛋白的变化, 发现CNOT7在HepG2细胞系中显著促进NF-κB p65蛋白表达水平, 提示CNOT7能够通过NF-κB p65调控TGF-β1表达水平。
综上所述, 本研究结果表明:CNOT7基因可能通过NF-κB信号通路调控TGF-β1的分泌水平参与了HCC免疫微环境的调节, 同时CNOT7基因表达下调增强NK细胞对肿瘤细胞的杀伤作用。CNOT7基因敲减改善HCC的免疫微环境, 这可能为后续研究HCC免疫治疗提供新的靶点。
| [1] |
TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics, 2012[J]. Ca Cancer J Clin, 2015, 65(2): 84-108. DOI:10.3322/caac.21262 |
| [2] |
中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 中华消化外科杂志, 2017, 16(7): 635-647. DOI:10.3760/cma.j.issn.1673-9752.2017.07.001 |
| [3] |
COHEN GS, BLACK M. Multidisciplinary management of hepatocellular carcinoma:a model for therapy[J]. J Multidiscip Health, 2013, 6: 189-195. DOI:10.2147/JMDH.S41206 |
| [4] |
BARTLAM M, YAMAMOTO T. The structural basis for deadenylation by the CCR4-NOT complex[J]. Protein Cell, 2010, 1(5): 443-452. DOI:10.1007/s13238-010-0060-8 |
| [5] |
CHAPAT C, KOLYTCHEFF C, LE ROMANCER M, et al. hCAF1/CNOT7 regulates interferon signalling by targeting STAT1[J]. EMBO J, 2013, 32(5): 688-700. DOI:10.1038/emboj.2013.11 |
| [6] |
赵雷, 任崇仁, 贺杰峰, 等. CNOT7基因参与诱导HepG2细胞对V γ 9V δ 2T细胞的免疫耐受[J]. 中华普通外科杂志, 2017, 32(1): 57-60. DOI:10.3760/cma.j.issn.1007-631X.2017.01.018 |
| [7] |
HERNANDEZ-GEA V, TOFFANIN S, FRIEDMAN SL, et al. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2013, 144(3): 512-527. DOI:10.1053/j.gastro.2013.01.002 |
| [8] |
SUN X, ZHANG J, HOU Z, et al. miR-146a is directly regulated by STAT3 in human hepatocellular carcinoma cells and involved in anti-tumor immune suppression[J]. Cell Cycle, 2015, 14(2): 243-252. DOI:10.4161/15384101.2014.977112 |
| [9] |
GIANNELLI G, MIKULITS W, DOOLEY S, et al. The rationale for targeting TGF-β in chronic liver diseases[J]. Eur J Clin Invest, 2016, 46(4): 349-361. DOI:10.1111/eci.12596 |
| [10] |
YU M, LI Z. Natural killer cells in hepatocellular carcinoma:current status and perspectives for future immunotherapeutic approaches[J]. Front Med, 2017, 11(4): 509-521. DOI:10.1007/s11684-017-0546-3 |
| [11] |
LI Z, ZHANG LJ, ZHANG HR, et al. Tumor-derived transforming growth factor-β is critical for tumor progression and evasion of immune surveillance[J]. Asian Pac J Cancer Prev, 2014, 15(13): 5181-5186. DOI:10.7314/APJCP.2014.15.13.5181 |
| [12] |
ROJAS A, ZHANG P, WANG Y, et al. A positive TGF-β/c-KIT feedback loop drives tumor progression in advanced primary liver cancer[J]. Neoplasia, 2016, 18(6): 371-386. DOI:10.1016/j.neo.2016.04.002 |
| [13] |
MASSAGUÉ J. TGFbeta in cancer[J]. Cell, 2008, 134(2): 215-230. DOI:10.1016/j.cell.2008.07.001 |
 2019, Vol. 48
2019, Vol. 48