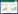文章信息
- 高天, 余铃, 李舒, 刘佳勇, 白楚杰, 薛瑞峰, 张路, 方志伟, 樊征夫
- Gao Tian, Yu Ling, Li Shu, Liu Jiayong, Bai Chujie, Xue Ruifeng, Zhang Lu, Fang Zhiwei, Fan Zhengfu
- Notch信号通路促进滑膜肉瘤细胞SW982增殖和侵袭的研究
- Notch Signaling Promotes Proliferation and Migration of SW982 Synovial Sarcoma Cells
- 中国医科大学学报, 2019, 48(3): 210-215
- Journal of China Medical University, 2019, 48(3): 210-215
-
文章历史
- 收稿日期:2018-05-08
- 网络出版时间:2019-02-28 13:54
2. 武汉大学人民医院骨1科, 武汉 430060
2. Department of Orthopedics, Renmin Hospital of Wuhan University, Wuhan 430060, China
滑膜肉瘤是一种临床上常见的高度恶性软组织肉瘤,好发于青壮年且多在关节周围[1-2]。尽管手术联合放化疗的治疗手段使患者5年生存率达到60%,10年生存率仍然极低[3]。Notch信号通路是一种进化中高度保守的跨膜受体信号通路家族,其所编码的单链跨膜受体蛋白在细胞的分化、个体发育的中起关键作用[4]。Notch信号通路包括Notch受体、配体、修饰蛋白及靶点转录因子。配体与受体结合后,Notch受体发生裂解并释放Notch受体胞内段(Notch intracellular domain,NICD),随后NICD进入细胞核调控靶基因转录[5]。研究[6-8]发现Notch信号通路的失调控参与多种肿瘤的发生发展,如血液系统肿瘤、乳腺癌、胰腺癌等。Notch信号通路对滑膜肉瘤的影响尚未见报道,本研究拟探讨Notch通路相关蛋白在滑膜肉瘤细胞SW982中的表达状态及Notch通路对SW982细胞增殖及侵袭能力的影响。
1 材料与方法 1.1 细胞培养人滑膜肉瘤细胞株SW982购自美国菌种保藏中心(American Type Culture Collection,ATCC)。SW982细胞常规培养于含10%胎牛血清、1% 100 U/mL青霉素和100 U/mL链霉素的L-15专用培养基中,置于37 ℃、5% CO2的培养箱中进行常规培养。
1.2 细胞转染NICD1过表达、CBF1-shRNA慢病毒和阴性对照病毒均购自上海吉凯基因化学技术有限公司。根据慢病毒转染手册对滑膜肉瘤细胞进行转染,从而得到SW982-Notch上调、W982-Notch下调细胞株。转染的细胞培养72 h后,用嘌呤霉素(3 μg/mL)孵育48 h。筛选后的滑膜肉瘤细胞株即为稳定转染细胞株。
1.3 CCK-8实验细胞分为SW982正常对照组、SW982-Notch上调组、W982-Notch下调组和DAPT处理组。收集各组细胞制成细胞悬液,用PBS调整细胞密度至1×105/mL。接种于96孔板中,每孔200 μL,培养24 h,细胞贴壁后分别加入终浓度1、2、4、8 μmol/L的DAPT,转染组细胞直接培养。培养24 h后,每孔加入10 μL CCK-8试剂,37 ℃孵育2 h。采用酶标仪检测450 nm处的光密度值(optical density,OD),计算细胞增殖率,每组实验均重复3次。
1.4 划痕实验将各组细胞用L-15专用培养基(含10%胎牛血清)培养于6孔板上,待融合后,用灭菌枪头划直线,划痕后0~24 h,用反转的Olympus IX50显微镜通过10倍物镜和Image-ProPlus软件捕获测量划痕面积。所有实验重复3次,划痕面积越大,表示迁移能力越弱。
1.5 qPCR检测NOTCH-1、HES-1、HES-5、HEY-1基因mRNA表达水平按照Invitrogen公司的Trizol操作说明书进行操作,抽提完成后,加入20 μL无RNA酶水,至完全溶解,紫外分析测定所抽提RNA的浓度。取5 μg按逆转录试剂盒说明逆转录cDNA。以cDNA为模板PCR扩增NOTCH-1、HES-1、HES-5和HEY-1,以GAPDH为内参照。各基因引物序列如下:NOTCH-1:5’-GGCACTTTCTGTGAGGAGGAC-3’,5’-GCAGTCAGGCGTGTTGTTCT-3’。HES-1:5’-ATTCTGGAAATGACAGTGAAGCAC-3’,5’-CACCTCGGTATTAACGCCCTC-3’。HES-5:5’-GAAGCCGGTGGTGGAGAA-3’,5’-GCTTGGAGTTGGGCTGGTG-3’。HEY-1:5’-GAAGCAGGTAATGGAGCAAGGA-3’,5’-GAAGCGTAGTTGTTGAGATGCG-3’。GAPDH:5’-ACTTTGGTATCGTGGAAGGACTCAT-3’,5’-GTTTTTCTAGACGGCAGGTCAGG-3’。PCR反应条件:预变性94 ℃ 5 s,94 ℃ 30 s,-60 ℃ 30 s,-72 ℃ 30 s,共40个循环;溶解曲线条件:95 ℃ 15 s,-60 ℃ 30 s,-95 ℃ 15 s。基因相对表达水平通过2-△△Ct法计算。
1.6 Western blotting法检测NOTCH-1及HES-1蛋白表达水平取各组细胞弃去培养液,PBS洗涤3次,提取细胞蛋白并定量。取适量裂解产物,以1:4比例加入样品与缓冲液,进行SDS-PAGE,电泳完成后将蛋白转移至硝酸纤维素膜上,用脱脂牛奶室温封闭1 h,加入相应一抗于4 ℃孵育4 h,TBST洗涤20 min;加入相应二抗于室温孵育1 h,TBST洗涤20 min;显色,成像扫描分析系统保存图像。
1.7 统计学分析数据采用SPSS 15.0统计软件进行分析,实验结果采用x±s表示,组间差异采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 Notch信号通路相关蛋白在滑膜肉瘤细胞SW982中表达增高NOTCH-1受体和目的基因HES-1、HES-5及HEY-1在人滑膜肉瘤细胞SW982中mRNA表达水平明显高于正常滑膜细胞,分别较对照组提高1.67±0.36、1.75±0.48、1.56±0.21和1.62±0.25倍,差异有统计学意义(P < 0.05,图 1A)。Western blotting结果同样显示,NOTCH-1蛋白和其目的基因HES-1在人滑膜肉瘤细胞SW982中表达水平显著高于正常滑膜细胞(图 1B)。
|
| A, qPCR; B, Western blotting. * P < 0.05 vs synovial cells. 图 1 正常滑膜和SW982细胞中Notch通路相关基因表达 Fig.1 Expression of Notch signaling pathway related genes in normal synovial cells and SW982 cells |
2.2 上调Notch信号通路对滑膜肉瘤细胞SW982增殖及侵袭的影响
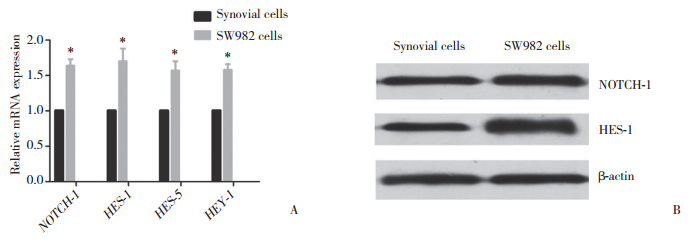
利用慢病毒转染技术构建NICD1持续表达的细胞SW982株。通过qPCR和Western blotting技术对NICD1表达发挥的Notch信号通路激活作用进行验证。qPCR结果显示,NOTCH-1及其靶基因HES-1,HES-5,HEY-1的mRNA表达量明显增高,平均较对照组提高1.58±0.27倍,差异有统计学意义(P < 0.05,图 2A)。Western blotting验证也发现蛋白表达水平与mRNA表达相符(图 2B)。对Notch上调细胞SW982及对照细胞SW982进行增殖能力测定,CCK8结果显示,24~72 h时间范围内Notch上调的细胞SW982增殖能力明显强于对照细胞SW982,24 h、48 h及72 h较对照组分别提高1.24±0.08、1.48±0.18和1.72±0.47倍,差异有统计学意义(P < 0.05,图 2C)。划痕实验发现,Notch上调的细胞SW982侵袭能力与对照细胞SW982在24h无明显差别。但在48 h时,Notch上调的细胞SW982迁移距离明显长于对照细胞SW982(图 2D)。
|
| A, qPCR; B, Western blotting; C, the proliferation of SW982 cells was upregulated following NICD1 overexpression; D, the invasion of SW982 cells was upregulated following NICD1 overexpression. * P < 0.05 vs control group. 图 2 过表达NICD1上调Notch通路活性,增加SW982的增殖和侵袭能力 Fig.2 The proliferation and invasion of SW982 cells were upregulated following NICD1 overexpression |
2.3 下调Notch信号通路对滑膜肉瘤细胞SW982增殖及迁移的影响
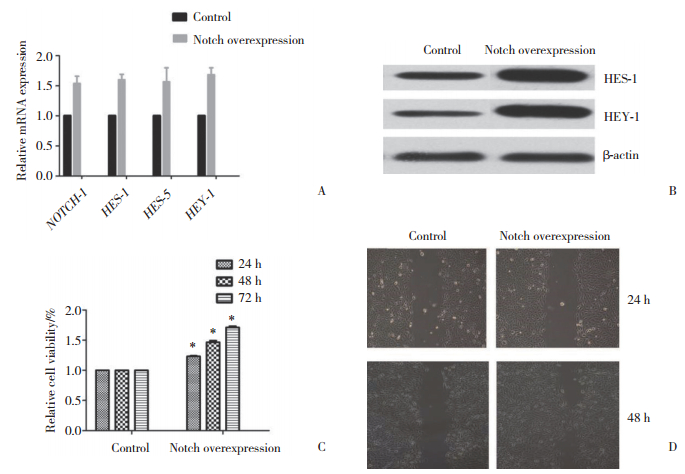
利用qPCR技术进行验证,下调组靶基因mRNA水平仅为对照组的46.3%±10.0%,差异有统计学意义(P < 0.05,图 3A),Western blotting实验也验证了上述结果(图 3B)。对Notch下调的细胞SW982及对照细胞SW982进行增殖能力测定,CCK8结果显示,24~72 h时间范围内Notch下调的细胞SW982增殖能力明显低于对照细胞SW982,24 h、48 h及72 h分别为对照组的72.3%±13.2%、57.6%±11.0%和34.6%±7.5%,差异有统计学意义(P < 0.05,图 3C)。划痕实验发现,Notch下调的细胞SW982迁移能力与对照细胞SW982在24 h无明显差别,48 h时Notch下调的细胞SW982迁移距离明显短于对照细胞SW982(图 3D)。
|
| A, qPCR; B, Western blotting; C, the proliferation of SW982 cells was downregulated following CBF1 knockdown; D, the invasion of SW982 cells was downregulated following CBF1 knockdown. * P < 0.05 vs control group. 图 3 干扰CBF1表达下调Notch通路活性,抑制SW982的增殖和侵袭能力 Fig.3 The proliferation and invasion of SW982 cells were downregulated following CBF1 knockdown |
2.4 DAPT对滑膜肉瘤细胞SW982增殖和侵袭的影响
CCK8检测发现,用不同浓度DAPT处理后,细胞SW982在24~72 h时间范围内增殖受到明显抑制,且抑制作用有明显剂量依耐性和时间依耐性。在一定范围内,随着DAPT剂量的增加(1,2,4,8 μmol/L)和作用时间的延长,细胞SW982增殖抑制效果明显增加,DAPT 8 μmol/L处理72 h的抑制率可达到87.3%±7.0%,差异有统计学意义(P < 0.05,图 4A)。

|
| A, the proliferation of SW982 cells was downregulated when exposed to different concentrations of DAPT for different durations; B, the invasion of SW982 cells was downregulated when exposed to DAPT. * P < 0.05 vs 0 μmol/L group; # P < 0.05 vs 24 h group. 图 4 DAPT抑制SW982细胞的增殖和侵袭 Fig.4 The proliferation and invasion of SW982 cells were downregulated by DAPT |
划痕实验结果显示,4 μmol/L的DAPT孵育细胞SW982 48 h后,细胞迁移的数量明显减少。与对照组相比,有统计学差异(图 4B)。
3 讨论在大多数滑膜肉瘤中存在特异性的染色体t(X;18)(p11.2;q11.2)易位,并在断裂处形成融合基因SYT-SSX[9],而这种融合基因带来的下游改变尚不清楚。在FRANCIS等[10]的研究中,对大量的软组织肉瘤样本行基因表达谱分析,其中包括31例滑膜肉瘤的样本,结果发现,在滑膜肉瘤中差异表达的基因参与Notch、Hh和Wnt等信号通路,其中NOTCH-1和JAG1明显上调。本研究结果与其一致,滑膜肉瘤细胞SW982中NOTCH-1及其下游基因HES-1、HES-5和HEY-1表达明显高于人源滑膜细胞,提示Notch信号通路在滑膜肉瘤细胞处于激活状态。
本研究通过慢病毒转染技术上调和下调Notch信号通路,结果显示,下调Notch信号通路后SW982细胞增殖及迁移明显受到抑制,而上调得到的结果完全相反。磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted in chromosome 10,PTEN)作为抑癌基因发生突变,其与Notch通路的关系在多种肿瘤中得到证实。如在乳腺癌中,Notch信号通路通过下调PTEN表达水平,导致ERK1/2信号转导的过度激活,从而参与曲妥珠单抗耐药[11];而在胃癌中,通过抑制Notch信号通路,可上调PTEN活性,从而诱导胃癌G2/M细胞周期阻滞[12]。本研究发现,滑膜肉瘤中NOTCH-1上调,推测其可能导致PTEN基因的降低,从而发挥肿瘤促进作用。
Notch信号通路无须第二信使,γ-分泌酶抑制剂能够靶向阻断活化的Notch受体从胞膜脱落,抑制下游靶基因激活[13-14]。在非小细胞肺癌移植瘤的模型中发现,γ-分泌酶抑制剂能够有效抑制肿瘤生长,且停药后仍然发挥着抗肿瘤作用[15]。同时,研究[16]也证实γ-分泌酶抑制剂对于软组织肉瘤具有抑制作用,如γ-分泌酶抑制剂可减少硬纤维瘤细胞的迁移和侵袭,并可导致其细胞周期阻滞,一项Ⅰ期临床试验表明γ-分泌酶抑制剂用于硬纤维瘤患者中,可取得较好的疗效[17]。本研究发现,滑膜肉瘤中Notch通路被过激活,因此,推测其抑制剂也可能对滑膜肉瘤发挥抑制效果。为了进一步检测γ-分泌酶抑制剂对于滑膜肉瘤的抑制效果,本研究采用DAPT处理SW982细胞,结果发现其增殖受到明显抑制。随后对Notch信号通路是否能影响SW982细胞迁移进行研究,与设想一致,DAPT处理SW982细胞48 h后,SW982迁移能力同样明显被削弱。上述结果高度提示Notch信号通路在滑膜肉瘤细胞SW982中扮演促进肿瘤发生发展的角色。
尽管如此,本研究仍具有一定局限性。第一,未能将Notch信号通路抑制剂与临床化疗药物联合应用观察对滑膜肉瘤细胞SW982的影响;第二,Notch信号通路是否能影响滑膜肉瘤细胞SW982体内的增殖和侵袭能力未知,需要后续的动物实验继续探究;第三,Notch本身受体及配体类型较多,本研究证实,NOTCH-1在滑膜肉瘤的增殖侵袭中发挥重要作用,但与之相关的配体尚需进一步研究。相信随着Notch分子生物学的进一步研究,将为包括滑膜肉瘤在内的软组织肿瘤的诊断和治疗提供新思路和实验依据。
| [1] |
RIEDEL RF, JONES RL, ITALIANO A, et al. Systemic anti-cancer therapy in synovial sarcoma:a systematic review[J]. Cancers (Basel), 2018, 10(11): E417. DOI:10.3390/cancers10110417 |
| [2] |
DESAR IME, FLEUREN EDG, VAN DER Graaf WTA. Systemic treatment for adults with synovial sarcoma[J]. Curr Treat Options Oncol, 2018, 19(2): 13. DOI:10.1007/s11864-018-0525-1 |
| [3] |
El BEAINO M, ARAUJO DM, LAZAR AJ, et al. Synovial sarcoma:advances in diagnosis and treatment identification of new biologic targets to improve multimodal therapy[J]. Ann Surg Oncol, 2017, 24(8): 2145-2154. DOI:10.1245/s10434-017-5855-x |
| [4] |
BIGAS A, ESPINOSA L. The multiple usages of Notch signaling in development, cell differentiation and cancer[J]. Curr Opin Cell Biol, 2018, 55: 1-7. DOI:10.1016/j.ceb.2018.06.010 |
| [5] |
MEURETTE O, MEHLEN P. Notch signaling in the tumor microenvironment[J]. Cancer Cell, 2018, 34(4): 536-548. DOI:10.1016/j.ccell.2018.07.009 |
| [6] |
ARRUGA F, VAISITTI T, DEAGLIO S. The NOTCH pathway and its mutations in mature B cell malignancies[J]. Front Oncol, 2018, 8: 550. DOI:10.3389/fonc.2018.00550 |
| [7] |
MOLLEN EWJ, IENT J, TJAN-HEIJNEN VCG, et al. Moving breast cancer therapy up a Notch[J]. Front Oncol, 2018, 8: 518. DOI:10.3389/fonc.2018.00518 |
| [8] |
HARBUZARIU A, OPREA-LLIES GM, GONZALEZ-PEREZ RR. The role of notch signaling and leptin-Notch crosstalk in pancreatic cancer[J]. Medicines (Basel), 2018, 5(3): E68. DOI:10.3390/medicines5030068 |
| [9] |
SAITO T. The SYT-SSX fusion protein and histological epithelial differentiation in synovial sarcoma:relationship with extracellular matrix remodeling[J]. Int J Clin Exp Pathol, 2013, 6(11): 2272-2279. |
| [10] |
FRANCIS P, NAMLOS HM, MULLER C, et al. Diagnostic and prognostic gene expression signatures in 177 soft tissue sarcomas:hypoxia-induced transcription profile signifies metastatic potential[J]. BMC Genomics, 2007, 8: 73. DOI:10.1186/1471-2164-8-73 |
| [11] |
BAKER A, WYATT D, BOCCHETTA M, et al. Notch-1-PTEN-ERK1/2 signaling axis promotes HER2+ breast cancer cell proliferation and stem cell survival[J]. Oncogene, 2018, 37(33): 4489-4504. DOI:10.1038/s41388-018-0251-y |
| [12] |
KIM SJ, LEE HW, BAEK JH, et al. Activation of nuclear PTEN by inhibition of Notch signaling induces G2/M cell cycle arrest in gastric cancer[J]. Oncogene, 2016, 35(2): 251-260. DOI:10.1038/onc.2015.80 |
| [13] |
BRAHMI M, BALLY O, EBERST L, et al. Therapeutic targeting of Notch signaling in cancer[J]. Bull Cancer, 2017, 104(10): 883-891. DOI:10.1016/j.bulcan.2017.07.007 |
| [14] |
GU K, LI Q, LIN H, et al. Gamma secretase inhibitors:a patent review (2013-2015)[J]. Expert Opin Ther Pat, 2017, 27(7): 851-866. DOI:10.1080/13543776.2017.1313231 |
| [15] |
ZHANG Y, XU W, GUO H, et al. NOTCH1 signaling regulates self-renewal and platinum chemoresistance of cancer stem-like cells in human non-small cell lung cancer[J]. Cancer Res, 2017, 77(11): 3082-3091. DOI:10.1158/0008-5472.CAN-16-1633 |
| [16] |
SHANG H, BRAGGIO D, LEE YJ, et al. Targeting the Notch pathway:a potential therapeutic approach for desmoid tumors[J]. Cancer, 2015, 121(22): 4088-4096. DOI:10.1002/cncr.29564 |
| [17] |
HUGHES DP, KUMMAR S, LAZAR AJ. New, tolerable γ-secretase inhibitor takes desmoid down a notch[J]. Clin Cancer Res, 2015, 21(1): 7-9. DOI:10.1158/1078-0432.CCR-14-1660 |
 2019, Vol. 48
2019, Vol. 48