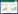文章信息
- 段睿, 焦奥, 张城硕, 林建贞, 石悦, 张佳林
- DUAN Rui, JIAO Ao, ZHANG Chengshuo, LIN Jianzhen, SHI Yue, ZHANG Jialin
- 短肽FLPNF对地塞米松诱导的胰岛细胞凋亡的保护作用
- Protective Effect of Oligopeptide FLPNF on Dexamethasone-induced Apoptosis of Islet Cells
- 中国医科大学学报, 2019, 48(3): 193-200
- Journal of China Medical University, 2019, 48(3): 193-200
-
文章历史
- 收稿日期:2018-11-06
- 网络出版时间:2019-02-28 11:41
糖皮质激素具有抗炎、免疫抑制等多种生理作用[1-2],可用于类风湿性关节炎、系统性红斑狼疮、血管炎等疾病的治疗[3-5]。临床应用糖皮质激素一般采用长时间和(或)高剂量的全身疗法,对胰岛β细胞具有一定的毒性作用[6],使其受到损伤,进而发展成为类固醇性糖尿病。这种损伤的程度与糖皮质激素的使用剂量和时间呈正相关。地塞米松(dexamethasone,Dexa)是常用的糖皮质激素药物,有研究[7-8]发现它可通过多种途径诱导细胞损伤。前期研究发现,短肽FLPNF对过表达人胰岛淀粉样多肽(human islet amyloid polypeptide,hIAPP)的大鼠胰岛细胞INS-1具有一定的保护作用。但目前尚未有研究报道FLPNF是否可以对Dexa诱导的胰岛β细胞凋亡具有保护作用。本研究拟探讨短肽FLPNF对Dexa诱导的胰岛β细胞凋亡的影响,为进一步研究FLPNF对类固醇性糖尿病的防治作用提供依据。
1 材料与方法 1.1 试剂与仪器RPMI1640培养液、胎牛血清、胰蛋白酶、PBS(北京Hyclone公司);Dexa,上海Sigma-Aldrich公司);短肽FLPNF,短肽NFGAIL(上海强耀生物科技有限公司);胃饥饿素(Ghrelin,美国Anaspec公司);兔抗Bcl-2多克隆抗体、鼠抗Bax多克隆抗体、兔抗c-caspase-3多克隆抗体、鼠抗Glut2多克隆抗体(武汉Proteintech公司);Annexin-V-FITC-PI双染试剂盒、增强型CCK-8试剂盒、一步法TUNEL细胞凋亡检测试剂盒、细胞周期与细胞凋亡检测试剂盒(上海碧云天生物科技有限公司);全自动酶标仪(瑞士SUNRISERC公司);FACSCalibur流式细胞仪(美国BD公司)。
1.2 方法 1.2.1 细胞培养大鼠胰岛细胞株INS-1(上海拜力生物科技有限公司)为我院普外实验室冻存。将复苏后的INS-1细胞添加RPMI1640培养基(10 mmol/L HEPES、2 mmol/L L-谷氨酰胺、1 mmol/L丙酮酸钠、10 μmol/L β-巯基乙醇、10%胎牛血清、100 U/mL青霉素及100 μg/mL链霉素)[9]置于37 ℃、5%CO2培养箱中培养。
1.2.2 细胞分组将细胞随机分为空白对照组、Dexa组、FLPNF组、FLPNF+Dexa组、Ghrelin对照组、Ghrelin+ Dexa对照组、NFGAIL对照组、NFGAIL+Dexa对照组,其中含有Ghrelin的对照组为阳性对照组,含有NFGAIL的对照组为阴性对照组。此分组中,用于处理细胞的Dexa的浓度为100 nmol/L,短肽FLPNF、NFGAIL的浓度为200 μmol/L,Ghrelin的浓度为100 nmol/L,FLPNF+Dexa组、Ghrelin+Dexa对照组、NFGAIL+Dexa对照组分别用FLPNF、Ghrelin、NFGAIL预处理细胞24 h,再添加Dexa。该分组用于方法1.2.3(3)、1.2.4、1.2.5、1.2.6及1.2.7部分。
1.2.3 CCK-8法测定INS-1细胞活力(1)为了探究Dexa与FLPNF的先后添加顺序对INS-1细胞活力的影响,取对数生长期细胞,接种至96孔板(5×103/孔),每个实验条件设置4个复孔。将细胞分为空白对照(Control)组、Dexa组、FLPNF组、FLPNF+Dexa组、Dexa 48 h+Control 72 h组、Dexa 48 h+FLPNF 72 h组、Control 72 h+Dexa 48 h组、FLPNF 72 h+Dexa 48 h组,其中FLPNF+Dexa组采用FLPNF与Dexa同时处理细胞的方式添加,其余组按时间顺序添加,添加的处理处理因素Dexa的浓度为100 nmol/L,短肽FLPNF、NFGAIL的浓度为200 μmol/L,Ghrelin的浓度为100 nmol/L。(2)为了探究不同浓度FLPNF对INS-1细胞增殖活力的影响,取对数生长期细胞,接种至96孔板(1×104/孔),每个实验条件设置4个复孔。将细胞分为空白对照(Control)组、Dexa组、100 μmol/L FLPNF组、100 μmol/L FLPNF+Dexa组、200 μmol/L FLPNF组、200 μmol/L FLPNF+Dexa组、400 μmol/L FLPNF组、400 μmol/L FLPNF+Dexa组,FLPNF+Dexa组用FLPNF预处理24 h,再添加Dexa。(3)为检测FLPNF与其他对照肽类对INS-1细胞活力的影响,取对数生长期细胞,接种至96孔板(1×104/孔),每个实验条件设置4个复孔。(4)各组细胞经过药物处理后,在每孔培养基中加入10 μL CCK-8溶液,于37 ℃培养箱中继续培养1~1.5 h。待CCK-8孵育结束后,将96孔板放入酶标仪中,测定各孔在450 nm处的吸光度值。
1.2.4 ELISA法检测葡萄糖刺激胰岛素分泌功能取对数生长期细胞接种于96孔板(1×104/孔)。将INS-1细胞分为Control组、Dexa组、FLPNF组、FLPNF+ Dexa组,Dexa终浓度为100 nmol/L,FLPNF终浓度为200 μmol/L,FLPNF+Dexa组先用FLPNF预处理24 h后,再添加终浓度为100 nmol/L的Dexa。药物处理后,以PBS洗涤2次,加入不含葡萄糖的KRBH液100 μL/孔,37 ℃孵育30 min,弃KRBH液,用含有低糖(1.1 mmol/L)或高糖(20 mmol/L)的KRBH液孵育1 h,将各组样本液体收集至离心管中,3 000r/min离心30 min,收集上清。在96孔板中加入标准品或样品(50 μL/孔),稀释标准品,制作标准曲线。每孔加入样品稀释液40 μL及样品10 μL,空白对照孔加入样品稀释液40 μL及完全培养基10 μL。用封口膜封闭孔口,置于37 ℃培养箱中孵育30 min。弃除液体并连续洗涤5次后,加入酶标试剂50 μL/孔,空白对照孔中不加。封口膜封孔后,37 ℃孵育30 min后,连续洗涤5次,每孔加入显色剂A、B各50 μL,室温避光静置15 min。显色后终止,用酶标仪测定450 nm处吸光度值。
1.2.5 TUNEL法检测细胞凋亡将对数生长期细胞接种至48孔板,进行相应药物处理(按1.2.2分组方法处理)后,PBS洗涤1次。4%多聚甲醛常温下固定30 min,PBS洗除固定液。加入免疫染色强力通透液1 mL/孔,室温孵育5 min。将TdT酶与荧光染色液按1:9混合成标准TUNEL检测液。孵育后的细胞用PBS洗涤2次,加入标准TUNEL检测液50 μL/孔,用封口膜将孔口封闭,37 ℃孵育60 min,PBS洗涤1次。加入DAPI荧光染液100 μL/孔,37 ℃孵育15 min。PBS洗涤2次,在激光共聚焦显微镜下观察和对比不同药物作用后的细胞形态和凋亡情况。
1.2.6 Annexin V-FITC/PI法检测细胞凋亡率各组INS-1细胞经药物处理后,用不含EDTA的胰酶消化,计数后将每组细胞数调节至1×105/mL,每组样品取1 mL细胞悬液,1 000 r/min、4 ℃离心10 min,弃上清。用预冷的PBS洗涤2次。将细胞重悬于195 μL Annexin V-FITC结合液。每管样品加入5 μL Annexin V-FITC、10 µL碘化丙啶染色液混匀,避光室温反应15 min,立即用流式细胞仪检测。
1.2.7 Western blotting检测Bcl-2、Bax、caspase-3及Glut2蛋白的表达水平向6孔板中各组细胞加入Western及IP裂解液(100 μL/孔,添加1%的苯甲基磺酰氟),裂解30 min后用超声仪匀浆。BCA法测定总蛋白浓度,煮沸5 min使蛋白变性。蛋白上样,电泳,转印至硝酸纤维素膜。5%脱脂牛奶封闭2 h,分别加入一抗(抗Bcl-2抗体、抗Bax抗体、抗caspase-3抗体1:500稀释,抗Glut2抗体1:1 000稀释),4 ℃过夜。室温孵育2 h,TBST洗膜3次,分别加入羊抗鼠二抗、羊抗兔二抗,室温孵育1 h,TBST洗膜3次。ECL显色,采用ImageJ 1.8.0软件对获取的图像进行分析。以β-actin为内参。
1.3 统计学分析采用GraphPad Prism 5软件进行统计学分析。计量资料用x±s表示,方差分析两两比较采用LSD法比较。P < 0.05为差异有统计学意义。
2 结果 2.1 FLPNF对Dexa作用下INS-1细胞增殖活力的影响如图 1A所示,与Dexa组相比,FLPNF+Dexa组的细胞活力明显增高(P < 0.001),FLPNF 72 h+Dexa 48 h组的细胞活力无明显变化,Dexa 48 h+FLPNF 72 h组的细胞活力有所增加,差异有统计学意义(P < 0.001)。与FLPNF+Dexa组比较,Dexa 48 h+FLPNF 72 h组的细胞活力较低,差异有统计学意义(P < 0.01),FLPNF 72 h+Dexa 48 h组的细胞活力较FLPNF+Dexa组低,但无统计学差异。如图 1B所示,不同浓度(100、200、400 μmol/L)FLPNF对INS-1细胞活力的影响几乎无差异;与Dexa组相比,FLPNF(100 μmol/L)+Dexa组的细胞活力有所增高,但无统计学差异,而FLPNF(200 μmol/L)+Dexa组及FLPNF(400 μmol/L)+Dexa组的细胞活力均有显著增高(P < 0.001);FLPNF(200 μmol/L)+Dexa组与FLPNF(400 μmol/L)+ Dexa组的细胞活力无显著差异。表明短肽FLPNF与Dexa共同处理细胞时,FLPNF的保护效果较好,发挥最佳保护作用的浓度为200 μmol/L。
|
| A, the effect of drug adding sequence on the cell viability of INS-1 cells, ***P < 0.001 vs group Dexa, ## P < 0.01 vs group Dexa+FLPNF, Δ P < 0.05 vs group Dexa 48 h+FLPNF 72 h; B, the effect of different concentrations of FLPNF on INS-1 cell viability, *** P < 0.001 vs group Dexa, # P < 0.05 vs group FLPNF (100 μmol/L); C, the effect of FLPNF on dexamethasone-induced apoptosis of INS-1 cells, ** P < 0.001 vs group control, *** P < 0.001 vs group Dexa, ## P < 0.01 vs group Dexa. 图 1 CCK-8法检测各组INS-1细胞增殖活力 Fig.1 The proliferation viability of INS-1 cells detected by CCK-8 |
如图 1C所示,与Control组相比,Ghrelin组、FLPNF组及NFGAIL组INS-1细胞增殖活力无明显变化,Dexa组细胞活力则明显降低(P < 0.05)。与Dexa组相比,Dexa+Ghrelin组(32.1%)、Dexa+FLPNF组(18.7%)的细胞活力均有显著增加(P < 0.001,P < 0.05),Dexa+ NFGAIL组则无显著变化(P > 0.05)。经过Dexa处理的INS-1细胞的活力明显下降,而加入短肽FLPNF和Ghrelin均对Dexa诱导的INS-1细胞活力有显著改善。
2.2 FLPNF对Dexa诱导的INS-1细胞葡萄糖刺激胰岛素分泌功能的影响如图 2A所示,低糖(1.1 mmol/L)条件下,FLPNF组、Dexa组及Dexa+FLPNF组与对照组的胰岛素分泌量无显著差异;在高糖(20 mmol/L)刺激下,Dexa组的胰岛素分泌量显著减少,而Dexa+FLPNF组的胰岛素分泌量比Dexa组则有较为明显的增加。如图 2B所示,与对照组相比,FLPNF组的葡萄糖刺激胰岛素分泌刺激指数无明显变化,Dexa组则明显降低(P < 0.001),Dexa+FLPNF组虽然比对照组有明显降低,但比Dexa组则有明显增加(P < 0.05)。

|
| A, the percentage of insulin release in insulin content; B, stimulation index. *** P < 0.001 vs group control; # P < 0.05 vs group Dexa. 图 2 FLPNF对Dexa培养的INS-1细胞葡萄糖刺激胰岛素分泌功能的影响 Fig.2 Effect of FLPNF on glucose-stimulated insulin secretion in dexamethasone cultured INS-1 cells |
2.3 短肽FLPNF对Dexa诱导的INS-1细胞凋亡的影响
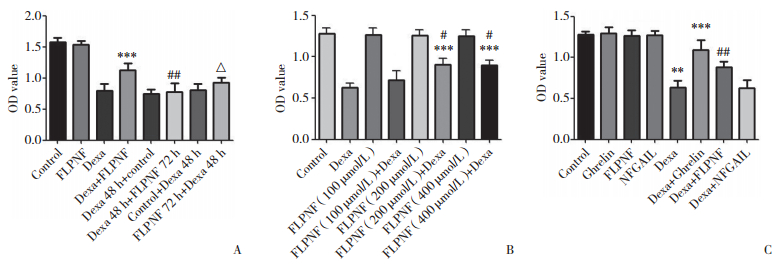
TUNEL法检测细胞凋亡的结果如图 3所示,空白对照组中较少见到细胞凋亡,相比之下,Dexa组与NFGAIL+Dexa组中细胞凋亡比例最高,两者无统计学差异;Ghrelin组、FLPNF组与空白对照组无明显差异,NFGAIL组稍有增加,但无统计学差异(P > 0.05);Ghrelin+Dexa组及FLPNF+Dexa组能观察到细胞凋亡,但比Dexa组细胞凋亡均有明显减少(P < 0.001)。
|
| A, apoptosis of INS-1 cells assessed by fluorescent microscopy (×40); B, apoptosis cells counts. * P < 0.01 vs group control; ** P < 0.001 vs group control; # P < 0.01 vs group Dexa. 图 3 TUNEL法检测短肽FLPNF对Dexa诱导的INS-1细胞凋亡的影响 Fig.3 Effect of oligopeptide FLPNF on dexamethasone-induced INS-1 cell apoptosis assessed by TUNEL |
如图 4所示,Annexin V-FITC/PI法检测细胞凋亡的结果与TUNEL法检测细胞凋亡的结果基本一致,空白对照组的细胞凋亡率较低,Dexa组和NFGAIL+Dexa组细胞凋亡率明显升高(P < 0.001),Ghrelin组、FLPNF组、NFGAIL组与空白对照组无明显差异(P > 0.05),Ghrelin+Dexa组及FLPNF+Dexa组的细胞凋亡率比Dexa组有明显降低(P < 0.001)。

|
| A, INS-1 cells analyzed by FACS, stained with annexin V/FITC/PI; B, apoptosis rate. *** P < 0.001 vs group control; ### P < 0.001 vs group Dexa; Δ P < 0.001, group Dexa+FLPNF vs group Dexa+Ghrelin. 图 4 Annexin V-FITC/PI流式细胞术检测细胞凋亡 Fig.4 Cell apoptosis detected by Annexin V-FITC/PI flow cytometry |
2.4 短肽FLPNF对Dexa诱导的INS-1细胞Bcl-2、Bax、caspase-3及Glut2蛋白表达的影响
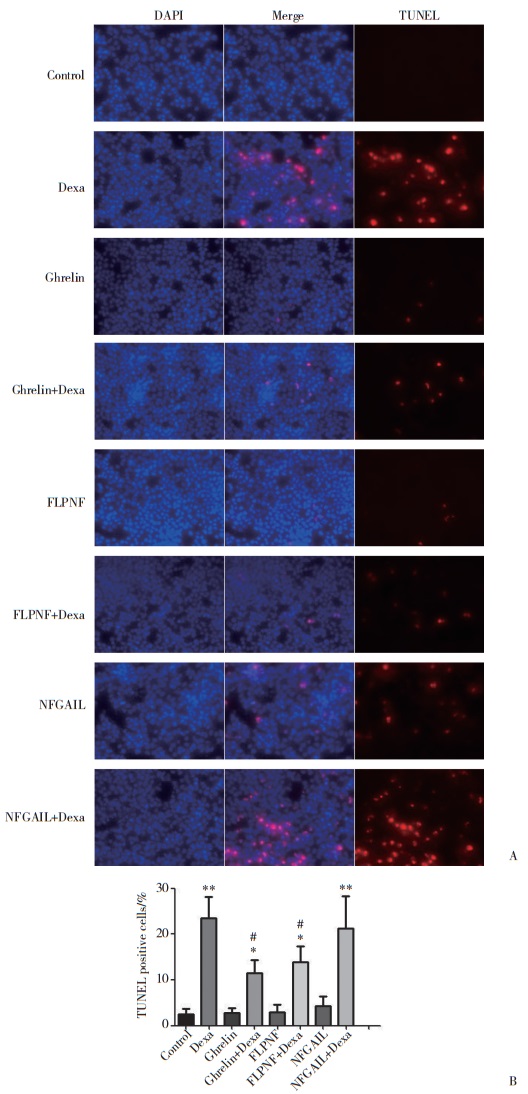
如图 5、6所示,Dexa组的Bcl-2、Glut-2表达水平较Control组显著降低(P < 0.05),经过FLPNF短肽处理后,Dexa+FLPNF组的Bcl-2、Glut-2表达明显升高(P < 0.05)。相反,Dexa组的Bax、cleaved caspase-3表达水平明显高于Control组(P < 0.05),而Dexa+FLPNF组的Bax、cleaved caspase-3表达较Dexa组则明显下降(P < 0.05)。

|
| A, Western blotting results; B, C, D, semiquantitative analysis. 1, group control; 2, group Dexa; 3, group Ghrelin; 4, group Ghrelin+Dexa; 5, group FLPNF; 6, group FLPNF+Dexa; 7, group NFGAIL; 8, group NFGAIL+Dexa. * P < 0.05 vs group control; # P < 0.05 vs group Dexa. 图 5 Western blotting检测INS-1细胞Bcl-2、Bax、cleaved caspase-3蛋白表达的变化 Fig.5 The protein expression changes of Bcl-2, Bax and cleaved caspase-3 in INS-1 cells detected by Western blotting |
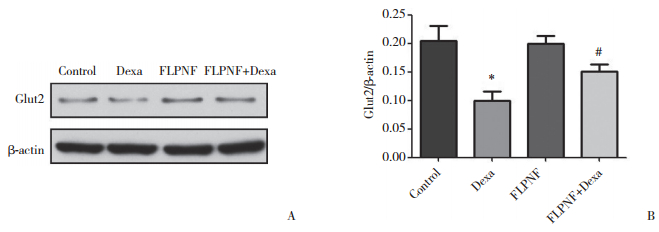
|
| A, Western blotting results; B, semiquantitative analysis. * P < 0.05 vs group control; # P < 0.05 vs group Dexa. 图 6 Western blotting检测FLPNF对Dexa培养的INS-1细胞Glut2蛋白表达的影响 Fig.6 The protein expression change of Glut2 in INS-1 cells detected by Western blotting |
3 讨论
糖皮质激素尽管对炎症性疾病、自身免疫病等多种疾病的治疗与预防具有显著成效[10-11],但其应用带来的胰岛并发症不可忽视。Dexa能产生氧自由基,促进胰岛细胞凋亡,减弱胰岛素的分泌功能[12]。前期研究结果表明,短肽FLPNF具有抗过表达hIAPP的胰岛细胞凋亡的作用,这种作用可能与短肽FLPNF与胰岛淀粉样沉淀的直接结合有关,也可能与其本身的促进增殖或抗凋亡作用有关。本研究通过Dexa诱导INS-1细胞凋亡,证明了短肽FLPNF能直接拮抗Dexa诱导的胰岛β细胞凋亡。
INS-1细胞在100 nmol/L Dexa的诱导下出现增殖活力降低,在加入短肽FLPNF后,细胞增殖虽未完全恢复正常,但已有了很大程度的提升。短肽FLPNF对正常增殖状态的INS-1细胞则无明显的促增殖作用。相比于正常细胞,短肽FLPNF可能更容易穿过被诱导凋亡的细胞的细胞膜,因此对凋亡的INS-1细胞具有更明显的作用。关于短肽FLPNF如何保护Dexa培养的INS-1细胞活力的机制,可能是直接发挥促增殖的作用,也可能是通过拮抗凋亡的过程而发挥作用。本研究中,相比于先后使用短肽FLPNF或Dexa处理细胞,短肽FLPNF与Dexa同期处理细胞的方式显示出更好的保护效果。此外,200 μmol/L FLPNF能起到较好的保护INS-1细胞活力的作用,而100 μmol/L FLPNF则不能发挥显著的保护作用,400 μmol/L FLPNF的效果与200 μmol/L FLPNF的保护作用无显著差异,因此,在后续实验中采用了200 μmol/L的浓度作为研究短肽FLPNF的浓度。本研究中,通过与阳性对照肽Ghrelin、阴性对照肽NFGAIL对比发现,短肽FLPNF虽具有一定保护INS-1细胞活力的作用,但其作用较Ghrelin稍差,这可能与其本身的作用较弱有关,也可能与其肽链不稳定有关。而相对阴性对照肽NFGAIL,FLPNF则有显著的保护作用,使胰岛细胞活力提升较为明显。
Glut是一类存在于细胞膜、负责由细胞外向细胞内转运葡萄糖的受体,分为Glut1、Glut2、Glut3、Glut4等几个主要亚型,分布于不同组织器官。啮齿类动物胰岛β细胞上主要表达Glut2,使该细胞对葡萄糖有较为敏感的反应。当葡萄糖浓度升高时,胰岛β细胞通过Glut2摄取葡萄糖,触发动作电位,使胰岛素释放入血液中,进而发挥降低血糖的作用。本研究结果显示,应用Dexa诱导胰岛细胞凋亡的同时,胰岛素受葡萄糖刺激引起排泌量减少,可能与Dexa导致Glut2表达下降有关。
胰岛细胞功能障碍的最直接表现是其胰岛素分泌功能的改变,胰岛素分泌方式、分泌量等改变都受胰岛细胞完整性的密切影响。胰岛素的产生过程是从PPI基因转录成PPI mRNA,并在内质网翻译成胰岛素前体物质,形成胰岛素原后转移至高尔基体。当血糖升高,Glut将葡萄糖转运入胞,刺激胰岛β细胞产生动作电位,由胰岛素原被切割成胰岛素与其他物质,形成分泌颗粒,由胰岛β细胞释放入血,从而发挥胰岛素的作用。有研究[13]发现,Dexa可以通过促进Glut2翻译后降解致Glut2蛋白表达减少,使胰岛细胞对葡萄糖刺激的敏感性大幅度下降,导致胰岛细胞内的胰岛素分泌颗粒不能正常分泌。前期蛋白组学预测发现,FLPNF具有促进Glut2表达的作用。本研究通过测定Dexa诱导INS-1细胞凋亡的状态下葡萄糖刺激胰岛素的释放量,证明FLPNF显著改善了Dexa培养的INS-1细胞的葡萄糖刺激胰岛素释放功能。
通过TUNEL法可以观察到INS-1细胞经不同药物处理后的细胞核形态及凋亡情况,而通过Annexin V-FITC/PI双染法则从凋亡率更具体地表现出不同药物处理后细胞的凋亡数目差异。本研究结果显示,用Dexa处理的INS-1细胞的凋亡细胞密度和凋亡率都有显著升高,而使用短肽FLPNF处理的细胞凋亡水平则有了明显的降低。
Dexa可通过多种途径导致胰岛β细胞凋亡及功能障碍。Bcl-2家族蛋白在凋亡通路中具有至关重要的作用,其中以Bcl-2与Bax蛋白的比例最为重要。Bcl-2是Bcl蛋白家族中的抗凋亡蛋白,Bax则是促凋亡蛋白,Bcl-2蛋白减少、Bax蛋白增加是凋亡通路的重要起始因素。随着Bcl-2/Bax的比例下降,线粒体膜的通透性逐渐增加,使线粒体内的物质如细胞色素c外流,进一步促进细胞凋亡的进展,导致caspase-3的升高。Dexa可通过降低Bcl-2/Bax的比例,促进线粒体通路细胞凋亡的发生[8]。本研究中,短肽FLPNF可拮抗Dexa的线粒体通路,使Bcl-2蛋白的表达明显升高,Bax蛋白的表达明显降低,抑制了线粒体通路的启动。
综上所述,本研究以大鼠胰岛素瘤INS-1细胞为研究对象,证实了短肽FLPNF能抑制Dexa诱导的胰岛细胞凋亡,促进其增殖,并改善胰岛细胞的葡萄糖刺激胰岛素分泌功能。本研究从细胞层面探讨和证明了FLPNF的抗凋亡作用,可能对临床应用糖皮质激素所产生的胰岛损伤的预防和治疗具有一定的临床意义。
| [1] |
COUTINHO AE, CHAPMAN KE. The anti-inflammatory and immunosuppressive effects of glucocorticoids, recent developments and mechanistic insights[J]. Mol Cell Endocrinol, 2011, 335(1): 2-13. DOI:10.1016/j.mce.2010.04.005 |
| [2] |
ROSE AJ, HERZIG S. Metabolic control through glucocorticoid hormones:an update[J]. Mol Cell Endocrinol, 2013, 380(1/2): 65-78. DOI:10.1016/j.mce.2013.03.007 |
| [3] |
HAJIALILO M, GHORBANIHAGHJO A, VALAEE L, et al. A double-blind randomized comparative study of triamcinolone hexacetonide and dexamethasone intra-articular injection for the treatment of knee joint arthritis in rheumatoid arthritis[J]. Clin Rheumatol, 2016, 35(12): 2887-2891. DOI:10.1007/s10067-016-3397-4 |
| [4] |
LUIJTEN RK, FRITSCH-STORK RD, BIJLSMA JW, et al. The use of glucocorticoids in systemic lupus erythematosus. After 60 years still more an art than science[J]. Autoimmun Rev, 2013, 12(5): 617-628. DOI:10.1016/j.autrev.2012.12.001 |
| [5] |
MUKHTYAR C, GUILLEVIN L, CID MC, et al. EULAR recommendations for the management of large vessel vasculitis[J]. Ann Rheum Dis, 2009, 68(3): 318-323. DOI:10.1136/ard.2008.088351 |
| [6] |
FRANSSON L, ROSENGREN V, SAHA TK, et al. Mitogen-activated protein kinases and protein phosphatase 5 mediate glucocorticoid-induced cytotoxicity in pancreatic islets and β-cells[J]. Mol Cell Endocrinol, 2014, 383(1/2): 126-136. DOI:10.1016/j.mce.2013.12.010 |
| [7] |
ROMA LP, SOUZA KL, CARNEIRO EM, et al. Pancreatic islets from dexamethasone-treated rats show alterations in global gene expression and mitochondrial pathways[J]. Gen Physiol Biophys, 2012, 31(1): 65-76. DOI:10.4149/gpb_2012_011 |
| [8] |
张城硕, 李乐, 张佳林, 等. 胃饥饿素通过抑制丝裂原活化蛋白激酶p38拮抗地塞米松诱导胰岛β细胞凋亡[J]. 中华实验外科杂志, 2015, 32(1): 191. DOI:10.3760/cma.j.issn.1001-9030.2015.01.073 |
| [9] |
KUTLU B, CARDOZO AK, DARVILLE MI, et al. Discovery of gene networks regulating cytokine-induced dysfunction and apoptosis in insulin-producing INS-1 cells[J]. Diabetes, 2003, 52(11): 2701-2719. DOI:10.2337/diabetes.52.11.2701 |
| [10] |
HEYING R, WEHAGE E, SCHUMACHER K, et al. Dexamethasone pretreatment provides antiinflammatory and myocardial protection in neonatal arterial switch operation[J]. Ann Thorac Surg, 2012, 93(3): 869-876. DOI:10.1016/j.athoracsur.2011.11.059 |
| [11] |
COURSEY TG, HENRIKSSON JT, MARCANO DC, et al. Dexamethasone nanowafer as an effective therapy for dry eye disease[J]. J Control Release, 2015, 213: 168-174. DOI:10.1016/j.jconrel.2015.07.007 |
| [12] |
SOMM E, VAUTHAY DM, GUÉRARDEL A, et al. Early metabolic defects in dexamethasone-exposed and undernourished intrauterine growth restricted rats[J]. PLoS One, 2012, 7(11): e50131. DOI:10.1371/journal.pone.0050131 |
| [13] |
GREMLICH S, RODUIT R, THORENS B. Dexamethasone induces posttranslational degradation of GLUT2 and inhibition of insulin secretion in isolated pancreatic beta cells. Comparison with the effects of fatty acids[J]. J Biol Chem, 1997, 272(6): 3216-3222. DOI:10.5897/IJEAPS2014.0344 |
 2019, Vol. 48
2019, Vol. 48