文章信息
- 杜信, 姜雅秋, 孙莹
- DU Xin, JIANG Yaqiu, SUN Ying
- 慢性碘过量对大鼠下丘脑Ⅱ型脱碘酶及血清促甲状腺激素释放激素水平的影响
- Effect of Chronic Iodine Excess on Type Ⅱ Deiodinase in Hypothalamus and Serum Thyrotropin Releasing Hormone Level in Rats
- 中国医科大学学报, 2019, 48(2): 97-100
- Journal of China Medical University, 2019, 48(2): 97-100
-
文章历史
- 收稿日期:2018-06-14
- 网络出版时间:2019-01-02 15:44
碘是甲状腺激素合成中不可或缺的元素。缺碘对人体健康构成严重威胁,使用碘化盐为世界范围内预防碘缺乏的常规策略[1-2]。然而,随着含碘盐在世界范围的常规化,已有大量研究[3-5]报道碘摄入过量现象已经开始出现。流行病学研究[6]表明,正常人群中血清促甲状腺激素(thyroid-stimulating hormone,TSH)水平升高,并且这与碘摄入量增加相关。因此,积极探索碘过量对甲状腺功能的影响机制具有潜在的临床价值。下丘脑-垂体-甲状腺轴的负反馈调节是维持血清甲状腺激素水平稳定性的最重要机制[7]。目前普遍认为,由下丘脑室旁核神经元释放的促甲状腺激素释放激素(thyrotropin releasing hormone,TRH)是参与调节下丘脑-垂体-甲状腺轴的重要分子,进而影响甲状腺功能。碘化甲状腺激素脱碘酶(脱碘酶)是一种硒蛋白酶,在调节甲状腺功能方面起到十分重要的作用[8]。广泛分布于下丘脑中的Ⅱ型脱碘酶(deiodinase type 2,D2)能够促进无活性的甲状腺素T4向有活性的T3转化,进而调控下丘脑-垂体-甲状腺轴[9]。D2表达也受到泛素化和内质网相关降解机制的重要调节,分别通过直接失活和抑制D2从头合成来降低D2活性[9-11]。为了阐明慢性碘过量对甲状腺功能的影响机制,本研究检测了慢性碘过量对大鼠下丘脑D2及血清TRH水平的影响,并探讨了大鼠下丘脑D2及血清TRH水平的相关性,为科学补碘提供新的理论依据。
1 材料与方法 1.1 实验动物选取180只4周龄Wistar大鼠(购自北京维通利华实验动物技术有限公司),雌雄参半,随机分为对照组和3倍、6倍、l0倍、50倍高碘组,分别给予双蒸水和浓度为277、692、1 245、6 788 μg/L的碘溶液合并普通饲料喂养4、8、12、24周。根据体质量将大鼠麻醉,腹部切开并采集心脏血,在离心机中离心20 min以分离血清,储存于-80 ℃冰箱。从心脏收集血液后用100~200 mL生理盐水灌流,处死大鼠,取出脑组织,迅速置于-40 ℃干冰中30 s后,放置于-80 ℃冰箱保存。
1.2 主要试剂碘化钠、10%水合氯醛(北京化学试剂公司),TRH试剂盒(武汉华美生物公司),辣根酶标二抗、DAB染色液(中杉金桥公司),D2一抗ab77481(英国Abcam公司),丙酮(生工生物工程上海股份有限公司)。
1.3 实验方法 1.3.1 大鼠血清TRH水平检测采用ELISA法检测,依据ELISA试剂盒说明书中所示步骤进行操作,实验于中国医科大学内分泌研究所进行。
1.3.2 大鼠下丘脑D2水平检测脑组织在下丘脑室旁核水平面上切成10 μm的冰冻切片,4 ℃冷丙酮固定。PBS冲洗3次,内源性过氧化物酶阻断,PBS冲洗3次,一抗孵育24 h,PBS冲洗3次,二抗温育20 min,PBS冲洗3次,DAB显色2 min,自来水冲洗,苏木精复染。梯度乙醇脱水,二甲苯透明,中性树胶封片。用机器拍摄照片,使用图像分析软件Image Pro Plus定量检测冰冻切片染色的结果。放大10倍,测量各组大鼠下丘脑第三脑室周围阳性染色的累积光密度。实验于中国医科大学内分泌研究所进行。
1.4 统计学分析采用SPSS 21.0统计软件进行处理和分析,数据用x±s表示。采用单因素方差分析比较多组间差异。P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠血清TRH水平4周时,与对照组相比,10倍、50倍高碘组血清TRH水平分别下降了0.36及0.34倍(P < 0.05);8周时,6倍、50倍高碘组与对照组相比分别下降了0.18及0.34倍(P < 0.05);12周时,6倍高碘组与对照组相比下降了0.17倍(P < 0.05);24周时,3倍、50倍高碘组与对照组相比分别下降了0.98及0.71倍(P < 0.05)。见表 1。
| Time point | NI | 3HI | 6HI | 10HI | 50HI |
| 4 weeks | 96.30±9.92 | 86.56±2.57 | 100.23±8.84 | 61.54±10.831) | 63.79±5.111) |
| 8 weeks | 26.65±2.00 | 29.94±3.41 | 21.80±1.161) | 25.01±3.95 | 17.49±3.301) |
| 12 weeks | 82.61±6.65 | 94.95±13.79 | 68.73±3.711) | 87.87±10.58 | 87.26±7.54 |
| 24 weeks | 71.31±6.02 | 17.68±2.771) | 74.21±3.88 | 64.47±4.90 | 20.64±1.721) |
| NI,normal iodine group;3HI,three-fold high iodine group;6HI,six-fold high iodine group;10HI,ten-fold high iodine group;50HI,fifty-fold high iodine group. 1)P < 0.05 vs NI group. | |||||
2.2 大鼠下丘脑D2水平
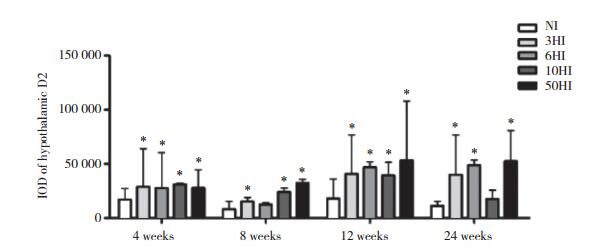
冰冻切片的免疫组化染色显示,在各个时间点各高碘组大鼠下丘脑D2水平较对照组均有所增加。见图 1~2。

|
| 图 1 大鼠下丘脑冰冻切片D2免疫组化染色照片×10 Fig.1 Hypothalamic frozen sections D2 immunohistochemical staining in rats ×10 |
|
| * P < 0.05 vs NI group. 图 2 各组大鼠下丘脑D2蛋白表达 Fig.2 Expression of D2 protein in the hypothalamus of rats in each group |
3 讨论
T3在中枢神经系统的发育和生理功能中发挥着重要作用,80%的大脑皮层在原代星形胶质细胞中使用T3。然而,人体血液中的甲状腺激素主要以T4的形式存在[12]。中枢神经系统中,通过脱碘酶D2将T4转化为T3是脑中T3的主要来源。因此,D2对维持中枢神经系统中甲状腺激素水平相对稳定起着重要作用。尽管随着碘浓度的变化,垂体D2的活性迅速而明显地变化,但是对于该条件调节下丘脑D2的定量分析鲜有研究报道。
D2在人体和大鼠的不同位置被发现,通常在大鼠中枢神经系统中发现,在人体甲状腺、棕色脂肪以及胎盘中也有发现。D2活性主要随着甲状腺功能的改变而改变,甲状腺功能减退症时垂体脱碘酶活性下降[7]。早期研究[13]表明,甲状腺功能减退大鼠循环中的T3恢复正常而不干预T4时,下丘脑室旁核表达的TRH mRNA水平不会恢复正常。因此,研究人员认为T3周期中T4转化参与了中枢神经系统的反馈调节机制[14],在一定程度上减少了脑中重要激素的波动联系。
下丘脑D2主要在伸长细胞中表达[9]。第三脑室伸长细胞位于正中隆起和侧壁之间的选择性双向运输路径上,特别是间质细胞、血液和脑脊液。D2 mRNA主要存在于脑中伸长细胞胞内,延伸到第三脑室,最终进入促垂体区域的TRH细胞中,从血液和脑脊液借由伸长细胞短突起摄取T3并进入下丘脑相应区域中。T4通过脱碘产生的T3被这种方法转移到TRH神经元中,从而影响TRH的释放[15]。最近研究[16]发现,伸长细胞中的焦谷氨酰肽可以降解下丘脑产生的TRH,影响TRH释放的浓度水平。
本课题组之前的研究[17]由过量碘引起的TSH升高得出结论:Wistar大鼠垂体TSHβ mRNA表达上调,Wistar大鼠垂体TSHβ蛋白增加。本研究结果显示,碘过量会增加D2在下丘脑中的表达,导致T4更多的转化为T3。T3经由MCT8转运体及伸长细胞进入室旁核的促垂体区域及合成TRH细胞区域内,抑制了下丘脑TRH的产生,进而降低了外周血清TRH表达水平,即大鼠下丘脑D2水平与血清TRH表达水平呈负相关。尽管在垂体中D2活性降低,使T3和T4的转换减少,导致T3对TSH的抑制作用减弱,最终导致TSH增加。但是在下丘脑中,碘过量使伸长细胞中的D2表达增加,增加了T3和T4的转换,T3对TRH的抑制作用增加,TRH降低。根据本研究可以推断,垂体水平TSH的升高不来源于下丘脑的TRH调节。然而,由于外周血中的TRH不仅来源于下丘脑,在伸长细胞中T3的运输依赖于MCT8调节,而伸长细胞表达的焦谷氨酰肽又能降解正中隆起释放的TRH,所以在碘过量致血清TRH下降的过程中,是否受到其他分子的干预及影响尚不明确,有待进一步研究。
综上所述,慢性碘过量可引起大鼠下丘脑D2表达水平增加及血清TRH水平降低,但该过程的具体机制有待继续探究,积极探讨慢性碘过量对甲状腺功能的影响机制对临床上科学补碘存在新的提示。
| [1] |
ZBIGNIEW S. Iodine prophylaxis in the lights of the last recommendation of WHO on reduction of daily salt intake[J]. Recent Pat Endocr Metab Immune Drug Discov, 2017, 11(1): 39-42. DOI:10.2174/1872214811666170608120810 |
| [2] |
MEKONNEN TC, ESHETE S, WASIHUN Y, et al. Availability of adequately iodized salt at household level in Dessie and Combolcha Towns, South Wollo, Ethiopia[J]. BMC Public Health, 2018, 18(1): 1152. DOI:10.1186/s12889-018-6066-5 |
| [3] |
CHEN Y, CHEN W, DU C, et al. Iodine nutrition and thyroid function in pregnant women exposed to different iodine sources[J]. Biol Trace Elem Res, 2018. DOI:10.1007/s12011-018-1530-8 |
| [4] |
HE Q, SU XH, LIU P, et al. Effect of reduction in iodine content of edible salt on the iodine status of the Chinese population[J]. Biomed Environ Sci, 2018, 31(9): 645-653. DOI:10.3967/bes2018.089 |
| [5] |
KIM HI, OH HK, PARK SY, et al. Non-immune-related hypothyroidism and its relationship with excess iodine[J]. Eur J Nutr, 2018. DOI:10.1007/s00394-018-1837-4 |
| [6] |
SUN X, SHAN Z, TENG W. Effects of increased iodine intake on thyroid disorders[J]. Endocrinol Metab (Seoul), 2014, 29(3): 240-247. DOI:10.3803/EnM.2014.29.3.240 |
| [7] |
ORTIGA-CARVALHO TM, CHIAMOLERA MI, PAZOS-MOURA CC, et al. Hypothalamus-pituitary-thyroid axis[J]. Compr Physiol, 2016, 6(3): 1387-1428. DOI:10.1002/cphy.c150027 |
| [8] |
SUN Z, SU Q, ROKITA SE. The distribution and mechanism of iodotyrosine deiodinase defied expectations[J]. Arch Biochem Biophys, 2017, 632: 77-87. DOI:10.1016/j.abb.2017.07.019 |
| [9] |
ARROJO E, DRIGO R, FONSECA TL, WERNECK-DE-CASTRO JP, et al. Role of the type 2 iodothyronine deiodinase (D2) in the control of thyroid hormone signaling[J]. Biochim Biophys Acta, 2013, 1830(7): 3956-3964. DOI:10.1016/j.bbagen.2012.08.019 |
| [10] |
ARROJO E, DRIGO R, FONSECA TL, CASTILLO M, et al. Endoplasmic reticulum stress decreases intracellular thyroid hormone activation via an eIF2a-mediated decrease in type 2 deiodinase synthesis[J]. Mol Endocrinol, 2011, 25(12): 2065-2075. DOI:10.1210/me.2011-1061 |
| [11] |
GEREBEN B, GONCALVES C, HARNEY JW, et al. Selective proteolysis of human type 2 deiodinase:a novel ubiquitin-proteasomal mediated mechanism for regulation of hormone activation[J]. Mol Endocrinol, 2000, 14(11): 1697-1708. DOI:10.1210/mend.14.11.0558 |
| [12] |
MULLUR R, LIU YY, BRENT GA. Thyroid hormone regulation of metabolism[J]. Physiol Rev, 2014, 94(2): 355-358. DOI:10.1152/physrev.00030.2013 |
| [13] |
LECHAN RM, FEKETE C. The TRH neuron:a hypothalamic integrator of energy metabolism[J]. Prog Brain Res, 2006, 153: 209-235. DOI:10.1016/s0079-6123(06)53012-2 |
| [14] |
FEKETE C, LECHAN RM. Negative feedback regulation of hypophysiotropic thyrotropin-releasing hormone (TRH) synthesizing neurons:role of neuronal afferents and type 2 deiodinase[J]. Front Neuroendocrinol, 2007, 28(2/3): 97-114. DOI:10.1016/j.yfrne.2007.04.002 |
| [15] |
NAKASHIMA M, KAWABE Y, AOYAGI T, et al. A case of eosinophilic myositis associated with orbital myositis[J]. Mod Rheumatol, 2002, 12(1): 80-83. DOI:10.3109/s101650200014 |
| [16] |
FONSECA TL, CORREA-MEDINA M, CAMPOS MP, et al. Coordination of hypothalamic and pituitary T3 production regulates TSH expression[J]. J Clin Invest, 2013, 123(4): 1492-1500. DOI:10.1172/JCI61231 |
| [17] |
LI N, JIANG Y, SHAN Z, et al. Prolonged high iodine intake is associated with inhibition of type 2 deiodinase activity in pituitary and elevation of serum thyrotropin levels[J]. Br J Nutr, 2012, 107(5): 674-682. DOI:10.1017/S0007114511003552 |
 2019, Vol. 48
2019, Vol. 48