文章信息
- 吴思, 吴盈盈, 于淼, 王爽, 崔畅婉, 孙峥嵘
- WU Si, WU Yingying, YU Miao, WANG Shuang, CUI Changwan, SUN Zhengrong
- 宫颈组织中Stat5b表达与宫颈病变的关系
- Relationship between Stat5b Expression in Cervical Tissues and Lesions
- 中国医科大学学报, 2019, 48(2): 144-148
- Journal of China Medical University, 2019, 48(2): 144-148
-
文章历史
- 收稿日期:2018-06-11
- 网络出版时间:2019-01-02 13:18
宫颈癌在全球范围内流行,最近新公布的数据显示每年大约有265 672例女性死于宫颈癌,并且每年新增病例大约为527 624例[1]。持续的高危型人类乳头瘤病毒(human papilloma virus,HPV)作用会导致宫颈病变乃至宫颈癌的发生[2]。为了建立持续感染,HPV必须通过先天性和适应性免疫反应来逃避监视,调节先天免疫反应的主要途径之一是Janus激酶信号转导和转录激活因子(Janus kinase-signal transducer and activator of transcription,JAK/Stats)途径。有研究[3]显示,HPV入侵宫颈细胞后可激活JAK/Stats通路,这对HPV的复制十分重要。
JAK/Stats通路中主要成员是Stat家族蛋白,由7个成员组成,包括Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b以及Stat6,其中Stat5a和Stat5b对于细胞的分化、凋亡、癌变以及免疫功能都有重要的调节作用[4-5]。小鼠中Stat5a和Stat5b由11号染色体转录[4],他们拥有超过94%的同源结构,均含有卷曲螺旋结构域、DNA结合结构域以及Src同源2结构域。Stat5a和Stat5b分别在Src同源结构域中第694和699位氨基酸进行酪氨酸磷酸化[4],磷酸化后可形成同源或者异源二聚体迁移至胞核与下游DNA结合,进而参与对下游基因的调控[6]。Stat5a和Stat5b尽管同源,但具有不同的功能,其中Stat5a缺失会使乳腺细胞发育受损,而Stat5b则与性别发育、癌细胞分化有关[7-8]。另一方面,Stat5b作为Stat5的主要亚型[3],其在细胞中的含量远远高于Stat5a,主要参与免疫炎症反应,调控细胞的增殖、分化和凋亡。本研究主要检测Stat5b以及其磷酸化形式p-Stat5b在宫颈病变中的表达变化,分析Stat5b和p-Stat5b与宫颈病变之间的关系。
1 材料与方法 1.1 临床资料选取2011年1月至2016年12月在中国医科大学附属盛京医院进行宫颈活检或者宫颈癌手术的患者标本,病理诊断分别为正常、低度鳞状上皮内病变(low-grade squamous intraepithelical lesion,LSIL)、高度鳞状上皮内病变(high-grade squamous intraepithelical lesion,HSIL)以及宫颈癌的宫颈组织石蜡切片,每组标本各20例,总计80例标本。
入选标准:(1)常规病理HE组织切片需得到至少2名有经验的病理学医师的一致诊断;(2)诊断必须符合组织学诊断标准。所有患者年龄为35~60岁,平均年龄43岁。
1.2 试剂和仪器Stat5b(产品货号:135300)、p-Stat5b(产品货号:PA538093)购自美国Thermo Fisher Scientific公司;PBS磷酸盐缓冲液(产品编号:ZLI-9062)、柠檬酸修复液(产品编号:ZLI-9064)、抗体稀释液(产品编号:ZLI-9030)、生物素标记二抗试剂盒(产品编号:SP-9000)购自北京中杉金桥生物技术有限公司。用已知阳性标本进行检测,以PBS代替一抗作为阴性对照。主要仪器有组织脱水机(ASP200S,德国Leica公司)、石蜡包埋机(ThermoHistoStarTM,美国Thermo Fisher Scientific公司)、石蜡组织切片机(Leica RM2245,德国Leica公司)、高压锅(YS24ED,中国苏泊尔公司)等。
1.3 实验方法检测标本来源于中国医科大学附属盛京医院生物样本库保存的正常宫颈组织及宫颈病变组织石蜡切片,采用免疫组织化学方法检测Stat5b和p-Stat5b的表达。主要步骤:(1)标本经4%中性甲醛固定,石蜡包埋,所有标本连续切片5张,厚度为3 μm,收至玻片,入58 ℃烤箱中烘干溶蜡3 h;(2)石蜡组织切片脱蜡水化(机械自动脱蜡);(3)经pH6.0柠檬酸修复液高温高压修复,高压锅喷气时开始计时,Stat5b修复时间为2 min,p-Stat5b修复时间为5 min;(4)滴加过氧化氢阻滞剂20 min,减少非特异性结合;(5)一抗孵育:Stat5b、p-Stat5b抗体均按1:200稀释为工作浓度,置于4 ℃冰箱孵育过夜;(6)滴加生物素标记的二抗,常温孵育30 min;(7)滴加DAB显色;(8)苏木精复染细胞核;(9)中性树胶封片剂封片,显微镜下观察。
1.4 结果判读方法选取400倍视野下进行评分。染色强度分数定义:阴性,0分;弱阳性,1分;中等阳性,2分;强阳性,3分。染色面积定义为5个等级:< 5%,0分;5%~25%,1分;> 25%~50%,2分;> 50%~75%,3分;> 75%,4分。评分范围在0~12分:0~6分为低表达,7~12分为高表达。每张组织在400倍视野下选取4~5个视野,对其评分结果取均值。
1.5 统计学分析利用SPSS 22.0统计软件,蛋白表达水平与宫颈病变程度的比较采用Spearman相关性分析,病变组间蛋白阳性率的比较采用χ2检验,检验水准α= 0.05。用Graphprism5.0绘制箱式图。
2 结果 2.1 Stat5b的表达与宫颈病变程度的相关性分析对80例宫颈组织切片进行Stat5b免疫组织化学分析,结果显示随着宫颈病变的进展Stat5b蛋白表达水平逐渐升高(图 1A)。20例正常宫颈组织中仅3例为高表达(15.0%,3/20),而在LSIL组织中未见高表达(0.0%,0/20),与正常组织相比略有下降,HSIL和宫颈癌组织中Stat5b的表达增加,其高表达比例分别为50.0%(10/20)和80.0%(16/20)。Spearman相关性分析显示,Stat5b蛋白表达水平与宫颈病变程度呈正相关(r = 0.570,P < 0.001)(图 1B)。按疾病的进展程度分为正常/低度病变和高度病变/宫颈癌,其中Stat5b在正常/低度病变组织中高表达比例为7.5%(3/40),在高度病变/宫颈癌高表达比例为65.0%(26/40),差异有统计学意义(χ2=26.180,P < 0.001)(图 1C)。
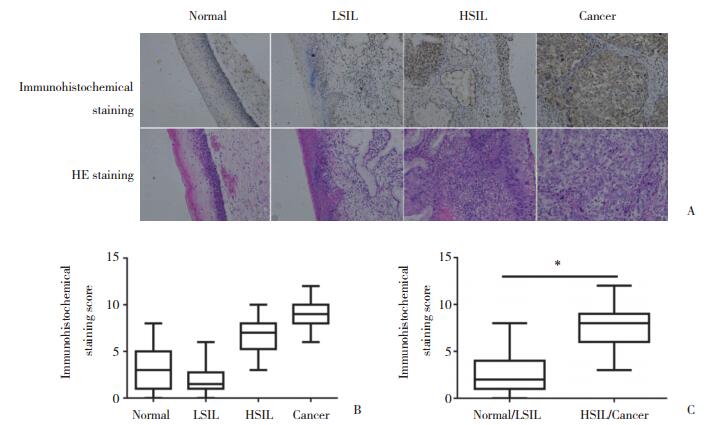
|
| A, immunohistochemical staining of Stat5b and corresponding HE staining images(×400);B, box plots represent Stat5b immunohistochemical staining scores in normal, LSIL, HSIL, and cancer tissues; C, box plots represent Stat5b immunohistochemical staining scores in normal/LSIL and HSIL/cancer tissues. * P < 0.05. 图 1 Stat5b在宫颈组织中的表达 Fig.1 The expression of Stat5b in cervical tissues |
2.2 p-Stat5b的表达随着宫颈病变程度的升高而降低
对80例标本进行p-Stat5b免疫组织化学分析,结果显示p-Stat5b蛋白表达水平随着宫颈病变程度的升高而降低(图 2A)。20例正常标本中16例为p-Stat5b高表达(80.0%,16/20),LSIL组织中p-Stat5b高表达比例为45.0%(9/20)。随着宫颈病变的进展,HSIL组织中p-Stat5b高表达比例仅为5.0%(1/20),同时对20例宫颈癌组织进行研究,发现p-Stat5b在宫颈癌中均无高表达(0.0%,0/20)。Spearman相关性分析显示,pStat5b蛋白表达水平与宫颈病变程度呈负相关(r = -0.668,P < 0.001)(图 2B)。按疾病的进展程度分为正常/低度病变和高度病变/宫颈癌,其中p-Stat5b在正常/低度病变组织中高表达比例为62.5%(25/40),在高度病变/宫颈癌高表达比例为2.5%(1/40),差异有统计学意义(χ2=30.142,P < 0.001)(图 2C)。

|
| A, immunohistochemical staining of p-Stat5b and corresponding HE staining images(×400);B, box plots represent p-Stat5b immunohistochemical staining scores in normal, LSIL, HSIL, and cancer tissues; C, box plots represent p-Stat5b immunohistochemical staining scores in nomal/LSIL and HSIL/ cancer tissues. * P < 0.05. 图 2 p-Stat5b在宫颈组织中的表达 Fig.2 Expression of p-Stat5b in cervical tissues |
3 讨论
Stat5是潜在的细胞质蛋白,由2种高度同源的同种型Stat5a和Stat5b组成[9]。Stat5基因已被证明在癌变过程中发挥重要作用,因为它参与促进细胞周期进程、细胞转化和预防细胞凋亡[10]。与其他Stat家族成员一样,Stat5通过磷酸化特定的酪氨酸残基而被激活,之后磷酸化的Stat5蛋白发生二聚化并转位至细胞核以调节基因转录[11]。有研究[12]证明,在前列腺癌中,Stat5的组成性活化与组织学分级和早期疾病复发相关。
本研究中,Stat5b随着宫颈病变的进展表达逐渐升高,这与SOBTI等[13]的研究结果相似,即大多数宫颈癌病例中观察到Stat5b表达水平升高,且Stat5b的过度表达也与宫颈癌病变的严重程度有关。这一结果在肝细胞癌的研究中也成立,表明Stat5b的表达与晚期肿瘤和癌细胞的侵袭行为显著相关[14]。SUMIYOSHI等[15]在胰腺癌的研究中也得到相似的结果,研究显示Stat5b在导管内乳头状黏液性良性腺瘤中不表达,在交界性导管内乳头状黏液性肿瘤中表达较高,且随着疾病进展,Stat5b在胰腺导管内乳头状黏液性腺癌中表达最高,其研究结果表明Stat5b蛋白可能促进导管内乳头状黏液性肿瘤的细胞增殖和进展。结肠癌细胞研究[16]中也证明了Stat5b蛋白的表达与TNM分期有关,且随着分期的升高表达量增加,该研究也表明Stat5b可能通过减少Bcl-2和生存素的表达,对结肠癌的进展产生影响。头颈部鳞状细胞癌研究[17]显示,阻断Stat5b可导致其下游靶基因cyclin D1和Bcl-xL的表达下调,上述靶基因促进细胞周期停滞,最终导致细胞凋亡,进而证明了Stat5b与肿瘤的发生、发展和治疗息息相关。因此,宫颈癌与Stat5b关系的研究有助于明确Stat5b在宫颈癌中发挥的作用,为以后宫颈癌的诊断及预后提供新的生化指标。
本研究还发现p-Stat5b的表达在宫颈病变进展过程中逐渐降低,在宫颈癌病例中低表达或不可检测。高危型HPV是宫颈病变发生及进展的主要病因,在几乎所有的宫颈癌细胞中均能检测HPV DNA的存在[18-19]。HONG等[20]在人类包皮上皮细胞中转染HPV病毒,并诱导其表达E6、E7蛋白,发现在有E6蛋白表达时p-Stat5b表达下降,由此推断E6蛋白可能导致p-Stat5b下降。Stat5b是Stat5的主要组成成员,在磷酸化水平上p-Stat5b也占据其主要成分,在宫颈组织中p-Stat5b的下降也可能与E6蛋白的表达有关[4]。此外有研究报道,宫颈病变进展是HPV基因组与宿主基因整合的结果[21],且随着宫颈病变程度的升高整合细胞所占比例也逐渐升高[22]。HPV整合可以分为2种类型:一种是单个基因组整合到细胞DNA中;另外一种是基因组的多个串联头对尾重复序列在某些情况下插入细胞的侧翼序列[23]。以上2种整合方式都可驱动致癌基因E6、E7的强表达[24],进而使p-Stat5b表达下降。
综上所述,Stat5b和p-Stat5b与宫颈病变的进展有关,且p-Stat5b的表达可能受致癌基因E6表达的影响,本研究对阐释宫颈癌发生发展的分子机制具有指导意义,为宫颈病变的早期诊断及筛查提供新的手段,亦可能为未来宫颈癌的治疗提供新的靶点。
| [1] |
SHRESTHA AD, NEUPANE D, VEDSTED P, et al. Cervical cancer prevalence, incidence and mortality in low and middle income countries:a systematic review[J]. Asian Pac J Cancer Prev, 2018, 19(2): 319-324. DOI:10.22034/APJCP.2018.19.2.319 |
| [2] |
ZHENG B, YANG H, LI Z, et al. HPV test results and histological follow-up results of patients with LSIL cervical cytology from the largest CAP-certified laboratory in China[J]. J Cancer, 2017, 8(13): 2436-2441. DOI:10.7150/jca.19421 |
| [3] |
HONG S, LAIMINS LA. The JAK-STAT transcriptional regulator, STAT-5, activates the ATM DNA damage pathway to induce HPV 31 genome amplification upon epithelial differentiation[J]. PLoS Pathog, 2013, 9(4): e1003295. DOI:10.1371/journal.ppat.1003295 |
| [4] |
ABLE AA, BURREL JA, STEPHENS JM. STAT5-interacting proteins:a synopsis of proteins that regulate STAT5 activity[J]. Biology (Basel), 2017, 6(1): E20. DOI:10.3390/biology6010020 |
| [5] |
KALTENECKER D, MUELLER KM, BENEDIKT P, et al. Adipocyte STAT5 deficiency promotes adiposity and impairs lipid mobilisation in mice[J]. Diabetologia, 2017, 60(2): 296-305. DOI:10.1007/s00125-016-4152-8 |
| [6] |
HORVATH CM. STAT proteins and transcriptional responses to extracellular signals[J]. Trends Biochem Sci, 2000, 25(10): 496-502. DOI:10.1016/S0968-0004(00)01624-8 |
| [7] |
HENNIGHAUSEN L, ROBINSON GW. Interpretation of cytokine signaling through the transcription factors STAT5A and STAT5B[J]. Gene Dev, 2008, 22(6): 711-721. DOI:10.1101/gad.1643908 |
| [8] |
LIN JX, DU N, LI P, et al. Critical functions for STAT5 tetramers in the maturation and survival of natural killer cells[J]. Nat Commun, 2017, 8(1): 1320. DOI:10.1038/s41467-017-01477-5 |
| [9] |
KLEJMAN A, SCHREINER SJ, NIEBOROWSKA-SKORSKA M, et al. The Src family kinase Hck couples BCR/ABL to STAT5 activation in myeloid leukemia cells[J]. EMBO J, 2002, 21(21): 5766-5774. DOI:10.1093/emboj/cdf562 |
| [10] |
CALÒ V, MIGLIAVACCA M, BAZAN V, et al. STAT proteins:from normal control of cellular events to tumorigenesis[J]. J Cell Physiol, 2003, 197(2): 157-168. DOI:10.1002/jcp.10364 |
| [11] |
WELTE T, LEITENBERG D, DITTEL BN, et al. STAT5 interaction with the T cell receptor complex and stimulation of T cell proliferation[J]. Science, 1999, 283(5399): 222-225. DOI:10.1126/science.283.5399.222 |
| [12] |
LI HZ, AHONEN TJ, ALANEN K, et al. Activation of signal transducer and activator of transcription 5 in human prostate cancer is associated with high histological grade[J]. Cancer Res, 2004, 64(14): 4774-4782. DOI:10.1158/0008-5472.CAN-03-3499 |
| [13] |
SOBTI RC, SINGH N, HUSSAIN S, et al. Deregulation of STAT-5 isoforms in the development of HPV-mediated cervical carcinogenesis[J]. J Receptor Signal Transduct Res, 2010, 30(3): 178-188. DOI:10.3109/10799891003786218 |
| [14] |
LEE TK, MAN K, POON RT, et al. Signal transducers and activators of transcription 5b activation enhances hepatocellular carcinoma aggressiveness through induction of epithelial-mesenchymal transition[J]. Cancer Res, 2006, 66(20): 9948-9956. DOI:10.1158/0008-5472.CAN-06-1092 |
| [15] |
SUMIYOSHI H, MATSUSHITA A, NAKAMURA Y, et al. Suppression of STAT5b in pancreatic cancer cells leads to attenuated gemcitabine chemoresistance, adhesion and invasion[J]. Oncol Rep, 2016, 35(6): 3216-3226. DOI:10.3892/or.2016.4727 |
| [16] |
DU W, WANG YC, HONG J, et al. STAT5 isoforms regulate colorectal cancer cell apoptosis via reduction of mitochondrial membrane potential and generation of reactive oxygen species[J]. J Cell Physiol, 2012, 227(6): 2421-2429. DOI:10.1002/jcp.22977 |
| [17] |
XI S, ZHANG Q, GOODING WE, et al. Constitutive activation of Stat5b contributes to carcinogenesis in vivo[J]. Cancer Res, 2003, 63(20): 6763-6771. |
| [18] |
BODA D, DOCEA AO, CALINA D, et al. Human papilloma virus:apprehending the link with carcinogenesis and unveiling new research avenues (Review)[J]. Int J Oncol, 2018, 52(3): 637-655. DOI:10.3892/ijo.2018.4256 |
| [19] |
ZHANG J, ZHANG S, WANG M, et al. Genetic variability in E5, E6, E7 and L1 genes of human papillomavirus type 31[J]. Mol Med Rep, 2018, 17(4): 5498-5507. DOI:10.3892/mmr.2018.8500 |
| [20] |
HONG SY, DUTTA A, LAIMINS LA. The acetyltransferase Tip60 is a critical regulator of the differentiation-dependent amplification of human papilloma viruses[J]. J Virol, 2015, 89(8): 4668-4875. DOI:10.1128/JVI.03455-14 |
| [21] |
BODELON C, UNTEREINER ME, MACHIELA MJ, et al. Genomic characterization of viral integration sites in HPV-related cancers[J]. Int J Cancer, 2016, 139(9): 2001-2011. DOI:10.1002/ijc.30243 |
| [22] |
MCBRIDE AA, WARBURTON A. The role of integration in oncogenic progression of HPV-associated cancers[J]. PLoS Pathog, 2017, 13(4): e1006211. DOI:10.1371/journal.ppat.1006211 |
| [23] |
JEON S, ALLEN-HOFFMANN BL, LAMBERT PF. Integration of human papillomavirus type 16 into the human genome correlates with a selective growth advantage of cells[J]. J Virol, 1995, 69(5): 2989-2997. |
| [24] |
LEUNG TW, LIU SS, LEUNG RCY, et al. HPV 16 E2 binding sites 1 and 2 become more methylated than E2 binding site 4 during cervical carcinogenesis[J]. J Med Virol, 2015, 87(6): 1022-1033. DOI:10.1002/jmv.24129 |
 2019, Vol. 48
2019, Vol. 48