文章信息
- 樊璐, 王慧, 肖庆桓
- FAN Lu, WANG Hui, XIAO Qinghuan
- 跨膜蛋白16F对乳腺癌细胞增殖及迁移的影响
- Effects of TMEM16F on the Proliferation and Migration of Breast Cancer Cells
- 中国医科大学学报, 2019, 48(2): 124-127
- Journal of China Medical University, 2019, 48(2): 124-127
-
文章历史
- 收稿日期:2018-10-23
- 网络出版时间:2019-01-02 15:57
跨膜蛋白16F(transmembrane protein16F,TMEM16F)又称作Anoctamin(ANO)6,是TMEM16家族的成员之一[1],是1个具有10次跨膜结构的蛋白。它在人类许多组织(胃上皮细胞、成骨细胞、淋巴细胞、血小板细胞、脉管系统以及肾脏)中都有表达[2],与多种疾病的发生发展密切相关。
TMEM16F结构还不明确,目前主要有3种说法:(1)TMEM16F具有磷脂翻转功能,这与其他TMEM16家族成员不同[3-4],在细胞膜上存在磷脂分布不对称性,外小叶上富含鞘磷脂和磷脂酰胆碱,内部小叶上含有磷酯酰丝氨酸和磷脂酰乙醇胺,这种磷脂不对称分布由一种依赖ATP的蛋白(scramblease)维持。无论在生理还是病理条件下Ca2+依赖的scramblease激活通过催化使磷酯酰丝氨酸快速外翻到细胞表面,而使这种膜不对称性崩塌[5]。(2)研究[6-7]发现,TMEM16F作为一种Ca2+激活的非选择性阳离子通道在血凝固期间能够对血小板造成磷脂翻转。(3)有研究[8]认为TMEM16F是Ca2+激活的阴离子通道。
2009年,研究[9]发现TMEM16家族中的很多成员都在肿瘤中过表达。研究[10]也发现TMEM16家族中的TMEM16A、TMEM16F、TMEM16K通常在同一组织中表达,并且TMEM16A基因定位于人类染色体11q13区域(amplicon core),此区域很多基因在乳腺癌、肺癌中高表达,且在癌症发生发展过程中都有重要作用[11]。2013年,有研究[12]表明在TMEM16F和TMEM16A稳定敲除的ELA细胞中,细胞迁移速率下降,并且TMEM16F会促进成肌细胞C2C12增殖[13-14]。TMEM16F与TMEM16A同源,TMEM16F与乳腺癌的相关性及对乳腺癌细胞迁移和增殖的影响还需进一步研究。本研究拟探讨TMEM16F在乳腺癌细胞中的表达,瞬时转染靶向TMEM16F的特异性shRNA到乳腺癌细胞T47D中,检测TMEM16F对乳腺癌细胞增殖和迁移的影响。
1 材料与方法 1.1 细胞培养乳腺癌MDA-MB-231、T47D细胞(均来自美国菌种保藏中心)于5%CO2、37 ℃的恒温箱内,在含10%胎牛血清(以色列Biological Industries公司)和1%青霉素和链霉素的DMEM胎牛血清培养液中培养。
1.2 转染鼠源TMEM16F的small hairpin RNA(shRNA,上海吉凯基因公司),序列为ATGTACTCACGTAGTGA TA,用scrambled shRNA(TTCTCCGAACGTGTCACGT)作为阴性对照。采用Lipofectamin 2000(美国Invitrogen公司)在无血清的培养基中瞬时转染T47D细胞的靶向TMEM16F特异性shRNA。转染48 h后将细胞用于后续实验。
1.3 Western blotting检测细胞转染48 h后将T47D细胞在含有RIPA缓冲液和蛋白酶抑制剂混合物(中国Beyotime公司)的冰冷裂解缓冲液中匀浆。在含有蛋白酶抑制剂和PMSF(细胞裂解缓冲液试剂盒,中国Beyotime Biotechnology公司)的冰冷RIPA缓冲液中,将细胞裂解物以13 400 r/min离心15 min,使用BCA方法测定蛋白质浓度。通过SDS-PAGE分离蛋白质,通过湿转膜方法转移到PVDF膜上。用5%的脱脂奶粉封闭,然后用TMEM16F抗体(1:1 000,美国Thermo公司)4 ℃下过夜孵育。用β-actin作为内参对照,然后将PVDF膜用与辣根过氧化物酶结合的山羊抗兔二抗(1:10 000,美国Abcam公司)室温下孵育1 h。使用显色增强的化学发光检测液ECL(美国BIO-RAD公司)进行显影。
1.4 CCK-8实验通过CCK-8试剂盒(中国Biosharp公司)检测细胞活力。将转染48 h后的T47D细胞(2×103/孔)接种到96孔板中。细胞在培养基中生长24 h后与CCK-8溶液一起温育2 h。采用酶标仪(美国Molecular Devices公司)450 nm波长测量。
1.5 细胞划痕实验细胞转染48 h后将细胞(1×106 /孔)接种在6孔板中。用200 μL移液管尖端轻轻刮擦汇合细胞,然后PBS轻轻洗涤。使用光学显微镜在0、24 h分别获得图像,并记录划痕面积。
1.6 统计学分析应用GraphPad Prism 62.02软件进行统计学分析,计量资料以x±s表示,2组比较采用t检验。每组实验重复3次,P < 0.05为差异有统计学意义。
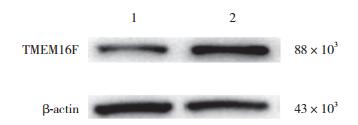
2 结果 2.1 乳腺癌细胞中TMEM16F蛋白表达结果显示,TMEM16F在乳腺癌细胞T47D及MDA-MB-231中均有表达,在乳腺癌细胞T47D表达水平高于乳腺癌细胞MDA-MB-231。可见TMEM16F与乳腺癌密切相关,见图 1。
|
| 1, MDA-MB-231 cells; 2, T47D cells. 图 1 乳腺癌细胞T47D和MDA-MB-231中TMEM16F表达比较 Fig.1 Western blotting reveals expression of TMEM16F in T47D and MDA-MB-231 cells |
2.2 2组乳腺癌细胞T47D中TMEM16F蛋白表达比较
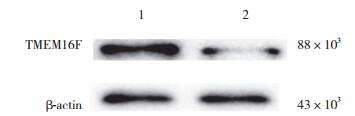
相对于转染TMEM16F scrambled shRNA组(1.00± 0.00),靶向TMEM16F的特异性shRNA组(0.42±0.12)对TMEM16F表达有明显抑制作用,2组比较差异有统计学意义(t = 6.072,P = 0.026 1)。
|
| 1, scrambled shRNA group; 2, specific shRNA group. 图 2 2组乳腺癌细胞T47D中TMEM16F蛋白表达比较 Fig.2 Western blotting reveals TMEM16F protein expression in T47D cells from both specific shRNA group and the control group |
2.3 敲除T47D乳腺癌细胞TMEM16F后对细胞增殖能力的影响
结果显示,特异性靶向TMEM16F的shRNA体外转染乳腺癌细胞T47D,敲除TMEM16F后T47D细胞增殖能力减弱。与对照组(scrambled shRNA组,1.00± 0.00)比较,敲除T47D细胞中TMEM16F后细胞增殖(0.50±0.14)差异有统计学意义(t = 5.055,P = 0.037 0)。
2.4 敲除T47D乳腺癌细胞TMEM16F后对细胞迁移能力的影响结果显示,转染TMEM16F shRNA后,T47D细胞的迁移能力增强,见图 3。与对照组[scrambled shRNA组,(31.45±0.94)%]比较,敲除T47D细胞中TMEM16F后的细胞迁移率[(46.74±0.42)%]增高,差异有统计学意义(t = 19.17,P = 0.002 7)。

|
| 图 3 敲除T47D乳腺癌细胞TMEM16F后对细胞迁移能力的影响×4 Fig.3 Migration ability upon TMEM16F knockdown in T47D breast cancer cells×4 |
3 讨论
研究[1]表明TMEM16家族参与多种生理功能(离子运输、磷脂翻转以及其他膜蛋白监管等)。Yu等[10]发现TMEM16家族中TMEM16F与TMEM16A密不可分,TMEM16F具有scramblease活性,而TMEM16A没有。并且通过TMEM16A与TMEM16F结合的杂交蛋白确定了TMEM16F区域负责scramblease活性。除此之外,scramblease区域电脑模型显示出它能够向细胞膜表面形成1个凹槽来帮助磷脂穿梭于细胞膜的双分子层,最终这个凹槽能够与其他的蛋白相互作用来调节磷脂翻转[10]。2013年研究[12]发现ELA细胞中稳定敲除TMEM16F和TMEM16A后细胞的迁移速率下降。但是TMEM16A和TMEM16F在细胞迁移过程中扮演不同角色,进而影响细胞迁移机制中的不同组分,TMEM16A更倾向于转向过程,TMEM16F更类似于迁移过程中的“引擎”,影响迁移速率[12]。研究[13-15]表明TMEM16A能够促进癌细胞增殖,TMEM16A在乳腺癌细胞中能够通过ERK/AKT信号通路促进乳腺癌细胞增殖。2014年ZHAO等[16]研究发现TMEM16F也可以通过ERK/AKT通路相似地调节C2C12细胞,促进成肌细胞增殖。
本研究结果证实,无论是三阴性乳腺癌细胞(MDA-MB-231),还是PR、ER阳性乳腺癌细胞(T47D)中,TMEM16F均表达,说明乳腺癌细胞与TMEM16F相关。CCK-8实验结果发现TMEM16F敲除后T47D细胞生存能力降低,证实TMEM16F可能促进T47D乳腺癌细胞增殖。细胞划痕实验发现TMEM16F敲除后的T47D细胞迁移率增加,证实TMEM16F可能会抑制T47D乳腺癌细胞的迁移。
综上所述,TMEM16F在T47D乳腺癌细胞中高表达,敲除TMEM16F能够抑制T47D乳腺癌细胞增殖而促进T47D乳腺癌细胞迁移。但TMEM16F在乳腺癌细胞增殖、迁移过程中具体作用机制需进一步研究。乳腺癌患者治疗通常采用全身、局部或者综合治疗[17]。虽然通过活检或者常规影像学和放射学检查可以获得相应的疾病进展状况,但在没有相应标志物的情况下可能导致治疗无效,因此寻找到新的靶向标志物至关重要。本研究提示TMEM16F可能成为乳腺癌细胞治疗的新的靶向标志物。
| [1] |
KUNZELMANN K, TIAN Y, MARTINS JR, et al. Anoctamins[J]. Pflugers Arch, 2011, 462(2): 195-208. DOI:10.1007/s00424-011-0975-9 |
| [2] |
TOSHIHIRO F, ASUKA S, SATOSHI N, et al. TMEM16F is required for phosphatidylserine exposure and microparticle release in activated mouse platelets[J]. Proc Natl Acad Sci USA, 2015, 112(41): 12800-12805. DOI:10.1073/pnas.1516594112 |
| [3] |
GYOBU S, ISHIHARA K, SUZUKI J, et al. Characterization of the scrambling domain of the TMEM16 family[J]. Proc Natl Acad Sci USA, 2017, 114(24): 6274-6279. DOI:10.1073/pnas.1703391114 |
| [4] |
SUZUKI J, UMEDA M, SIMS PJ, et al. Calcium-dependent phospholipid scrambling by TMEM16F[J]. Nature, 2010, 468(7325): 834-838. DOI:10.1038/nature09583 |
| [5] |
LIU G, LIU G, CHEN H, et al. Involvement of Ca2+ activated Cl-channel Ano6 in platelet activation and apoptosis[J]. Cell Physiol Biochem, 2015, 37(5): 1934-1944. DOI:10.1159/000438554 |
| [6] |
SCHENK LK, SCHULZE U, HENKE S, et al. TMEM16F regulates baseline phosphatidylserine exposure and cell viability in human embryonic kidney cells[J]. Cell Physiol Biochem, 2016, 38(6): 2452-2463. DOI:10.1159/000445596 |
| [7] |
YANG H, KIM A, DAVID T, et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation[J]. Cell, 2012, 151(1): 111-122. DOI:10.1016/j.cell.2012.07.036 |
| [8] |
GRUBB S, POULSEN KA, JUUL CA, et al. TMEM16F (Anoctamin 6), an anion channel of delayed Ca2+ activation[J]. J Gen Physiol, 2013, 141(5): 585-600. DOI:10.1085/jgp.201210861 |
| [9] |
GALINDO BE, VACQUIER VD. Phylogeny of the TMEM16 protein family:some members are overexpressed in cancer[J]. Inter J Mol Med, 2005, 16(5): 919-924. DOI:10.1089/hum.2005.16.1346 |
| [10] |
YU K, WHITLOCK JM, LEE K, et al. Identification of a lipid scrambling domain in ANO6/TMEM16F[J]. elife, 2015, 4: e06901. DOI:10.7554/eLife.06901 |
| [11] |
AKERVALL JA, JIN Y, WENNERBERG JP, et al. Chromosomal abnormalities involving 11q13 are associated with poor prognosis in patients with squamous cell carcinoma of the head and neck[J]. Cancer, 1995, 76(5): 853-859. DOI:10.1002/(ISSN)1097-0142 |
| [12] |
JACOBSEN KS, ZEEBERG K, SAUTER DR, et al. The role of TMEM16A (ANO1) and TMEM16F (ANO6) in cell migration[J]. Pflugers Archiv, 2013, 465(12): 1753-1762. DOI:10.1007/s00424-013-1315-z |
| [13] |
BRITSCHGI A, BILL A, BRINKHAUS H, et al. Calcium-activated chloride channel ANO1 promotes breast cancer progression by activating EGFR and CAMK signaling[J]. Proc Natl Acad Sci USA, 2013, 110(11): E1026-E1034. DOI:10.1073/pnas.1217072110 |
| [14] |
WU H, WANG H, GUAN S, et al. Cell-specific regulation of proliferation by Ano1/TMEM16A in breast cancer with different ER, PR, and HER2 status[J]. Oncotarget, 2017, 8(49): 84996-85013. DOI:10.18632/oncotarget.18662 |
| [15] |
STANICH JE, GIBBONS SJ, EISENMAN ST, et al. Ano1 as a regulator of proliferation[J]. Am J Physiol Gastroint Liver Physiol, 2011, 301(6): G1044-G1051. DOI:10.1152/ajpgi.00196.2011 |
| [16] |
ZHAO P, TORCASO A, MARIANO A, et al. Anoctamin 6 regulates C2C12 myoblast proliferation[J]. PLos One, 2014, 9(3): e92749. DOI:10.1371/journal.pone.0092749 |
| [17] |
AKTAS B, KASIMIR-BAUER S, MÜLLER V, et al. Comparison of the HER2, estrogen and progesterone receptor expression profile of primary tumor, metastases and circulating tumor cells in metastatic breast cancer patients[J]. BMC Cancer, 2016, 16: 522. DOI:10.1186/s12885-016-2587-4 |
 2019, Vol. 48
2019, Vol. 48