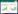文章信息
- 崔梦莹, 郭澍, 佟爽, 张华, 朱梦茹, 陈义庆, 魏松乔
- CUI Mengying, GUO Shu, TONG Shuang, ZHANG Hua, ZHU Mengru, CHEN Yiqing, WEI Songqiao
- 脂肪干细胞来源外泌体通过Wnt/β-catenin信号通路促进脂肪干细胞成骨分化
- Exosomes Promote Osteoblastic Differentiation of Adipose-Derived Stem Cells by Activating the Wnt/β-catenin Signaling Pathway
- 中国医科大学学报, 2019, 48(2): 114-118
- Journal of China Medical University, 2019, 48(2): 114-118
-
文章历史
- 收稿日期:2018-08-23
- 网络出版时间:2019-01-02 15:52
脂肪干细胞(adipose-derived stem cells,ADSCs)能够分化为成骨细胞[1],但仅依赖ADSCs向成骨分化的能力不足以修复骨缺损。研究[2]发现,间充质干细胞促进组织修复不仅通过直接分化为靶细胞起到修复与替代作用,而且通过成熟细胞旁分泌机制刺激邻近未成熟细胞受体产生活性。细胞通过转运必须内体分选复合物(endosomal sorting complex required for transport,ESCRT)以胞吐的方式分泌囊泡,该囊泡选择性包裹蛋白质、mRNAs和miRNAs,命名为外泌体(exosome,EXO)[3]。外泌体参与细胞间的交流,发挥修复再生的功能[4]。近年来,脂肪干细胞来源的外泌体(ADSCs-derived exosomes,ADSCs-EXO)在身体各系统中的再生修复作用逐渐被证实。
RNARAYANAN等[5]证明EXO可以促进间充质干细胞分化为成骨细胞系,促进骨再生[6-8]。然而,EXO究竟如何发挥作用目前尚不清晰。研究[9-10]发现,Wnt通路参与细胞增殖、分化、凋亡等生长过程的调节,对于ADSCs成骨分化更为重要。因此,推测ADSCs-EXO可能通过激活Wnt/β-catenin通路促进ADSCs成骨分化。本研究从验证ADSCs-EXO促进ADSCs成骨分化着手,重点探究其与Wnt/β-catenin通路的关系。
1 材料与方法 1.1 材料本研究于2017年11月至2018年4月在中国医科大学附属第一医院整形外科进行,使用抽吸的人大腿皮下脂肪组织(24岁女性志愿者,身体健康;受试者已签署知情同意书,且通过伦理委员会审查)。胎牛血清和胰蛋白酶购自美国Gibco公司;PBS和DMEM/F12(1:1)购自美国Hyclone公司;Ⅰ型胶原酶和地塞米松磷酸钠,TritoX-100购自美国Sigma公司;抗坏血酸购自美国Wako公司;抗β-catenin多克隆抗体购自美国CST公司;DKK1购自以色列Prospec公司;碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒、BCA蛋白浓度测定试剂盒和SDS-PAGE凝胶配制试剂盒等购自中国碧云天生物技术公司。
1.2 ADSCs的分离培养抽吸大腿皮下脂肪组织约200 mL,无菌环境下分装并洗涤2次,去除大块纤维组织,以0.1%Ⅰ型胶原酶处理45 min,终止消化后800 r/min室温离心5 min,重悬离心2次。细胞悬液均匀种植于75 cm2培养瓶中,标记为P0代。于37 ℃,5% CO2环境培养,当细胞生长至80%~90%后以一定比例传代。培养至三代(P3)备用[11]。
1.3 ADSCs鉴定 1.3.1 ADSCs向成骨分化能力鉴定待P3代ADSCs细胞生长至80%~90%时,更换为成骨诱导液,培养21 d后弃上清并洗涤,4%多聚甲醛溶液固定5 min,茜素红染液染色20 min,倒置相差显微镜(日本Olmpus CX22)下观察并拍照。
1.3.2 ADSCs向成软骨分化能力鉴定待P3代ADSCs细胞生长至80%~90%时,消化并重悬,更换为成软骨诱导液,换液前后100 g室温离心5 min,28 d后经阿尔法蓝染色30 min,倒置相差显微镜下观察并拍照。
1.4 ADSCs的成骨诱导及EXO分离鉴定 1.4.1 配制成骨诱导液地塞米松磷酸钠10-8 mol/L+抗坏血酸0.1 mmol/L+ DMEM/ F12。待P3代ADSCs细胞生长至80%~90%时,更换为成骨诱导液(不含血清),后每隔2~3 d更换成骨诱导液(含血清),交替换液至21 d。收集不含血清的上清液。将上清液2 000 g 4 ℃下离心30 min,弃去沉淀。20 000 g 4 ℃下离心1 h,弃去沉淀,重复1次。100 000 g 4 ℃下离心1 h,弃去上清,PBS洗涤后重复1次,弃去上清后200 μL预冷PBS重悬,标记为ADSCs-EXO。
1.4.2 透射电镜观察ADSCs-EXO形态取分离纯化的10 μL ADSCs-EXO滴于300目载样铜网上,3%磷钨酸溶液负染1 min,晾干,透射电镜观察。
1.4.3 ADSCs-EXO蛋白定量检测低温裂解ADSCs-EXO,按BCA试剂盒说明书测定蛋白浓度。电泳后,根据分子量截取目的条带(CD63:53 000,CD9:28 000),湿法转膜,5%脱脂奶粉室温孵育2 h,CD63(1:500)、CD9(1:500),4 ℃孵育12 h。二抗(1:2 000)室温孵育1 h,采用ECL显影。
1.5 分组另取P3代ADSCs,当细胞融合至80%~90%时,以浓度为15 μg/mL的ADSCs-EXO与其共培养,设为实验组(ADSCs+普通培养液+ADSCs-EXO),另外设置Control组(ADSCs+普通培养液),阳性对照组(ADSCs+成骨诱导液)和抑制剂组(ADSCs+普通培养液+ADSCs-EXO+100 ng/mL DKK1)。
1.6 检测ADSCs-EXO对ADSCs成骨分化作用 1.6.1 ALP活性检测P3代ADSCs均匀接种于24孔板中,每组3个复孔,当细胞融合至80%~90%时按分组处理,第12天时,弃去上清液,各孔加入0.1%TritonX-100 250 μL以充分裂解细胞,10 000 r/min 4 ℃离心10 min,收集上清液,按试剂盒要求操作,测定405 nm吸光度(optical density,OD),酶活性以OD值表示。
1.6.2 检测矿化结节P3代ADSCs均匀接种于12孔板中,每组3个复孔,当细胞融合至80%~90%时按分组处理,第21天时,弃去上清液,反复漂洗,4%多聚甲醛2 mL室温固定5 min,茜素红染液室温染色20 min,观察并拍摄。
1.7 Western blotting检测各组经典Wnt/β-catenin通路相关蛋白的表达情况于75 cm2培养瓶中培养P3代ADSCs,当融合约80%~90%时按各组处理,于第7天时收集细胞,弃去上清液,按BCA试剂盒说明书测定蛋白浓度。电泳后,根据分子量截取目的条带(β-catenin:92×103),封闭2 h,β-catenin(1:1 000),4 ℃孵育12 h。二抗(1:4 000)室温孵育1 h,采用ECL显影。
1.8 统计学分析以β-actin为内参,应用Image J软件对Western blotting条带进行灰度扫描及半定量分析,采用SPSS 17.0软件进行统计学分析,结果采用独立样本t检验进行比较,P < 0.05为差异有统计学意义。
2 结果 2.1 ADSCs生长特性及鉴定P3代ADSCs呈长梭形,束状或漩涡状排列,胞核位于正中,细胞轮廓清晰,见图 1。

|
| 图 1 P3代ADSCs形态×50 Fig.1 Morphological assessment of P3-ADSCs ×50 |
P3代ADSCs成骨诱导培养至6 d时,部分细胞形态由长梭形变为多角形,诱导培养至12 d时,细胞质内充满颗粒状物,细胞间可见钙质沉积,14 d时,镜下可见少量结节,21 d茜素红染色可见橘红色结节。在成软骨诱导条件下,可见细胞内基质均匀蓝染,表明诱导后的软骨细胞内含有糖胺聚糖(图 2)。因此ADSCs能够向成骨、成软骨分化,具有多向分化潜能。
|
| A, alizarin red staining (×100); B, alcian blue staining (×20). 图 2 ADSCs的鉴定 Fig.2 Identification of ADSCs |
2.2 ADSCs-EXO的结构形态及鉴定
透射电镜下观察发现,ADSCs-EXO呈现圆形或椭圆形环状结构,有完整的双层膜结构,直径30~100 nm(图 3A)。离心200 mL上清液可获得ADSCs-EXO约100 μg/mL。检测ADSCs-EXO与ADSCs的CD9、CD63蛋白表达量,以β-actin为内参,可见ADSCs-EXO特异性蛋白CD9、CD63表达量明显(图 3B),进一步证明超速离心提取沉淀为ADSCs-EXO。

|
| A, ADSCs-EXO; B, Western blotting analysis of CD9 and CD63 expression. 图 3 ADSCs-EXO的形态观察及鉴定 Fig.3 Morphological assessment and identification of ADSCs-EXO |
2.3 ADSCs-EXO对ADSCs成骨分化作用
课题组前期研究发现15 μg/mL ADSCs-EXO对于ADSCs成骨分化作用最强。为评估ADSCs-EXO对ADSCs成骨诱导作用,检测各组培养12 d后的ALP水平,发现实验组ALP活性显著升高,OD值为2.702±0.13,与空白对照组OD值(1.54±0.247)相比,差异有统计学意义(P < 0.05)。阳性对照组OD值为3.015±0.266,与实验组相比,差异无统计学意义。抑制剂组OD值为2.031±0.06,与实验组相比差异有统计学意义(P < 0.05)。
检测P3代ADSCs培养21 d后矿化情况,实验组可见明显橘红色钙化结节,但相比于阳性对照组钙化结节较少,而空白对照组未见橘红色钙化结节,抑制剂组可见矿化结节,但数量较实验组减少,见图 4。

|
| A, N-control group; B, experimental group; C, positive control group; D, DKK1 group. 图 4 茜素红检测各组矿化结节情况×100 Fig.4 Detection of osteoblast mineralization by alizarin red staining ×100 |
2.4 Wnt/β-catenin通路影响ADSCs成骨分化
P3代ADSCs经ADSCs-EXO处理后,其Wnt/β-catenin信号通路相关蛋白β-catenin表达量灰度值(2.539± 0.110)上调,与空白对照组灰度值(1.826±0.041)相比,差异有统计学意义(P < 0.05),较阳性对照组蛋白表达量灰度值(3.281±0.178)略低,差异有统计学意义(P < 0.05)。加入100 ng/mL DKK1的抑制剂组β-catenin表达量灰度值(1.604±0.084)较实验组明显降低,且差异有统计学意义(P < 0.01),见图 5。
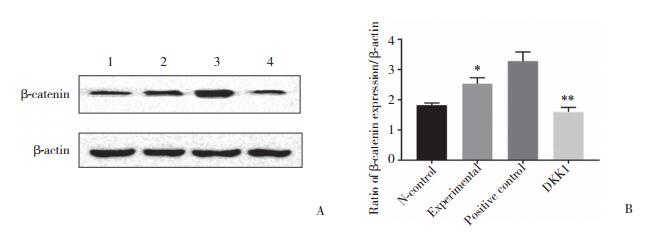
|
| A, Western blotting; B, relative expression of β-catenin. * P < 0.05 vs N-control group; **P < 0.01 vs experimental group. 1, N-control group; 2, experimental group; 3, positive control group; 4, DKK1 group. 图 5 各组β-catenin蛋白表达量Western blotting检测结果 Fig.5 Expression of β-catenin by Western blotting |
3 讨论
EXO在细胞交流中起到不可或缺的作用,相比较于直接细胞疗法,EXO具有如下的优点:(1)便于存储与转移;(2)无恶变倾向;(3)免疫排斥可能性较低;(4)生物效能高;(5)生物安全性高[12]。间充质干细胞释放的EXO能够修复受损组织[13]。基于这些因素,本研究提取ADSCs-EXO代替成骨诱导液作用于ADSCs。课题组前期的浓度梯度研究,确定15 μg/mL的ADSCs-EXO促进成骨分化能力较强。
空白对照组ALP活性较低,且茜素红染色没有钙结节产生,证明了ADSCs在普通培养基中无成骨分化能力,而在含有ADSCs-EXO的普通培养基中向成骨细胞分化。与研究者提取成骨细胞EXO,促进骨髓间充质干细胞成骨分化相一致[14]。由于促成骨分化后的ADSCs与成骨细胞成分及功能相似,EXO中携带有促进成骨相关蛋白及RNAs,因此,ADSCs-EXO被ADSCs内化后能够通过信号通路或调控基因的方式发挥促成骨分化的作用,同时当ADSCs受ADSCs-EXO影响后向成骨细胞分化时,也能分泌具有促成骨分化能力的EXO,进而加速周围ADSCs的成骨分化进程,形成一个正反馈机制。
经典Wnt/β-catenin通路是参与干细胞成骨分化的重要通路之一,在ADSCs成骨分化过程中,Wnt家族发挥重要作用[15-16]。β-catenin是此通路中关键调节分子,β-catenin广泛存在于细胞质内,受到Wnt信号激活后转入细胞核内,调节目标基因RUNX2[15-17],促进ADSCs成骨分化。Wnt/β-catenin信号通路抑制剂DKK1与LRP5受体结合,竞争性抑制WNT配体蛋白,影响β-catenin水平,进而影响成骨分化过程[18]。ADSCs-EXO与ADSCs共培养,加入终浓度为100 ng/mL的DKK1时,即可对Wnt通路产生较强的抑制作用。本研究发现,加入ADSCs-EXO的ADSCs分化过程中β-catenin的水平明显较高,而当加入Wnt/β-catenin抑制剂DKK1后,ADSCs-EXO组β-catenin的表达水平明显降低,成骨分化能力减弱。ALP检测与茜素红染色发现,ADSCs-EXO组水平明显高于空白对照组,而加入DKK1后ALP水平与矿化结节相比于实验组成骨分化能力降低,但仍较空白对照组强。说明Wnt通路并不是ADSCs-EXO促进ADSCs成骨分化过程的唯一通路,ADSCs-EXO通过通路网络实现修复功能,而不是通过单一的通路促进组织再生修复,这些通路有待进一步探索。此外,ADSCs-EXO如何取代成骨诱导液发挥促进ADSCs成骨分化的作用,以及ADSCs-EXO中的哪些被分选分子发挥作用,将有待进一步研究。
综上所述,本研究首次证实ADSCs-EXO可以活化ADSCs中的Wnt/β-catenin信号通路,促进ADSCs成骨分化,并为进一步研究干细胞来源的EXO在促进ADSCs成骨分化的机制奠定了基础。
| [1] |
GRIFFIN MF, IBRAHIM A, SEIFALIAN AM, et al. Chemical group-dependent plasma polymerisation preferentially directs adipose stem cell differentiation towards osteogenic or chondrogenic lineages[J]. Acta Biomater, 2017, 301(50): 450-461. DOI:10.1016/j.actbio.2016.12.016 |
| [2] |
HU GW, LI Q, NIU X, et al. Exosomes secreted by human-induced pluripotent stem cell-derived mesenchymal stem cells attenuate limb ischemia by promoting angiogenesis in mice[J]. Stem Cell Res Ther, 2015, 6(1): 1-15. DOI:10.1186/scrt546 |
| [3] |
THERY C, ZITVOGEL L, AMIGORENA S. Exosomes:composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2(8): 569-579. DOI:10.1038/nri855 |
| [4] |
VAN NIEL G, D'ANGELO G, RAPOSO G. Shedding light on the cell biology of extracellular vesicles[J]. Nat Rev Mol Cell Biol, 2018, 19(4): 213-228. DOI:10.1038/nrm.2017.125 |
| [5] |
NARAYANAN R, HUANG CC, RAVINDRAN S. Hijacking the cellular mail:exosome mediated differentiation of mesenchymal stem cells[J]. Stem Cells Int, 2016, 2016(3808674): 1-11. DOI:10.1155/2016/3808674 |
| [6] |
LIANG X, DING Y, ZHANG Y, et al. Paracrine mechanisms of mesenchymal stem cell-based therapy:current status and perspectives[J]. Cell Transplant, 2014, 23(9): 1045-1059. DOI:10.3727/096368913X667709 |
| [7] |
HAO ZC, LU J, WANG SZ, et al. Stem cell-derived exosomes:a promising strategy for fracture healing[J]. Cell Prolif, 2017, 50(5): e12359. DOI:10.1111/cpr.12359 |
| [8] |
LIN R, WANG S, ZHAO RC. Exosomes from human adipose-derived mesenchymal stem cells promote migration through Wnt signaling pathway in a breast cancer cell model[J]. Mol Cell Biochem, 2013, 383(1/2): 13-20. DOI:10.1007/s11010-013-1746-z |
| [9] |
GUIDOTTI S, FACCHINI A, PLATANO D, et al. Enhanced osteoblastogenesis of adipose-derived stem cells on spermine delivery via beta-catenin activation[J]. Stem Cells Dev, 2013, 22(10): 1588-1601. DOI:10.1089/scd.2012.0399 |
| [10] |
D'ALIMONTE I, LANNUTTI A, PIPINO C, et al. Wnt signaling behaves as a "master regulator" in the osteogenic and adipogenic commitment of human amniotic fluid mesenchymal stem cells[J]. Stem Cell Rev, 2013, 9(5): 642-654. DOI:10.1007/s12015-013-9436-5 |
| [11] |
WANG T, GUO S, LIU X, et al. Protective effects of adipose-derived stem cells secretome on human dermal fibroblasts from ageing damages[J]. Int J Clin Exp Pathol, 2015, 8(12): 15739-15748. |
| [12] |
CHEN F, ZHANG H, WANG Z, et al. Adipose-derived stem cell-derived exosomes ameliorate erectile dysfunction in a rat model of type 2 diabetes[J]. J Sex Med, 2017, 14(9): 1084-1094. DOI:10.1016/j.jsxm.2017.07.005 |
| [13] |
HAN C, SUN X, LIU L, et al. Exosomes and their therapeutic potentials of stem cells[J]. Stem Cells Int, 2016, 2016(7/8): 1-11. DOI:10.1155/2016/7653489 |
| [14] |
CUI Y, LUAN J, LI H, et al. Exosomes derived from mineralizing osteoblasts promote ST2 cell osteogenic differentiation by alteration of microRNA expression[J]. FEBS Lett, 2016, 590(1): 185-192. DOI:10.1002/1873-3468.12024 |
| [15] |
AHMADZADEH A, NOROZI F, SHAHRABI S, et al. Wnt/beta-catenin signaling in bone marrow niche[J]. Cell Tissue Res, 2016, 363(2): 321-335. DOI:10.1007/s00441-015-2300-y |
| [16] |
SHAO XR, LIN S Y, PENG Q, et al. Effect of tetrahedral DNA nanostructures on osteogenic differentiation of mesenchymal stem cells via activation of the Wnt/beta-catenin signaling pathway[J]. Nanomedicine, 2017, 13(5): 1809-1819. DOI:10.1016/j.nano.2017.02.011 |
| [17] |
MACDONALD BT, HE X. Frizzled and LRP5/6 receptors for Wnt/beta-catenin signaling[J]. Cold Spring Harb Perspect Biol, 2012, 4(12): S107. DOI:10.1101/cshperspect.a007880 |
| [18] |
TSAO YT, SHIH YY, LIU YA, et al. Knockdown of SLC41A1 magnesium transporter promotes mineralization and attenuates magnesium inhibition during osteogenesis of mesenchymal stromal cells[J]. Stem Cell Res Ther, 2017, 8(1): 39. DOI:10.1186/s13287-017-0497-2 |
 2019, Vol. 48
2019, Vol. 48