文章信息
- 李木子, 陈克研, 孙倩, 邱雨华
- LI Muzi, CHEN keyan, SUN Qian, QIU Yuhua
- TLR4/Myd88/NF-κB通路介导表没食子儿茶素没食子酸酯对脓毒血症大鼠急性肾损伤的保护作用
- Protective Effect of Epigallocatechin Gallate on Acute Kidney Injury Induced by Lipopolysaccharide in Rats via TLR4/Myd88/NF-κB Pathway
- 中国医科大学学报, 2019, 48(2): 109-113
- Journal of China Medical University, 2019, 48(2): 109-113
-
文章历史
- 收稿日期:2018-05-08
- 网络出版时间:2019-01-02 15:49
2. 中国医科大学实验动物部, 沈阳 110122
2. Department of Laboratory animal science, China Medical University, Shenyang 110122, China
急性肾损伤(acute kidney injury,AKI)是临床上多种原因导致的危急重症,19%~31%的患者因为肾功能不能完全恢复导致肾衰竭,死亡率高[1]。脓毒血症是AKI最常见的原因[2]。研究[3-4]表明,脓毒血症诱导的AKI致病机制与其他病因引发的AKI不同。在脓毒血症人群中,不依赖于AKI的严重程度,存在3种病理学改变:微循环功能障碍、炎症和对损伤的生物能适应性反应[5-7]。细胞表面TLR4识别内毒素及其下游反应在脂多糖(lipopolysaccharide,LPS)导致的AKI病理生理中起着重要作用[8]。没食子儿茶素-3-没食子酸酯(epigallocatechin gallate,EGCG)是绿茶提取物的主要儿茶素,是强效的抗氧化剂和活性氧清除剂[9]。研究[10]表明,EGCG在AKI模型中具有潜在的作用。然而,EGCG对AKI的影响和分子生物机制尚未阐明,故本研究拟通过建立LPS诱导大鼠AKI模型,探讨EGCG对AKI大鼠的保护作用及分子生物学机制。
1 材料与方法 1.1 材料 1.1.1 主要试剂TLR4、Myd88、核因子kappa B(nuclear factor-kappa B,NF-κB)抗体(美国CST公司);LPS来源于大肠杆菌O55;BS(英国Sigma-Aldrich公司);白细胞介素-6(interleukin 6,IL-6)、白细胞介素-1β(interleukin 1β,IL-1β)、白细胞介素-10(interleukin 10,IL-10)和肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)ELISA试剂盒(武汉USCN公司);EGCG(中国阿拉丁试剂有限公司)。
1.1.2 实验动物分组及模型制备清洁级SD大鼠,雄性,40只,体质量200~220 g,购自北部战区总医院实验动物科,在屏障系统中饲养。动物实验经北部战区总医院实验动物福利伦理委员会批准。SD大鼠随机分为4组:假手术组(Sham组)、LPS诱导急性肾损伤组(AKI组)、EGCG治疗组(EGCG组)和EGCG+LPS+TLR4抑制剂组(TLR4组),每组10只。AKI组、EGCG组、TLR4组大鼠采用腹腔注射LPS(40 mg/kg)建立内毒素血症大鼠模型;EGCG组在建模前4 d每天灌胃EGCG(80 mg/kg),TLR4组在给予EGCG后腹腔注射TLR4抑制剂。
1.2 方法 1.2.1 样品采集与检测各组大鼠于模型建立后6 h处死,取血液分离血清,一部分送检验科检测尿素氮(urea nitrogen,BUN)和血清肌酐(serum creatinine,Cr)含量,另一部分用于ELISA检测,剩余部分用于鲎试剂合成基质偶氮显色法(试剂盒购于厦门市鲎试剂实验厂有限公司);取肾脏组织,一部分置于多聚甲醛中,另一部分低温冰箱保存。
1.2.2 ELISA检测血清中炎性细胞因子含量按照ELISA试剂盒说明书检测血清中IL-6、IL-1β、TNF-α和IL-10含量变化。依次倍比稀释标准品建立标准曲线,加入待测样本37 ℃孵育90 min,PBST洗涤;加入50 μL酶标二抗,37 ℃孵育30 min;每孔加入显色剂50 μL,避光显色15 min,每孔加入终止液50 μL;酶标仪检测,绘制标准曲线,计算样品浓度。
1.2.3 HE染色检测肾脏组织组织进行脱水、透明、浸蜡后对心肌组织进行石蜡包埋,将包埋好的肾脏组织进行连续切片后,将切片脱蜡至水,苏木素染色2~3 min后,盐酸乙醇分化3~5 s,伊红染色1 min,切片梯度脱水、透明后封片,显微镜下观察肾脏组织的病理学变化。
1.2.4 实时PCR检测将收集的肾脏组织加入Trizol(美国Invitrogen公司,15596026)溶液中,按照Trizol试剂操作说明书进行分离提取组织和细胞中的总RNA,反转录合成第一链cDNA(美国Thermo公司,K1622)后,按照实时PCR(美国Qiagen公司,204057)法检测TLR4、Myd88和NF-κB,参照试剂盒说明书操作,引物由上海杰瑞生物公司合成,引物序列见表 1。反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,循环40次;融解曲线分析95 ℃ 1 s,65 ℃ 15 s,95 ℃ 5 s。结果采用2-ΔΔCt计算。
| Gene | Primer(5’→3’) |
| TLR4 | |
| Forward | AAGGGCTTCTACTCAGAG |
| Reverse | AGGACCCACATGGGCACT |
| Myd88 | |
| Forward | GTAGCCAGCCTCTGAAAC |
| Reverse | AGCCAGGATGATGTCTAC |
| NF-κB | |
| Forward | TTTCAAAAGTGGCATTGC |
| Reverse | TTAAGCTGTAAAATCACA |
| GAPDH | |
| Forward | GTCATCAACGGGAAACC |
| Reverse | CATGGAGAAGGCTGGGG |
1.2.5 Western blotting检测
将肾脏组织置于含有蛋白酶抑制剂的RIPA裂解液中,于冰上对心肌组织进行匀浆,收集上清液后,使用BCA蛋白定量试剂盒进行定量,蛋白上样行SDS-PAGE电泳、PVDF转膜后,加入TLR4、Myd88和NF-κB抗体(1:1 000),4 ℃孵育过夜,加入辣根过氧化物酶标记的二抗,室温孵育2 h后,使用ECL发光试剂盒和凝胶成像系统对蛋白进行显色,结果使用Image J软件进行灰度分析。
1.3 统计学分析采用SPSS 11.0统计软件进行分析,计量资料采用x±s表示。蛋白表达比较采用方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 内毒素检测与Sham组LPS含量(0.016±0.003)相比,AKI组LPS含量(0.372±0.015)显著升高,差异有统计学意义(P < 0.05);与AKI组相比,EGCG组LPS含量(0.132± 0.012)显著降低,差异有统计学意义(P < 0.05);与EGCG组相比,TLR4组LPS含量(0.318±0.009)显著升高,差异有统计学意义(P < 0.05)。
2.2 病理组织学变化与Sham组相比,AKI组肾脏肾小管扩张、出现肾小球炎症反应;与AKI组相比,EGCG组可明显减轻肾脏损伤,肾小球炎症减轻;加入TLR4抑制剂后,EGCG的作用减弱。见图 1。
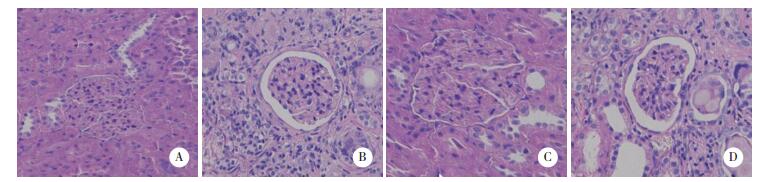
|
| A,Sham group;B,AKI group;C,EGCG group;D,TLR4 group. 图 1 HE染色检测各组大鼠肾脏组织病理学变化×200 Fig.1 Pathological changes in kidney tissues of rats from each group by HE staining ×200 |
2.3 肾功能检测
与Sham组Cr(40.21±6.34)和BUN(6.07±0.71)含量相比,AKI组Cr(130.34±11.23)和BUN(28.41±2.21)含量显著升高,差异有统计学意义(P < 0.05);与AKI组相比,EGCG组Cr(80.29±9.87)和BUN(19.22±2.31)含量显著降低,差异有统计学意义(P < 0.05);与EGCG组相比,TLR4组Cr(119.84±8.96)和BUN(23.27±1.71)含量显著升高,差异有统计学意义(P < 0.05)。
2.4 炎性细胞因子检测与Sham组IL-6(8.764±0.821)、IL-1β(43.227± 8.227)、TNF-α(57.281±3.882)和IL -10(164.32±10.88)水平相比,AKI组IL-6(15.283±1.241)、IL-1β(262.273± 26.942)和TNF-α(195.517±11.423)水平显著升高,IL -10(101.53±9.74)水平降低,差异有统计学意义(P < 0.05);与AKI组相比,EGCG组IL-6(10.642± 0.912)、IL-1β(137.731±9.811)和TNF-α(103.732± 4.713)水平显著降低,IL -10(184.33±8.93)水平升高,差异有统计学意义(P < 0.05);与EGCG组相比,TLR4组逆转了EGCG的抑制炎症反应作用,IL-6(13.281± 1.428)、IL-1β(198.732±18.742)和TNF-α(136.832± 9.883)水平显著升高,IL -10(133.42±9.92)水平降低,差异有统计学意义(P < 0.05)。
2.5 肾脏组织中TLR4、Myd88和NF-κB蛋白和mRNA表达水平分别用实时PCR和Western blotting检测TLR4、Myd88、NF-κB蛋白和mRNA表达,与Sham组TLR4、Myd88和NF-κB蛋白(0.39±0.048、0.31±0.035、0.71± 0.063)和mRNA(1±0、1±0、1±0)表达相比,AKI组TLR4、Myd88和NF-κB蛋白(1.19±0.088、0.74±0.053、1.33±0.092)和mRNA(1.832±0.084、1.721±0.056、1.984±0.093)表达显著增加,差异有统计学意义(P < 0.05);与AKI组相比,EGCG组TLR4、Myd88、NF-κB蛋白(0.98±0.039、0.57±0.042、1.04±0.048)和mRNA(1.432±0.071、1.503±0.072、1.573±0.066)表达显著降低,差异有统计学意义(P < 0.05);与EGCG组相比,TLR4组TLR4、Myd88、NF-κB蛋白(0.68±0.055、0.42±0.038、0.81±0.053)和mRNA(1.215±0.051、1.098±0.048、1.224±0.084)表达显著降低(P < 0.05)。见图 2。
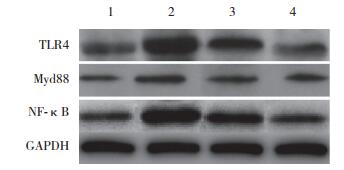
|
| 1, Sham group; 2, AKI group; 3, EGCG group; 4, TLR4 group. 图 2 Western blotting法检测肾脏组织中TLR4、Myd88和NF-κB蛋白表达水平结果 Fig.2 Western blotting results for the expression of TLR4, Myd88, and NF-κB in rat kidney tissues. |
3 讨论
本研究利用LPS构建了内毒素AKI模型,LPS诱导的AKI主要病理生理学特征为内皮功能障碍,肾小球内血栓形成和肾小管损伤的肾实质中的严重炎症反应。研究[11]表明LPS诱导的大鼠AKI,可以引起大鼠肾脏组织IL-6、TNF-α和IL-1β等炎性细胞因子表达的上调,因此,抑制这些炎性细胞因子的表达可以预防LPS诱导的AKI。
EGCG作为强效的抗氧化剂和活性氧清除剂,已证实有强抗炎作用[12]。CHANG等[13]研究发现,用环孢菌素(cyclosporine A,CsA)诱导的肾毒性大鼠模型中,EGCG对由氧自由基引起的肾功能改变具有保护作用。EL-MOWAFY等[14]研究发现,EGCG可以通过抑制白细胞增多、全身炎症、氧化应激来避免CP引起大鼠肾脏损伤。本研究结果显示,EGCG预处理LPS引起的AKI,BUN和Cr的表达水平明显下降,表明EGCG对大鼠肾脏具有明显的保护作用。ELISA检测结果表明,血清中IL-6、TNF-α和IL-1β的表达也明显下降。这些结果表明EGCG对LPS诱导AKI大鼠的肾脏保护是通过抑制肾脏组织中的炎性细胞因子来实现的。
TOLL样受体作为一种参与全身免疫反应和炎症反应的重要识别受体,能介导免疫细胞识别病原微生物,并引发全身免疫反应[15]。研究[16]表明,TLR4在LPS诱导的AKI动物模型中表达显著增高,LPS诱导后TLR4水平的增加可能与炎性细胞因子介导的受体表达增加有关。本研究进一步探讨了EGCG调控内毒素血症大鼠肾脏炎症反应的作用机制,结果显示,EGCG能够明显抑制LPS诱导的TLR4的表达及下游因子Myd88和NF-κB的活化。
综上所述,本研究结果表明,EGCG可以明显减轻LPS导致的大鼠肾损伤和全身炎症反应,其作用机制可能与TLR4/Myd88/NF-κB通路有关。
| [1] |
REWA O, BAGSHAW SM. Acute kidney injury-epidemiology, outcomes and economics[J]. Nat Rev Nephrol, 2014, 10(4): 193-207. DOI:10.1038/nrneph.2013.282 |
| [2] |
CHEN X, TONG H, CHEN Y, et al. Klotho ameliorates sepsis-induced acute kidney injury but is irrelevant to autophagy[J]. Onco Targets Ther, 2018, 11: 867-881. DOI:10.2147/OTT.S156891 |
| [3] |
FANI F, REGOLISTI G, DELSANTE M, et al. Recent advances in the pathogenetic mechanisms of sepsis-associated acute kidney injury[J]. J Nephrol, 2017, 2017(8): 1-9. DOI:10.1007/s40620-017-0452-4 |
| [4] |
HULTSTROM M, BECIROVIC-AGIC M, JONSSON S. Comparison of acute kidney injury of different etiology reveals in-common mechanisms of tissue damage[J]. Physiol Genomics, 2018, 50(3): 127-141. DOI:10.1152/physiolgenomics.00037.2017 |
| [5] |
HERING D, WINKLEWSKI PJ. R1 autonomic nervous system in acute kidney injury[J]. Clin Exp Pharmacol Physiol, 2017, 44(2): 162-171. DOI:10.1111/1440-1681.12694 |
| [6] |
SHUM HP, YAN WW, CHAN TM. Recent knowledge on the pathophysiology of septic acute kidney injury:a narrative review[J]. J Crit Care, 2016, 31(1): 82-89. DOI:10.1016/j.jcrc.2015.09.017 |
| [7] |
ZHANG Z, ZHANG H, CHEN R, et al. Oral supplementation with ursolic acid ameliorates sepsis-induced acute kidney injury in a mouse model by inhibiting oxidative stress and inflammatory responses[J]. Mol Med Rep, 2018, 17(5): 7142-7148. DOI:10.3892/mmr.2018.8767 |
| [8] |
MOHAMED AF, SAFAR MM, ZAKI HF, et al. Telluric acid ameliorates endotoxemic kidney injury in mice:involvement of TLR4, Nrf2, and PI3K/Akt signaling pathways[J]. Inflammation, 2017, 40(5): 1742-1752. DOI:10.1007/s10753-017-0617-2 |
| [9] |
ENG QY, THANIKACHALAM PV, RAMAMURTHY S. Molecular understanding of epigallocatechin gallate (EGCG) in cardiovascular and metabolic diseases[J]. J Ethnopharmacol, 2018, 210: 296-310. DOI:10.1016/j.jep.2017.08.035 |
| [10] |
FUNAMOTO M, MASUMOTO H, TAKAORI K, et al. Green tea polyphenol prevents diabetic rats from acute kidney injury after cardiopulmonary bypass[J]. Ann Thorac Surg, 2016, 101(4): 1507-1513. DOI:10.1016/j.athoracsur.2015.09.080 |
| [11] |
TAN F, CHEN Y, YUAN D, et al. Dexmedetomidine protects against acute kidney injury through downregulating inflammatory reactions in endotoxemia rats[J]. Biomed Rep, 2015, 3(3): 365-370. DOI:10.3892/br.2015.427 |
| [12] |
GUO R, ZHOU FM, SU CJ, et al. Epigallocatechin-3-gallate attenuates acute and chronic psoriatic itch in mice:involvement of antioxidant, anti-inflammatory effects and suppression of ERK and Akt signaling pathways[J]. Biochem Biophys Res Commun, 2018, 496(4): 1062-1068. DOI:10.1016/j.bbrc.2018.01.122 |
| [13] |
CHANG EJ, MUN KC. Effect of epigallocatechin gallate on renal function in cyclosporine-induced nephrotoxicity[J]. Transplant Proc, 2004, 36(7): 2133-2134. DOI:10.1016/j.transproceed.2004.08.020 |
| [14] |
EL-MOWAFY AM, AL-GAYYAR MM, SALEM HA, et al. Novel chemotherapeutic and renal protective effects for the green tea (EGCG):role of oxidative stress and inflammatory-cytokine signaling[J]. Phytomedicine, 2010, 17(14): 1067-1075. DOI:10.1016/j.phymed.2010.08.004 |
| [15] |
JIN S, WANG J, CHEN S, et al. A novel limonin derivate modulates inflammatory response by suppressing the TLR4/NF-kappaB signalling pathway[J]. Biomed Pharmacother, 2018, 100: 501-508. DOI:10.1016/j.biopha.2018.02.046 |
| [16] |
NAIR AR, MASSON GS, EBENEZER PJ, et al. Role of TLR4 in lipopolysaccharide-induced acute kidney injury:protection by blueberry[J]. Free Radic Biol Med, 2014, 71: 16-25. DOI:10.1016/j.freeradbiomed.2014.03.012 |
 2019, Vol. 48
2019, Vol. 48