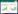文章信息
- 黄碧莹, 刘洁, 钟鸣, 王珺婷, 王小玢, 康媛媛, 孙妍, 乔雪
- HUANG Biying, LIU Jie, ZHONG Ming, WANG Junting, WANG Xiaobin, KANG Yuanyuan, SUN Yan, QIAO Xue
- LC3在成釉细胞瘤中的表达及意义
- Expression and Significance of LC3 in Ameloblastomas
- 中国医科大学学报, 2019, 48(2): 101-104
- Journal of China Medical University, 2019, 48(2): 101-104
-
文章历史
- 收稿日期:2018-06-11
- 网络出版时间:2019-01-02 15:46
2. 中国医科大学科学实验中心, 沈阳 110122;
3. 中国医科大学附属口腔医院中心实验室, 沈阳 110002
2. The Science Experiment Center, China Medical University, Shenyang 110122, China;
3. Department of Central Laboratory, Hospital of Stomatology, China Medical University, Shenyang 110002, China
成釉细胞瘤是牙源性肿瘤中最常见的上皮源性肿瘤,其术后易复发且具有局部侵袭性生长的生物学特性。成釉细胞瘤的病因及局部侵袭性表现的分子生物学机制尚不明确,目前的主要治疗方法为手术切除,但术后易复发,且有恶变的可能,为治疗带来难度,并严重影响患者的生存质量[1]。因此,深入研究该肿瘤的发生发展机制,探索新的早期诊断和治疗方法具有重要意义。
细胞自噬是真核细胞处理自身产生的衰老、损伤或变性的蛋白及细胞器等生物大分子的一种现象,能使这些来源于细胞自身的成分在溶酶体内降解或再利用,这一过程的目的不仅仅是清除细胞自身产生的废物,更是作为一种动态循环系统,为细胞更新修复和维持动态平衡提供能量[2]。在自噬体形成过程中,微管相关蛋白1轻链3(microtubule-assaiated protein 1 light chain 3,LC3)分子由水溶形式的LC3-Ⅰ转化为脂溶形式的LC3-Ⅱ,LC3-Ⅱ可以和新形成的自噬体膜结合,并且一直结合到自噬体与溶酶体融合,因而LC3-Ⅱ常被作为细胞内自噬的标志物[3-4],LC3表达水平可作为检测肿瘤自噬水平的指标。细胞自噬作为一种细胞的正常代谢现象在肿瘤的发生发展中可起到抑制或促进的双重作用[5],而细胞自噬在成釉细胞瘤中发挥的作用尚不明确。本研究旨在通过免疫组织化学染色方法检测成釉细胞瘤及正常口腔黏膜组织中LC3表达水平,分析LC3表达与患者临床病理资料间的关系,研究细胞自噬在成釉细胞瘤发生发展中的作用。
1 材料与方法 1.1 组织标本收集中国医科大学附属口腔医院2015年至2016年手术切除的104例成釉细胞瘤石蜡标本,均经病理科确诊。其中男60例,女44例,年龄6~88岁,平均36.96岁;原发病例94例,复发10例;实性型成釉细胞瘤83例,单囊型成釉细胞瘤12例,促结缔组织增生型成釉细胞瘤3例,外周型成釉细胞瘤6例。选取20例正常口腔黏膜组织标本作为对照,取材于中国医科大学附属口腔医院口腔外科门诊智齿拔除术带出的牙周黏膜组织。所有标本使用均经患者知情同意,本研究经医院伦理委员会批准同意。
1.2 主要试剂及方法 1.2.1 主要试剂一抗为兔抗人LC3多克隆抗体,购自英国Abcam公司,二抗为羊抗兔抗体,购自中国碧云天生物有限公司。SP超敏试剂盒(鼠/兔)及DAB显色试剂盒购自福州迈新生物技术开发有限公司。
1.2.2 免疫组织化学染色石蜡包埋标本常规4 μm厚切片,采用链霉素抗生物素蛋白-过氧化物酶法(SP三步法)。常规脱蜡、水化、柠檬酸盐高压抗原修复,3% H2O2阻断内源性过氧化物酶活性,一抗4 ℃过夜,LC3抗体工作浓度为1: 400,二抗37 ℃孵育30 min,DAB染色,苏木精复染。阴性对照采用0.01 mol/L PBS代替一抗。
1.2.3 结果评判LC3阳性表达见于细胞质,为棕黄色颗粒,强阳性时细胞间质和细胞核中亦可见表达。每张切片在200倍下观察,随机选取3个视野,对每个视野均进行染色强度评分与阳性瘤细胞百分比评分。胞质无着色记0分,浅黄色记1分,棕黄色记2分,棕褐色记3分;阳性瘤细胞占总细胞数的0~5%记0分,> 5%~25%记1分,> 25%~50%记2分,> 50%记3分。每张切片最终评分=染色强度评分×阳性瘤细胞百分比评分,1~3分为阴性(-),4分以上为阳性。
1.3 统计学分析应用SPSS 17.0软件进行统计学分析,计数资料比较采用χ2检验及Fisher确切概率法,P < 0.05为差异有统计学意义。
2 结果 2.1 LC3在成釉细胞瘤组织和正常口腔黏膜组织中的表达LC3主要表达于成釉细胞瘤上皮细胞细胞质,阳性率高时细胞核也有着色(图 1),在正常口腔黏膜组织中阴性表达(图 2)。104例成釉细胞瘤组织中LC3表达阳性率为76.92%(80/104),显著高于正常口腔黏膜组织(10.00%,2/20),差异有统计学意义(P < 0.05)。
|
| A, follicular ameloblastoma showing strong reactivity for LC3;B, plexiform ameloblastoma showing strong reactivity for LC3 in most neoplastic cells; C, unicystic ameloblastoma showing reactivity for LC3 in the ameloblastomatous epithelium lining; D, granular cell ameloblastoma showing reactivity in peripheral columnar cells and strong reactivity in granular cells for LC3;E, peripheral ameloblastoma showing reactivity for LC3;F, desmoplastic ameloblastoma showing strong reactivity for LC3. 图 1 LC3在成釉细胞瘤中阳性表达SP×200 Fig.1 Positive immunohistochemical reactivity for LC3 in ameloblastomas SP×200 |
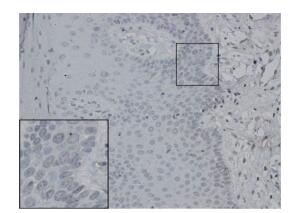
|
| 图 2 LC3在正常口腔黏膜中阴性表达SP×200 Fig.2 Negative immunohistochemical reactivity for LC3 in normal oral mucosal tissues SP×200 |
2.2 LC3表达与成釉细胞瘤临床病理资料的关系
成釉细胞瘤中LC3的表达在患者年龄、性别及是否复发方面的差异无统计学意义(P > 0.05),在病变部位方面,发生于下颌骨的成釉细胞瘤中LC3阳性表达率高于发生于上颌骨及牙龈的成釉细胞瘤,差异有统计学意义(P < 0.05)。在病理分型方面,实性多囊型患者的LC3阳性表达率高于其他分型患者,差异有统计学意义(P < 0.05)。见表 1。
| Clinicopathological characteristic | n | LC3-positive expression [n(%)] | χ2 | P |
| Age(year) | 0.185 | 0.667 | ||
| ≤50 | 73 | 57(78.08) | ||
| > 50 | 31 | 23(74.19) | ||
| Gender | 0.005 | 0.942 | ||
| Male | 60 | 46(76.67) | ||
| Female | 44 | 34(77.27) | ||
| Tumor location | 3.967 | 0.046 | ||
| Mandible | 84 | 70(83.33) | ||
| Maxilla and gingiva | 20 | 10(50.00) | ||
| Pathological type | 4.487 | 0.034 | ||
| Solid/multicystic | 83 | 68(81.93) | ||
| Others(unicystic, peripheral, desmoplastic) | 21 | 12(57.14) | ||
| Recurrence | 0.000 | 1.000 | ||
| Yes | 10 | 8(80.00) | ||
| No | 94 | 72(76.60) |
3 讨论
细胞自噬是一种细胞的分解代谢过程。在压力条件下,如缺氧、生长因子缺乏和代谢压力等,细胞通过降解或再利用自身产生的变性蛋白质或细胞器成分而产生能量,以帮助细胞度过生存危机,适应压力环境,可起到阻止细胞衰老和死亡的作用。越来越多的研究[6]发现,细胞自噬在口腔及全身肿瘤、神经退行性疾病、心脏疾病、自身免疫性疾病和感染性疾病等的发生发展和治疗中都发挥重要作用。
研究表明,细胞自噬在牙发育过程中也发挥重要作用。YANG等[7]发现,在小鼠的牙胚发育过程中,自噬相关基因Beclin1主要定位于成釉器的细胞质,星网状层、内外釉上皮层的细胞核中也有Beclin1的表达,Beclin1可能参与了牙发育过程中细胞自噬及凋亡的相互作用,并与牙形态形成及发育有关;还有研究[8]在鼠牙胚发育的过程中检测到LC3,提示自噬可能与牙齿发育期间分化细胞的细胞增殖、分化和稳态维持有关。在牙源性角化囊肿中也检测到自噬水平增高,且自噬相关基因Beclin1和细胞增殖标志物Ki-67的表达呈现明显的相关性[9],这种现象表明自噬可能与细胞增殖潜能增加有关,可能与牙源性角化囊性瘤细胞具有较强的增殖能力以及术后易复发的特点有关。
成釉细胞瘤是牙源性肿瘤,与牙的发育密切相关,可能起源于发育中的牙釉质器官、牙齿上皮细胞剩余部分、口腔上皮细胞的基底细胞[10]及牙源性囊肿的衬里上皮或被覆黏膜的残留物[11]。本研究中,LC3在成釉细胞瘤组织中的阳性表达率显著高于正常口腔黏膜组织,差异有统计学意义(P < 0.05),表明成釉细胞瘤中的自噬水平高于正常口腔黏膜组织,提示细胞自噬可能参与牙源性上皮的发生发展,对成釉细胞瘤的形成有一定影响。
研究[12]表明,细胞自噬可通过调节肝癌细胞中的活性氧水平起到促进上皮-间质转化进而促进肿瘤细胞的转移作用,并且肿瘤坏死因子α可以通过抑制自噬来抑制上皮-间质转化。另有研究[13]发现,间质标志物波形蛋白在成釉细胞瘤的上皮细胞中亦有表达,且上皮标志蛋白上皮钙黏蛋白在成釉细胞瘤上皮细胞中表达下降,提示成釉细胞瘤中存在上皮-间质转化现象,与成釉细胞瘤的局部侵袭性密切相关。结合本研究结果,成釉细胞瘤中的自噬现象可能影响上皮-间质转化,对肿瘤的生物学行为产生一定影响。
本研究结果显示,LC3在发生于下颌骨的成釉细胞瘤中的阳性表达率显著高于发生于上颌骨及牙龈的成釉细胞瘤,但由于成釉细胞瘤发生于下颌骨者所占比例显著高于发生于上颌骨及牙龈等部位[14],且目前尚无对成釉细胞瘤发病部位与肿瘤生物学行为的相关性报道,推测可能由于下颌骨与上颌骨相比,血供较为单一,且骨质较致密,肿瘤细胞在下颌骨中的增殖更易发生缺氧或能量不足,需要细胞自噬为肿瘤细胞增殖提供能量。本研究中发生于上颌骨及牙龈者例数较少,LC3阳性表达率在发病部位上的差异仍需进一步扩大样本研究。由于复发例数较少,在复发病例与原发病例之间,LC3阳性表达率的差异无统计学意义。但在实性/多囊型成釉细胞瘤中LC3的阳性表达率显著高于其他分型,有研究[15]发现实性/多囊型成釉细胞瘤的复发率高于其他分型,提示实性/多囊型成釉细胞瘤中自噬水平升高可能与肿瘤复发有关。
综上所述,自噬标志蛋白LC3在成釉细胞瘤中的阳性表达率高于正常口腔黏膜组织,且与病理分型和发病部位有关,提示成釉细胞瘤中存在细胞自噬现象,自噬现象与成釉细胞瘤的发生发展及其局部侵袭的生物学特性的关系有待进一步研究。
| [1] |
FREGNANI ER, DA CRUZ PEREZ DE, DE ALMEIDA OP, et al. Clinicopathological study and treatment outcomes of 121 cases of ameloblastomas[J]. Int J Oral Maxillofac Surg, 2010, 39(2): 145-149. DOI:10.1016/j.ijom.2009.11.022 |
| [2] |
NOBORU M, MASAAKI K. Autophagy:renovation of cells and tissues[J]. Cell, 2011, 147(4): 728-741. DOI:10.1016/j.cell.2011.10.026 |
| [3] |
OHSUMI Y. Molecular dissection of autophagy:two ubiquitin-like systems[J]. Nat Rev Mol Cell Biol, 2001, 2(3): 211-216. DOI:10.1038/35056522 |
| [4] |
MIZUSHIMA N. Autophagy:process and function[J]. Genes Dev, 2007, 21(22): 2861-2873. DOI:10.1101/gad.1599207 |
| [5] |
WHITE E, MEHNERT JM, CHAN CS. Autophagy, metabolism, and cancer[J]. Clin Cancer Res, 2015, 21(22): 5037-5046. DOI:10.1158/1078-0432.CCR-15-0490 |
| [6] |
王雅雯, 侯劲松. 自噬基因Beclin 1在肿瘤中的作用及其与口腔癌的关系[J]. 中国实用口腔科杂志, 2011, 4(6): 374-376. DOI:10.3969/j.issn.1674-1595.2011.06.019 |
| [7] |
YANG J, WAN C, NIE S, et al. Localization of Beclin1 in mouse developing tooth germs:possible implication of the interrelation between autophagy and apoptosis[J]. J Mol Histol, 2013, 44(6): 619-627. DOI:10.1007/s10735-013-9518-3 |
| [8] |
YANG JW, ZHU LX, YUAN GH, et al. Autophagy appears during the development of the mouse lower first molar[J]. Histochem Cell Biol, 2013, 139(1): 109-118. DOI:10.1007/s00418-012-1016-2 |
| [9] |
LI RF, CHEN G, ZHAO Y, et al. Increased expression of autophagy-related proteins in keratocystic odontogenic tumours:its possible association with growth potential[J]. Br J Oral Maxillofac Surg, 2014, 52(6): 551-556. DOI:10.1016/j.bjoms.2014.03.009 |
| [10] |
SELVAMANI M, YAMUNADEVI A, BASANDI PS, et al. Analysis of prevalence and clinical features of multicystic ameloblastoma and its histological subtypes in South Indian sample population:a retrospective study over 13 years[J]. J Pharm Bioallied Sci, 2014, 6(Suppl 1): S131-S134. DOI:10.4103/0975-7406.137419 |
| [11] |
MASTHAN KM, ANITHA N, KRUPAA J, et al. Ameloblastoma[J]. J Pharm Bioallied Sci, 2015, 7(Suppl 1): S167-S170. DOI:10.4103/0975-7406.155891 |
| [12] |
DASH S, SARASHETTI PM, RAJASHEKAR B, et al. TGF-β2-induced EMT is dampened by inhibition of autophagy and TNF-α treatment[J]. Oncotarget, 2018, 9(5): 6433-6449. DOI:10.18632/oncotarget.23942 |
| [13] |
HAO FY, LIU J, ZHONG M, et al. Expression of E-cadherin, vimentin and β-catenin in ameloblastoma and association with clinicopathological characteristics of ameloblastoma[J]. Int J Clin Exp Pathol, 2018, 11(1): 199-207. |
| [14] |
PATSA S, JADAV RB, HALDER GC, et al. Demographic and histopathological variation of ameloblastoma:a hospital-based study[J]. J Oral Maxillofac Pathol, 2016, 20(2): 230-233. DOI:10.4103/0973-029X.185937 |
| [15] |
ANTONOGLOU GN, SÁNDOR GK. Recurrence rates of intraosseous ameloblastomas of the jaws:a systematic review of conservative versus aggressive treatment approaches and meta-analysis of non-randomized studies[J]. J Craniomaxillofac Surg, 2015, 43(1): 149-157. DOI:10.1016/j.jcms.2014.10.027 |
 2019, Vol. 48
2019, Vol. 48