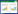文章信息
- 蒋保三, 赵洪波, 朱亚玲, 王刚, 张越美, 刁勇
- JIANG Baosan, ZHAO Hongbo, ZHU Yaling, WANG Gang, ZHANG Yuemei, DIAO Yong
- 泛素结合酶E2S在肝细胞肝癌中的表达及其与预后的关系
- Expression and Prognostic Value of UBE2S in Hepatocellular Carcinoma
- 中国医科大学学报, 2019, 48(10): 915-918, 925
- Journal of China Medical University, 2019, 48(10): 915-918, 925
-
文章历史
- 收稿日期:2018-08-27
- 网络出版时间:2019-09-27 17:12
2. 昆明医科大学分子临床医学研究院暨云南省干细胞和再生医学重点实验室, 昆明 650500
2. Institute of Molecular Clinical Medicine, Kunming Medical University and Key Laboratory of Stem Cell and Regenerative Medicine of Yunnan Province, Kunming 650500, China
原发性肝癌(primary liver carcinoma,PLC)是最常见的恶性肿瘤之一,其中80%以上为肝细胞肝癌(hepatocellular carcinoma,HCC)[1],其发生和发展需经历多个病理阶段,发生多种分子改变[2]。PLC的病死率很高,半数以上的发病和死亡病例是在中国[3]。大多数肝癌患者确诊时已经是中晚期,且预后不良,术后5年生存率较低[4]。
泛素化对于信号转导、细胞内运输和蛋白质降解必不可少。泛素化过程由E1泛素激活酶、E2泛素结合酶和E3泛素连接酶介导。E3连接酶介导E2活性半胱氨酸上泛素向特定靶标蛋白赖氨酸的转移[5-6]。泛素化在癌症发展中起着至关重要的作用。泛素结合酶E2S(ubiquitin-conjugating enzyme E2S,UBE2S)是将泛素链延伸至26S蛋白酶体的关键[7-9],与多种癌症的发生发展密切相关[10-13]。但目前未见UBE2S与肝癌相关的报道,因此,本研究拟通过挖掘公共数据库现有的肝癌数据信息,分析UBE2S在肝癌中的表达与预后的关系,为进一步研究UBE2S在肝癌发生发展中的作用机制提供线索和思路。
1 材料与方法 1.1 Oncomine数据库检索Oncomine是目前世界上最大的癌基因芯片数据库和整合数据挖掘平台,旨在挖掘癌症基因信息。截至目前,该数据库已经收集了715个基因表达数据集,86 733个癌症组织和正常组织的样本数据。它拥有最全的癌症突变谱、基因表达数据以及相关临床信息,可用于发现新的生物标记物或新的治疗靶点。本研究中的检索条件设置如下:(1)Analysis type为clear cell renal cell carcinoma vs. normal analysis;(2)Data type为mRNA;(3)设定条件为Under-expression,Gene为UBE2S。
1.2 GEPIA数据库检索GEPIA是基于TCGA和GTEx数据库得出的标准RNA测序数据库[14-15],本研究中选择使用TCGA数据,用以分析验证UBE2S在HCC中的表达情况。差异表达分析筛选条件为:(1)Expression DIY为Expression on Box Plots;(2)Gene为UBE2S;(3)Datasets selection为LIHC;(4)Matched normal data为TCGA。生存分析条件设置:(1)Datasets selection为LIHC;(2)Methods为overall survival/disease free survival;(3)Group cutoff为Median。
1.3 STRING数据库检索该数据库是分析生物学基因或蛋白相互作用的检索工具,包含已证实的和可以预测的蛋白质-蛋白质相互作用的生物数据库和网络资源[16],利用该数据库,分析UBE2S相关联的基因,条件设置:Protein name为UBE2S,Organism为homo sapiens。
2 结果 2.1 UBE2S在HCC与正常组织中的差异表达在Oncomine数据库中发现,自2002年开始,共有5个研究(WURMBACH等[17],ROESSLER等[18])涉及UBE2S在HCC组织和正常组织中的表达研究,共包括877个样本。整合这些研究结果发现,与对照组相比,UBE2S在HCC中高表达(P = 2.61×10-7),3个队列的结果均显示UBE2S在HCC组织中的表达显著高于正常组织(P均 < 0.01,图 1)。
|
| 图 1 Oncomine数据库中UBE2S在不同肝癌研究芯片中的表达 Fig.1 Expression of UBE2S in different liver cancer research chips in Oncomine database |
2.2 GEPIA数据库验证结果
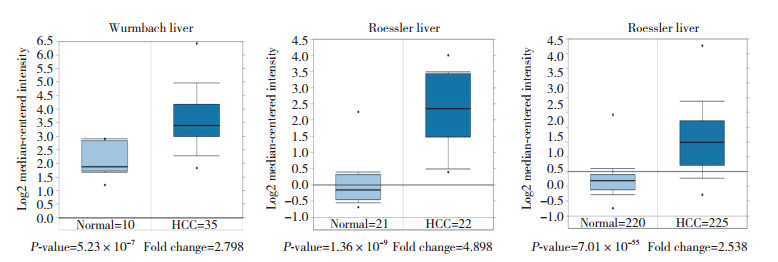
为了验证UBE2S在肝癌中的高表达,使用GEPIA分析来自TCGA数据库的419个样本,其中HCC 369例,正常肝组织50例,结果如图 2所示,UBE2S在HCC中表达量明显高于正常肝组织(P < 0.01),与Oncomine结果一致。
|
| 图 2 TCGA数据库中UBE2S在正常肝组织与HCC组织中的差异表达 Fig.2 Differential expression of UBE2S in normal liver tissue and HCC tissue in TCGA database |
2.3 UBE2S表达水平与HCC患者预后的关系
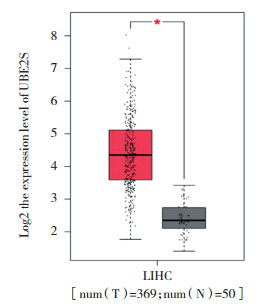
在GEPIA中分析UBE2S表达水平与HCC患者预后的关系,得出UBE2S高表达与低表达患者各182例的总体生存期曲线(图 3)和无病生存曲线(图 4),结果显示,HCC中UBE2S基因高表达患者5年预后较差,低表达患者5年预后较好,UBE2S的高低表达患者总体生存期和无病生存期差异值分别为log rank P = 2.7×10-5,HR=2.1;log rank P = 4.3×10-5,HR=1.9,有统计学意义,且UBE2S是肝癌的危险因素(风险比HR > 1表明研究对象是危险因素,HR < 1表明研究对象是保护因素),即肝癌中UBE2S高表达者预后差。
|
| 图 3 HCC患者UBE2S表达的总体生存期曲线 Fig.3 Overall survival curve of UBE2S expression in hepatocellular carcinoma patients |
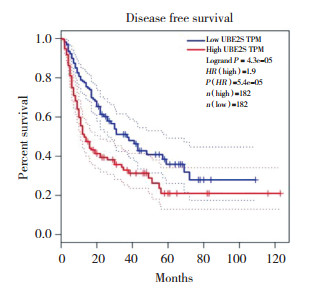
|
| 图 4 UBE2S表达与无病生存期的关系 Fig.4 Relationship between UBE2S expression and disease free survival |
2.4 UBE2S基因表达水平与HCC病理分级的关系
在GEPIA中分析UBE2S基因表达与HCC患者病理分级的关系。选择TCGA的LIHC数据集,可得出Ⅰ、Ⅱ、Ⅲ与Ⅳ期(癌症分期)的HCC患者UBE2S的变化情况(P = 2.15×10-6),其中Ⅰ~Ⅲ期UBE2S水平逐渐升高,Ⅳ期却略有降低(图 5),原因可能是样本量较少,从图 5中可看出Ⅳ期的样本量明显少于其他3组,也有可能是Ⅳ期的患者为肝癌晚期接近死亡,继续入院治疗者较少,造成样本的选择偏倚。出现此状况的具体原因尚未有文献报道,故这一现象的出现原因也有待研究解释。
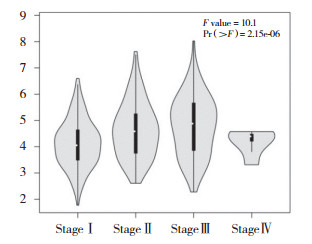
|
| 图 5 病理分级中的UBE2S表达强度 Fig.5 UBE2S expression intensity in pathological grading |
2.5 UBE2S相互作用蛋白网络
通过使用STRING数据库分析UBE2S的蛋白相互作用网络发现,以UBE2S蛋白为中心,有多个相互作用的蛋白及同类蛋白,如CDC20、UBA1等(图 6)。UBE2S基因在泛素介导的蛋白质水解中处于重要节点位置,主要参与调节多种生理过程,其中泛素介导蛋白水解、细胞周期与肿瘤的发生发展有关联(表 1)。
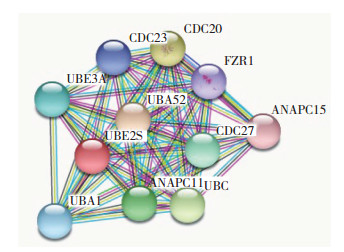
|
| 图 6 与UBE2S基因表达蛋白相关蛋白网络图 Fig.6 Network diagram of proteins associated with UBE2S gene expression |
| Pathway ID | Pathway description | Count in gene set | False discovery rate |
| 04120 | Ubiquitin mediated proteolysis | 8 | 1.28×10-13 |
| 04110 | Cell cycle | 5 | 4.29×10-7 |
| 04914 | Progesterone-mediated oocyte maturation | 4 | 6.37×10-6 |
| 04114 | Oocyte meiosis | 4 | 1.51×10-5 |
| 05166 | HTLV-I infection | 4 | 3.86×10-4 |
3 讨论
HCC是常见的恶性肿瘤之一,比较有效的治疗手段是外科手术切除。但由于肝癌发病较隐匿,发现较晚,极易错过最佳治疗时期,临床上仅有约10%~15%的患者可以进行手术切除术或肝移植。肝癌术后预后差,易复发,5年生存率较低。
UBE2S在恶性肿瘤中表达水平较高,是泛素化过程中所需要的泛素结合酶E2家族成员之一,AYESHA等[11]的研究表明,UBE2S在乳腺癌中的表达高于正常组织,且在肿瘤组织的有丝分裂过程中高表达,并证实UBE2S的缺失抑制了癌细胞的恶性特性,如迁移、侵袭和不依赖锚定的生长;除此之外,也有文献[10, 13]报道UBE2S在肾细胞癌、宫颈癌肿瘤组织中较正常组织中表达水平更高,且与预后不良有关。由此可见,UBE2S可以用作多种癌症的标记物。
泛素化修饰有多种连接方式,其中7种涉及泛素链内部赖氨酸K与泛素分子C末端的甘氨酸G相连接的方式,分别是K6、K11、K27、K29、K33、K48、K63位多聚泛素化修饰,UBE2S主要促进K11位泛素化修饰[8]。首先APC / C(后期促进复合物)与UBE2C结合,引发底物的赖氨酸残基,接着UBE2S把泛素链沿着K11连接型延长,最后生成的泛素链促进蛋白酶体降解底物蛋白并促进有丝分裂退出。此外,UBE2S与调节肌动蛋白细胞骨架和焦点粘连有关,UBE2S的减少引起细胞形态的变化并破坏肌动蛋白应力纤维和黏着斑的形成,其中肌动蛋白细胞骨架在许多细胞功能中发挥关键作用,如细胞迁移和扩散。所以在没有UBE2S的情况下,细胞的迁移与传播速度减慢[11]。
本研究通过数据库挖掘分析,经多重验证,得出UBE2S在基因层面和蛋白层面与HCC的发生发展密切相关,UBE2S在HCC中呈高表达,且与HCC患者的预后不良相关,这为进一步研究肝癌的标志物以及靶标治疗提供了一条新思路。
| [1] |
BALOGH J, VICTOR D 3rd, ASHAM EH, et al. Hepatocellular carcinoma:a review[J]. J Hepatocell Carcinoma, 2016, 3: 41-53. DOI:10.2147/JHC.S61146 |
| [2] |
龚由之, 江应安. 肝癌发生、发展过程中部分基因表达异常对其诊断及治疗的意义[J]. 胃肠病学和肝病学杂志, 2016, 25(8): 848-851. DOI:10.3969/j.issn.1006-5709.2016.08.002 |
| [3] |
TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [4] |
LLOVET JM, RICCI S, MAZZAFERRO V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359(4): 378-390. DOI:10.1056/nejmoa0708857 |
| [5] |
PICKART CM, EDDINS MJ. Ubiquitin:structures, functions, mechanisms[J]. Biochim Biophys Acta, 2004, 1695(1/3): 55-72. DOI:10.1016/j.bbamcr.2004.09.019 |
| [6] |
NEUTZNER M, NEUTZNER A. Enzymes of ubiquitination and deubiquitination[J]. Essays Biochem, 2012, 52: 37-50. DOI:10.1042/bse0520037 |
| [7] |
GARNETT MJ, MANSFELD J, GODWIN C, et al. UBE2S elongates ubiquitin chains on APC/C substrates to promote mitotic exit[J]. Nat Cell Biol, 2009, 11(11): 1363-1369. DOI:10.1038/ncb1983 |
| [8] |
WILLIAMSON A, WICKLIFFE KE, MELLONE BG, et al. Identification of a physiological E2 module for the human anaphase-promoting complex[J]. Proc Natl Acad Sci USA, 2009, 106(43): 18213-18218. DOI:10.1073/pnas.0907887106 |
| [9] |
MEYER HJ, RAPE M. Enhanced protein degradation by branched ubiquitin chains[J]. Cell, 2014, 157(4): 910-921. DOI:10.1016/j.cell.2014.03.037 |
| [10] |
LIANG J, NISHI H, BIAN ML, et al. The ubiquitin-conjugating enzyme E2-EPF is overexpressed in cervical cancer and associates with tumor growth[J]. Oncol Rep, 2012, 28(4): 1519-1525. DOI:10.3892/or.2012.1949 |
| [11] |
AYESHA AK, HYODO T, ASANO E, et al. UBE2S is associated with malignant characteristics of breast cancer cells[J]. Tumour Biol, 2016, 37(1): 763-772. DOI:10.1007/s13277-015-3863-7 |
| [12] |
TEDESCO D, ZHANG JH, TRINH L, et al. The ubiquitin-conjugating enzyme E2-EPF is overexpressed in primary breast cancer and modulates sensitivity to topoisomeraseⅡinhibition[J]. Neoplasia, 2007, 9(7): 601-613. DOI:10.1593/neo.07385 |
| [13] |
ROOS FC, EVANS AJ, BRENNER W, et al. Deregulation of E2-EPF ubiquitin carrier protein in papillary renal cell carcinoma[J]. Am J Pathol, 2011, 178(2): 853-860. DOI:10.1016/j.ajpath.2010.10.033 |
| [14] |
TOMCZAK K, CZERWIŃSKA P, WIZNEROWICZ M. The cancer genome atlas (TCGA):an immeasurable source of knowledge[J]. Contemp Oncol (Pozn), 2015, 19(1A): A68-A77. DOI:10.5114/wo.2014.47136 |
| [15] |
HAAKE SM, WEYANDT JD, RATHMELL WK. Insights into the genetic basis of the renal cell carcinomas from the cancer genome atlas[J]. Mol Cancer Res, 2016, 14(7): 589-598. DOI:10.1158/1541-7786.MCR-16-0115. |
| [16] |
SZKLARCZYK D, MORRIS JH, COOK H, et al. The STRING database in 2017:quality-controlled protein-protein association networks, made broadly accessible[J]. Nucleic Acids Res, 2017, 45(D1): D362-D368. DOI:10.1093/nar/gkw937 |
| [17] |
WURMBACH E, CHEN YB, KHITROV G, et al. Genome-wide molecular profiles of HCV-induced dysplasia and hepatocellular carcinoma[J]. Hepatology, 2007, 45(4): 938-947. DOI:10.1002/hep.21622 |
| [18] |
ROESSLER S, JIA HL, BUDHU A, et al. A unique metastasis gene signature enables prediction of tumor relapse in early-stage hepatocellular carcinoma patients[J]. Cancer Res, 2010, 70(24): 10202-10212. DOI:10.1158/0008-5472.CAN-10-2607 |
 2019, Vol. 48
2019, Vol. 48