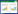文章信息
- 赵兴, 马天娇, 罗钢
- ZHAO Xing, MA Tianjiao, LUO Gang
- ILEI在肾间质纤维化中的表达变化
- Expression of Interleukin-Like Epithelial-Mesenchymal Transition Inducer in Renal Interstitial Fibrosis
- 中国医科大学学报, 2019, 48(10): 910-914
- Journal of China Medical University, 2019, 48(10): 910-914
-
文章历史
- 收稿日期:2019-06-06
- 网络出版时间:2019-09-27 11:25
慢性肾脏病是一种威胁人类生命健康的“全球公共健康问题”,其病因复杂多样[1],肾脏纤维化是该病进展的共同结局[2]。研究[3]已证实,肾间质纤维化是导致肾脏纤维化的主要原因,是参与终末期肾脏病形成的共同通路,主导肾脏疾病的转归。目前,肾间质纤维化的发病机制尚不清楚,如何减轻或逆转肾脏纤维化以延缓终末期肾病的发生已成为国内外研究的热点。单侧输尿管梗阻(unilateral ureteral occlusion,UUO)是引起梗阻性肾病的实验动物模型,用于研究肾脏炎症和瘢痕形成的各个方面,包括疾病的发病机制和潜在的抗炎或抗纤维化治疗实验[4]。研究[5]表明,上皮-间质转分化(epithelial-mesenchymal transition,EMT)在肾间质纤维化的发生、发展过程中起到至关重要的作用。转化生长因子-β(transforming growth factor-β,TGF-β)被公认为是参与EMT最重要的促纤维化因子[6]。本文研究的白细胞介素样的EMT诱导因子(interleukin-like epithelial-mesenchymal transition inducer,ILEI)参与肿瘤细胞的侵袭、转移等多种生物过程。本研究采用UUO小鼠和人近端肾小管上皮细胞(HK-2细胞),分别从体内及体外两个方面探讨ILEI是否参与肾间质纤维化的形成,以期丰富肾间质纤维化的分子理论基础,为慢性肾脏病的治疗开发新思路。
1 材料与方法 1.1 材料SPF级雄性小鼠24只(美国癌症研究所引进,中国医科大学实验动物中心提供),动物批号:SCXK(辽)2008-0005,3~4周龄,体质量18~22 g。HK-2细胞系(中国典型培养物保藏中心)。人TGF-β1(美国PEPROTECH公司);DMEM培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);ILEI抗体(英国Abcam公司);凝胶成像分析仪(北京六一生物科技有限公司);倒置相差显微镜(中国麦克奥迪公司)。
1.2 方法 1.2.1 动物模型的制备及分组选取4~6周龄SPF级健康雄性小鼠24只,于中国医科大学实验动物部适应性喂养1周。按体质量分层后随机分为3组:假手术组、UUO模型7 d组、UUO模型14 d组,每组8只。0周时,以10%水合氯醛(3.5 mL/kg)进行腹腔注射麻醉,将小鼠固定于手术台上,腹部备毛,正中左侧旁切口,打开腹腔,暴露左肾,游离输尿管。其中模型组小鼠在输尿管近端及远端分别以4.0丝线结扎,中间离断关腹;假手术组仅游离左侧输尿管,不进行结扎;75%乙醇消毒切口。放入饲养笼内等待苏醒,自由饮食。术后7 d处死8只小鼠,术后14 d处死余下小鼠,留取手术侧肾脏组织用于后续检测。
1.2.2 Masson染色取小鼠肾脏组织固定48 h,脱水,透明,包埋,切片后烘干。染色前,切片脱蜡,梯度乙醇脱水,入Masson复合染液5 min,醋酸洗液洗片,磷钨酸染色8 min,醋酸洗液再次洗片,甲苯胺蓝染色3 min,醋酸洗液冲洗、经乙醇脱水、透明后封片。
1.2.3 免疫组织化学染色小鼠肾组织石蜡切片,经枸盐酸盐修复,4 ℃下滴加一抗(1:200)过夜后,37 ℃下滴加二抗孵育30 min,DAB显色,脱水、透明、中性树胶封片。ILEI阳性在镜下呈棕黄色,进行定位分析。采用Image-Pro Plus 6.0图像分析系统进行半定量分析,每张切片选取5个高倍视野,测平均吸光度,取均值作比较。
1.2.4 细胞培养复苏HK-2细胞后,加入含有10%胎牛血清的DMEM培养基,在37 ℃含有5%CO2培养箱中培养。待细胞生长状态较佳时收集细胞,接种于T25塑料培养瓶中并分成正常对照组、5 ng/mL TGF-β1组、10 ng/mL TGF-β1组,每组3×105个细胞。置于37 ℃、5%CO2的培养箱内培养24 h,培养基更换为无血清DMEM,分别加入5和10 ng/mL的TGF-β1,将不添加TGF-β1处理组作为正常对照组。进行时间依赖性实验时,控制每组TGF-β1处理浓度不变,将5 ng/mL TGF-β1组及10 ng/mL TGF-β1组细胞再置于37 ℃、5%CO2的培养箱内分别培养24、48及72 h。将各组细胞在相差显微镜(100×)下拍照。
1.2.5 Western blotting提取细胞总蛋白,BCA法测定总蛋白浓度;制备SDS-PAGE胶,上样,跑胶,转膜,封闭,加一抗4 ℃孵育过夜(ILEI抗体稀释比例为1:1 000),加二抗37 ℃孵育45 min,加ECL液显影,抗体剥脱,采用Gel-Pro-Analyzer凝胶图像分析系统进行半定量分析。
1.3 统计学分析采用SPSS 19.0统计软件进行统计学分析,小鼠肾组织中ILEI蛋白的表达水平以x±s表示,采用单因素方差分析进行比较,P < 0.05为差异有统计学意义。所有实验至少重复3次。
2 结果 2.1 肾组织的病理改变Masson染色光镜下可见假手术组小鼠肾组织结构清晰,染色均一,未见明显病变;UUO模型7 d组肾组织结构病变较为严重,部分肾小球皱缩深染,部分肾小管萎缩并出现蓝色胶原蛋白沉积,伴有散在分布的血细胞浸出,肾小管上皮细胞肿胀,肾间质萎缩,间质区部分出现蓝色胶原蛋白沉积;UUO模型14 d组肾组织结构病变严重,部分肾小球皱缩,部分肾小管萎缩,肾小管腔不可见,肾小管上皮细胞肿胀,可见空泡变性,细胞扁平,肾间质萎缩坏死,间质区大量蓝色胶原蛋白沉积。见图 1。
|
| A, sham-operation group; B, 7-day UUO model group; C, 14-day UUO model group. 图 1 肾组织Masson染色分析×200 Fig.1 Masson staining of renal tissue ×200 |
2.2 免疫组织化学法检测ILEI在肾组织中表达
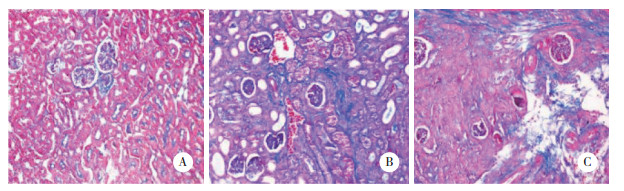
光镜下观察每组小鼠的肾组织,假手术组小鼠肾组织中可见微量ILEI棕黄色阳性表达颗粒,UUO模型7 d组小鼠肾组织中ILEI棕黄色阳性表达颗粒明显增多,UUO模型14 d组小鼠肾组织中ILEI棕黄色阳性表达颗粒减少。假手术组、UUO模型7 d组、UUO模型14 d组ILEI平均吸光度值分别为0.002 0±0.000 5、0.024 6±0.006 1、0.001 7±0.000 5(P < 0.05)。见图 2。
|
| A, sham-operation group; B, 7-day UUO model group; C, 14-day UUO model group. 图 2 ILEI表达的免疫组织化学分析×400 Fig.2 ILEI expression analyzed by immunohistochemistry ×400 |
2.3 TGF-β1诱导肾小管上皮细胞形态改变
5 ng/mL TGF-β1处理HK-2细胞72 h后,应用倒置显微镜观察各组细胞形态变化。正常对照组HK-2细胞具有上皮细胞典型的铺路石样形态,为椭圆形或圆形。TGF-β1诱导后,HK-2细胞间隙增宽,细胞形态变长、变大,同倍率视野内的细胞数量减少。见图 3。

|
| A, normal control group; B, HK-2 cells treated with 5 ng/mL TGF-β1 for 72 hours. 图 3 倒置显微镜下观察TGF-β1诱导对HK-2细胞形态的影响×100 Fig.3 Morphological changes in HK-2 cells treated by TGF-β1 observed under an inverted microscope ×100 |
2.4 TGF-β1诱导肾小管上皮细胞ILEI的蛋白表达
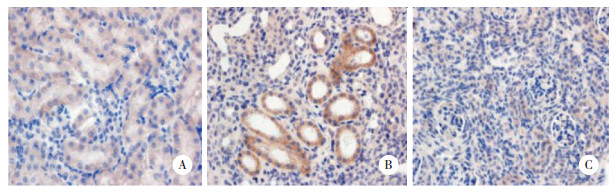
Western blotting结果证实:HK-2细胞几乎不表达ILEI,经TGF-β1诱导后,其ILEI表达量逐渐增多。且随着TGF-β1作用时间延长ILEI表达量逐渐升高,48 h达到高峰(P < 0.05),72 h与24和48 h比较明显下降(P < 0.05),见图 4。
|
| A,normal control group;5 ng/mL TGF-β1 group at(B)24,(D)48,and(F)72 hours; 10 ng/mL TGF-β1 group at(C)24,(E)48,and(G)72 hours. * P < 0.05 vs normal control group;# P < 0.05 vs 24 hours within group;△ P < 0.05 vs 48 hours within group. 图 4 不同浓度的TGF-β1作用HK-2细胞对ILEI蛋白表达的影响 Fig.4 ILEI expression in HK-2 cells treated with TGF-β1 for different time periods and at different concentrations |
3 讨论
纤维化是多种慢性疾病进展到终末期时共同经历的病理过程,肾间质纤维化是慢性肾脏病发展为终末期肾功能衰竭的病理表现。肾间质纤维化影响慢性肾脏疾病的预后并主导肾脏疾病的转归。肌成纤维细胞是一群位于肾间质、具有平滑肌细胞和成纤维细胞特征的一类细胞,同时也是产生细胞外基质的主要效应细胞。目前认为,肾间质纤维化以肌成纤维细胞增殖和活化、促进细胞外基质大量产生和异常沉积为特征[7]。据文献报道,EMT与肿瘤侵袭、转移[8]、复发[9]和器官纤维化等疾病的病理过程密切相关。EMT是间质肌成纤维细胞的重要来源,是肾脏纤维化形成的重要环节[10]。肾小管上皮细胞是最易受损的肾脏固有细胞,研究[11]表明,发生EMT的肾小管上皮细胞是肌成纤维细胞的主要来源之一,其维持和促进肾脏纤维化的作用已成为近年研究热点。本研究针对慢性肾脏病肾间质纤维化的发生机制进行分子研究,为早期控制疾病进展及优化患者治疗方案提供新思路。
EMT是指肾脏受损后,肾小管上皮细胞丧失了原有上皮细胞的表型,获得间质细胞的形态和特征。这一过程包括4个关键环节:(1)上皮细胞失去黏附特性;(2)间充质细胞标志蛋白如α-平滑肌肌动蛋白、纤连蛋白重新合成;(3)肾小管基底膜被破坏;(4)细胞的侵袭和迁移能力明显增强[12]。有许多细胞通路激活并刺激EMT发生,如TGF-β、成纤维细胞生长因子等。其中,TGF-β1作为最重要的促纤维化因子,是EMT的核心因子,启动并调节EMT的全过程[12]。研究[13]已证明,几乎所有慢性肾脏疾病的人类标本或动物研究模型中均可检测到TGF-βl表达上调。
2002年发现的蛋白序列相似度为3的类细胞因子家族(family with similarity 3,FAM3)包括4个成员(FAM3A、FAM3B、FAM3C、FAM3D)。现有研究表明,FAM3基因家族成员可能在糖尿病、肿瘤等多种重大疾病的发生发展过程中起重要作用。FAM3C是FAM家族成员之一,又称为ILEI,最初是作为参与常染色体隐性遗传的非综合征性听力丧失的候选基因被发现,是视网膜形成的关键因子[14]。近年来,先后有学者发现ILEI在多种生物过程中发挥作用,包括阿尔茨海默病[15]、骨密度调控[16]、肾间质纤维化[17]以及肿瘤细胞的侵袭和转移等[18]。
根据UUO小鼠模型Masson染色,可以观察到假手术组小鼠肾组织中肾间质未见明显病变,UUO模型7 d组小鼠肾间质区部分出现蓝色胶原蛋白沉积,UUO模型14 d组小鼠肾间质区大量蓝色胶原蛋白沉积,肾脏纤维化明显,提示肾小管EMT模型制作成功。免疫组织化学结果显示,与假手术组比较,UUO模型7 d组小鼠肾组织中ILEI表达量明显增多,UUO模型14 d组ILEI表达量较前下降。在UUO模型建立数小时后黏附因子和趋化因子分泌增加,并持续7~10 d,此时是炎症反应的高峰期,ILEI表达量升高明显,说明ILEI很可能参与了该病变过程。
另外本研究发现,HK-2细胞被TGF-β1诱导后,其ILEI的蛋白表达量在48 h内也显著增多。既往研究[19]已证实,TGF-β1能够诱导HK-2细胞发生肾小管上皮细胞转分化。本研究应用TGF-β1诱导HK-2细胞后,肾小管上皮细胞发生了形态学的改变,且随着TGF-β1作用时间的延长,ILEI的表达量逐渐升高。因此,推测ILEI与TGF-β1诱导的肾小管EMT存在密切关系。
综上所述,本研究的体内及体外实验结果证实了ILEI在肾间质纤维化中表达量变化明显,认为其参与肾间质纤维化的形成,在肾间质纤维化中扮演重要角色。
| [1] |
WEBSTER AC, NAGLER EV, MORTON RL, et al. Chronic kidney disease[J]. Lancet, 2017, 389(10075): 1238-1252. DOI:10.1016/S0140-6736(16)32064-5 |
| [2] |
DJUDJAJ S, BOOR P. Cellular and molecular mechanisms of kidney fibrosis[J]. Mol Aspects Med, 2019, 65: 16-36. DOI:10.1016/j.mam.2018.06.002 |
| [3] |
LIU MN, NING XX, LI R, et al. Signalling pathways involved in hypoxia-induced renal fibrosis[J]. J Cell Mol Med, 2017, 21(7): 1248-1259. DOI:10.1111/jcmm.13060 |
| [4] |
HESKETH EE, VEMON MA, DING P, et al. A murine model of irreversible and reversible unilateral ureteric obstruction[J]. J Vis Exp, 2014(94): e52559-e52559. DOI:10.3791/52559 |
| [5] |
LOVISA S, LEBLEU VS, TAMPE B, et al. Epithelial to mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis[J]. Nat Med, 2015, 21(9): 998-1009. DOI:10.1038/nm.3902 |
| [6] |
DU J, HONG SL, DONG L, et al. Dynamic sialylation in transforming growth factor-β (TGF-β) -induced epithelial to mesenchymal transition[J]. J Biol Chem, 2015, 290(19): 12000-12013. DOI:10.1074/jbc.M115.636969 |
| [7] |
CHEN SX, LIU JL, YANG M, et al. Fn14, a downstream target of the TGF-β signaling pathway, regulates fibroblast activation[J]. PLoS One, 2015, 10(12): e0143802. DOI:10.1371/journal.pone.0143802 |
| [8] |
BENZOUBIR N, MUSSINI C, LEJAMTEL C, et al. Gamma-smooth muscle actin expression is associated with epithelial-mesenchymal transition and stem-like properties in hepatocellular carcinoma[J]. PLoS One, 2015, 10(6): e0130559. DOI:10.1371/journal.pone.0130559 |
| [9] |
XIA HP, CHEN JX, SHI M, et al. EDIL3 is a novel regulator of epithelial-mesenchymal transition controlling early recurrence of hepatocellular carcinoma[J]. J Hepatol, 2015, 63(4): 863-873. DOI:10.1016/j.jhep.2015.05.005 |
| [10] |
CAREW RM, WANG B, KANTHARIDIS P. The role of EMT in renal fibrosis[J]. Cell Tissue Res, 2012, 347(1): 103-116. DOI:10.1007/s00441-011-1227-1 |
| [11] |
FU HY, TIAN Y, ZHOU LL, et al. Tenascin-C is a major component of the fibrogenic niche in kidney fibrosis[J]. J Am Soc Nephrol, 2017, 28(3): 785-801. DOI:10.1681/ASN.2016020165 |
| [12] |
HUMPHREYS BD. Mechanisms of renal fibrosis[J]. Annu Rev Physiol, 2017, 7(1): 10-17. DOI:10.1146/annurev-physiol-022516-034227 |
| [13] |
YAN Y, MA L, ZHOU X, et al. Src inhibition blocks renal interstitial fibroblast activation and ameliorates renal fibrosis[J]. Kidney Int, 2016, 89(1): 68-81. DOI:10.1038/ki.2015.293 |
| [14] |
KATAHIRA T, NAKAGIRI S, TERADA K, et al. Secreted factor FAM3C (ILEI) is involved in retinal laminar formation[J]. Biochem Biophys Res Commun, 2010, 392(3): 301-306. DOI:10.1016/j.bbrc.2009.12.180 |
| [15] |
HASEGAWA H, LIU L, TOOYAMA I, et al. The FAM3 superfamily member ILEI ameliorates Alzheimer's disease-like pathology by destabilizing the penultimate amyloid-β precursor[J]. Nat Commun, 2014, 5: 3917. DOI:10.1038/ncomms4917 |
| [16] |
MÄÄTTÄÄ JA, BENDRE A, LAANTI M, et al. Fam3c modulates os-teogenic cell differentiation and affects bone volume and cortical bone mineral density[J]. Bonekey Rep, 2016, 5: 787. DOI:10.1038/bonekey.2016.14 |
| [17] |
ZHAO X, LUO G, FAN Y, et al. ILEI is an important intermediate participating in the formation of TGF-β1-induced renal tubular EMT[J]. Cell Biochem Funct, 2018, 36(2): 46-55. DOI:10.1002/cbf.3316 |
| [18] |
NOGUCHI K, DINCMAN TA, DALTON AC, et al. Interleukin-like EMT inducer (ILEI) promotes melanoma invasiveness and is transcriptionally up-regulated by upstream stimulatory factor-1(USF-1)[J]. J Biol Chem, 2018, 293(29): 11401-11414. DOI:10.1074/jbc.RA118.003616 |
| [19] |
LEASK A, ABRAHAM DJ. TGF-β signaling and the fibrotic response[J]. FASEB J, 2004, 18(7): 816-827. DOI:10.1096/fj.03-1273rev |
 2019, Vol. 48
2019, Vol. 48