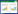文章信息
- 董乃萱, 顾卉, 刘丹, 魏晓伟, 马巍, 马玲, 袁正伟
- DONG Naixuan, GU Hui, LIU Dan, WEI Xiaowei, MA Wei, MA Ling, YUAN Zhengwei
- 孕妇血清淀粉样P物质作为神经管缺陷产前标志物的研究
- Serum Amyloid P Component in Pregnant Women as a Biomarker for Prenatal Diagnosis of Fetal Neural Tube Defects
- 中国医科大学学报, 2019, 48(10): 883-886
- Journal of China Medical University, 2019, 48(10): 883-886
-
文章历史
- 收稿日期:2018-11-06
- 网络出版时间:2019-09-27 17:12
神经管缺陷(neural tube defects, NTDs)是最常见和致残率最高的出生缺陷之一[1], 通过在怀孕早期增加母亲的叶酸摄入量可以降低NTDs的发生率, 但仍不能完全预防所有NTDs的发生[2-3]。因此, 早期发现和诊断NTDs至关重要。蛋白组学的发展有助于识别新的生物标志物, 建立与NTDs相关的分子网络[4]。
血清淀粉样P物质(serum amyloid P component, SAP)是正五聚蛋白家族的一员, 在肝细胞中产生并循环于血液中, 可以结合所有类型的淀粉样纤维[5]。SAP在生理状态下可以特异地、Ca2+依赖性地与DNA、染色质结合, 参与因细胞死亡而暴露的染色质的清除[6]。研究发现, SAP有助于神经退行性相关疾病的诊断。通过测量脑脊液中SAP的含量可以帮助识别早期阿尔兹海默病和轻度认知障碍[7], SAP有潜力成为诊断帕金森病的血清标志物[8]。在唐氏综合征中, SAP表达显著下调, 有成为其新型生物标志物的可能[9]。
前期研究中, 本研究组利用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation, iTRAQ)技术筛查正常孕妇和胎儿患有NTDs孕妇血清中的差异蛋白, 发现SAP可能与NTDs相关。目前尚未有报道称SAP同NTDs相关, 因此, 本研究将重点验证SAP在正常孕妇血清和NTDs胎儿孕妇血清中的表达情况, 探讨其作为NTDs产前标志物的可能。
1 材料与方法 1.1 血清样本收集收集2010年1月至2011年12月在中国医科大学附属盛京医院经产前超声诊断且在胎儿引产后确诊的NTDs共12例(病例组)。根据病例组采集的孕周、孕妇年龄和采集时间等条件匹配12例正常孕妇, 作为对照组。分别于12、14、15、19、21、23、26、28、29、33、37、38孕周采集血清样本。于清晨空腹抽取2组孕妇外周静脉血5 mL, 立即放入4 ℃静置1~2 h, 4 ℃离心10 min (1 600 r/min)。吸取上清后分装置于-80 ℃保存备用。本研究经中国医科大学附属盛京医院医学伦理委员会批准同意, 所有研究对象均知情同意。
1.2 方法采用Western blotting验证差异蛋白的表达水平。取2组血清100倍稀释后, 12 μL/孔上样行10%SDS-PAGE, 电转移至PVDF膜。5%脱脂牛奶中封闭2 h, 加入鼠抗人SAP单克隆抗体(1︰1 000稀释, 中国proteintech公司)和鼠抗人GAPDH单克隆抗体(内参照), 4 ℃反应过夜。次日, 用TBST洗膜3次后, 加入羊抗鼠IgG (1︰2 000稀释, 中国中杉金桥公司), 常温下置于摇床反应2 h, 二抗均带有辣根过氧化物酶标记物。用TBST洗膜5次后, 采用ImmobilonTM Western (美国Millipore公司)进行底物的化学发光。经Image J软件(美国National Institutes of Health公司)量化条带, 以目的蛋白条带与内参照蛋白条带灰度值的比值表示目的蛋白的相对表达水平。实验重复3次。
1.3 统计学分析采用SPSS 19.0软件进行统计分析。2组间的比较采用配对t检验, P<0.05为差异有统计学意义。为判断利用SAP早期诊断NTDs的价值, 绘制受试者操作特征(receiver operating characteristic, ROC)曲线, 并计算ROC曲线下面积(area under curve, AUC)。
2 结果 2.1 SAP在不同妊娠时期孕妇血清中的表达水平SAP蛋白在不同妊娠时期孕妇血清中均有表达, 主要以27×103条带分布(图 1A)。SAP蛋白的表达水平存在一定的时间依赖性, 在妊娠12周开始呈上调趋势, 在妊娠21~28周达到峰值, 并在妊娠28周以后趋于稳定(图 1B)。在妊娠12~19周、21~28周时, SAP在病例组孕妇血清中的表达明显下调, 差异有统计学意义(P<0.05)。妊娠12~19周、21~28周时, 病例组较对照组分别下调48%~50%、79%~80% (图 1B)。
|
| A, Western blotting results of SAP protein; B, SAP expression of the case group was lower than that of the normal control group significantly at 12 to 19 weeks and 21 to 28 weeks during pregnancy. * P < 0.05 vs normal group. W, weeks. 图 1 不同妊娠时期SAP蛋白在2组孕妇血清中的表达 Fig.1 Expression of SAP protein in the serum of normal group and case group during different gestational weeks |
2.2 ROC曲线分析
如图 2所示, AUC=0.770 8 (95%CI:0.573 9~0.967 8), P=0.024。根据ROC曲线计算, Youden’s指数最大值时, 诊断效能客观上达到最佳的诊断分界点, 此时敏感度为83.33%, 特异度为66.67%。
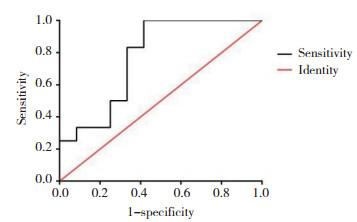
|
| 图 2 ROC曲线 Fig.2 Receiver operating characteristic curve |
3 讨论
目前, NTDs的诊断很大程度上依赖于超声显像对胎儿的结构评估, 生化特征(如母体血清中甲胎蛋白的含量)则被用作次级筛查工具[10-12]。研究[13]显示, 常规超声检查诊断NTDs的敏感度和特异度分别为75.5%和34.9%。但超声诊断胎儿腰骶部微小病变的敏感度较差, 且超声诊断主要依赖于超声检查者的经验和手法的娴熟程度。甲胎蛋白测定的阳性诊断率高, 但特异度低, 易受到其他因素的影响, 如先天性腹裂、死胎等[14-15]。母体血清学检查是一种安全、无创的产前检查, 如果能找到更具敏感度和特异度的血清标志物, 则更利于早期诊断NTDs。本研究中, ROC结果显示, SAP诊断胎儿NTDs的敏感度为83.33%, 特异度为66.67%。
SAP为血清正常糖蛋白, 被认为可以调控染色质的降解, 在早期阶段同凋亡细胞结合, 参与体内细胞凋亡的进程[16]。有序的细胞死亡调节了胚胎发育的正常过程, 如神经管背腹构型[17]。但这种受基因调控的细胞死亡极易受到各种因素的干扰, 引起发育异常, 从而导致畸形的发生。研究[18-19]显示, 过度的神经上皮细胞凋亡与NTDs的发病密切相关。因此, 推测SAP在NTDs的母体血清中表达下调可能源于细胞的过度凋亡。组蛋白H1/H5和H4与SAP的123~132残基具有高度同源性, SAP在细胞凋亡和坏死后可与核抗原结合, 清除致病性细胞碎片[20]。当NTDs发生时, 细胞凋亡增加, 导致细胞碎片增多, 大量的SAP与这些细胞碎片结合, 从而导致血清中SAP的含量降低。
SAP作为正五聚体蛋白家族的一员, 还参与创伤修复和先天性免疫应答, 是体内的急性时相蛋白[21]。在慢性神经退行性疾病中, 补体激活少突神经胶质, 受损脑组织的SAP表达水平与包覆少突神经胶质的补体C4d和C3d的表达水平相平行, 推测SAP参与补体的激活途径[22-23]。研究[24]发现, 在室间隔缺损患者的血清中, SAP水平也显著降低, SAP与室间隔缺损患者的先天免疫功能下降相关, SAP表达下调提示患者对感染和肺部疾病更加易感。在胚胎的正常发育过程中, 固有免疫起很重要的作用, 推测SAP、固有免疫系统与NTDs三者密切相关。SAP的血清浓度异常, 可以提示胎儿有NTDs的风险, SAP有作为无创产前诊断的血清生物标志物的可能。
在妊娠相关的疾病中, 已有SAP作为唐氏综合征筛查的候选血清标志物的报道[25], 但目前尚没有SAP在NTDs诊断中应用的报道。本研究发现在胎儿NTDs的孕妇血清中SAP表达显著降低, AUC达0.770 8, 提示SAP有作为NTDs产前诊断标志物的潜在可能。
| [1] |
LUPO PJ, ZOHN I. Papers from the ninth international conference on neural tube defects[J]. Birth Defects Res, 2017, 109(2): 65-67. DOI:10.1002/bdr2.1000 |
| [2] |
KHOSHNOOD B, LELONG N. Trends in the prevalence of neural tube defects:a tale of two policies[J]. Paediatr Perinat Epidemiol, 2017, 31(4): 301-303. DOI:10.1111/ppe.12367 |
| [3] |
OBEID R, HOLZGREVE W, PIETRZIK K. Is 5-methyltetrahydrofolate an alternative to folic acid for the prevention of neural tube defects?[J]. J Perinat Med, 2013, 41(5): 469-483. DOI:10.1515/jpm-2012-0256 |
| [4] |
PUVIRAJESINGHE TM, BORG JP. Neural tube defects:from a proteomic standpoint[J]. Metabolites, 2015, 5(1): 164-183. DOI:10.3390/metabo5010164 |
| [5] |
URBÁNYI Z, FORRAI E, SÁRVÁRI M, et al. Glycosaminoglycans inhibit neurodegenerative effects of serum amyloid P component in vitro[J]. Neurochem Int, 2005, 46(6): 471-477. DOI:10.1016/j.neuint.2004.12.001 |
| [6] |
HELMFORS L, BERGKVIST L, BRORSSON AC. Serum amyloid P component ameliorates neurological damage caused by expressing a lysozyme variant in the central nervous system of Drosophila melanogaster[J]. PLoS One, 2016, 11(7): e0159294. DOI:10.1371/journal.pone.0159294 |
| [7] |
VERWEY NA, SCHUITEMAKER A, VAN DER FLIER WM, et al. Serum amyloid P component as a biomarker in mild cognitive impairment and Alzheimer's disease[J]. Dement Geriatr Cogn Disord, 2008, 26(6): 522-527. DOI:10.1159/000178756 |
| [8] |
CHEN HM, LIN CY, WANG V. Amyloid P component as a plasma marker for Parkinson's disease identified by a proteomic approach[J]. Clin Biochem, 2011, 44(5-6): 377-385. DOI:10.1016/j.clinbiochem.2011.01.002 |
| [9] |
YU B, ZHANG B, WANG J, et al. Preliminary proteomic-based identification of a novel protein for Down's syndrome in maternal serum[J]. Exp Biol Med (Maywood), 2012, 237(5): 530-539. DOI:10.1258/ebm.2012.011312 |
| [10] |
SEPULVEDA W, WONG AE, SEPULVEDA F, et al. Prenatal diagnosis of spina bifida:from intracranial translucency to intrauterine surgery[J]. Childs Nerv Syst, 2017, 33(7): 1083-1099. DOI:10.1007/s00381-017-3445-7 |
| [11] |
KRANTZ D, HALLAHAN T, JANIK D, et al. Maternal serum screening markers and adverse outcome:a new perspective[J]. J Clin Med, 2014, 3(3): 693-712. DOI:10.3390/jcm3030693 |
| [12] |
李笑天, 乐小妮, 何晓明, 等. 出生缺陷产前诊断的临床模式研究[J]. 中华小儿外科杂志, 2005, 26(9): 449-452. DOI:10.3760/cma.j.issn.0253-3006.2005.09.001 |
| [13] |
顾卉, 黄天楚, 梅妍, 等. 孕妇血清微小RNA-423对胎儿神经管缺陷产前诊断的意义[J]. 国际儿科学杂志, 2015, 42(3): 331-333, 337. DOI:10.3760/cma.j.issn.1673-4408.2015.03.026 |
| [14] |
潘三强, 宿宝贵, 吕来清. 神经管畸形产前诊断方法的研究进展[J]. 现代临床医学生物工程学杂志, 2005, 11(1): 66-68. DOI:10.3760/cma.j.issn.1674-1927.2005.01.033 |
| [15] |
安东.利用iTRAQ技术筛查神经管畸形产前诊断的分子标志物及其在畸形发生过程中作用机制研究[D].沈阳: 中国医科大学, 2015. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2993985
|
| [16] |
FAMILIAN A, ZWART B, HUISMAN HG, et al. Chromatin-independent binding of serum amyloid P component to apoptotic cells[J]. J Immunol, 2001, 167(2): 647-654. DOI:10.4049/jimmunol.167.2.647 |
| [17] |
CHAPPELL JH JR, WANG XD, LOEKEN MR. Diabetes and apoptosis:neural crest cells and neural tube[J]. Apoptosis, 2009, 14(12): 1472-1483. DOI:10.1007/s10495-009-0338-6 |
| [18] |
WANG L, LIN S, YI D, et al. Apoptosis, expression of PAX3 and P53, and caspase signal in fetuses with neural tube defects[J]. Birth Defects Res, 2017, 109(19): 1596-1604. DOI:10.1002/bdr2.1094 |
| [19] |
WU LN, WEI XW, FAN Y, et al. Altered expression of 14-3-3ζ protein in spinal cords of rat fetuses with spina bifida aperta[J]. PLos One, 2013, 8(8): e70457. DOI:10.1371/journal.pone.0070457 |
| [20] |
吴瑾, 熊思东, 吴厚生. 血清淀粉样P物质的结构、表达调控及功能[J]. 生命的化学, 2001, 21(4): 283-285. DOI:10.3969/j.issn.1000-1336.2001.04.008 |
| [21] |
CRAWFORD JR, BJORKLUND NL, TAGLIALATELA G, et al. Brain serum amyloid P levels are reduced in individuals that lack dementia while having Alzheimer's disease neuropathology[J]. Neurochem Res, 2012, 37(4): 795-801. DOI:10.1007/s11064-011-0674-0 |
| [22] |
AKIYAMA H, YAMADA T, KAWAMATA T, et al. Association of amyloid P component with complement proteins in neurologically diseased brain tissue[J]. Brain Res, 1991, 548(1-2): 349-352. DOI:10.1016/0006-8993(91)91148-t |
| [23] |
CUBEDO J, PADRÓ T, BADIMON L. Coordinated proteomic signature changes in immune response and complement proteins in acute myocardial infarction:the implication of serum amyloid P-component[J]. Int J Cardiol, 2013, 168(6): 5196-5204. DOI:10.1016/j.ijcard.2013.07.181 |
| [24] |
ZHANG X, WANG K, YANG Q, et al. Acute phase proteins altered in the plasma of patients with congenital ventricular septal defect[J]. Proteomics Clin Appl, 2015, 9(11/12): 1087-1096. DOI:10.1002/prca.201400166 |
| [25] |
HEYWOOD W, WANG D, MADGETT TE, et al. The development of a peptide SRM-based tandem mass spectrometry assay for prenatal screening of Down syndrome[J]. J Proteomics, 2012, 75(11): 3248-3257. DOI:10.1016/j.jprot.2012.03.037 |
 2019, Vol. 48
2019, Vol. 48