文章信息
- 封宇, 刘颖, 阎雪晶, 欧阳嶷
- 双侧颞极白质受累的神经系统遗传疾病12例临床诊断分析
- Diagnostic Analysis of 12 Cases of Hereditary Nervous System Diseases with Bilateral Temporal Pole Involvement
- 中国医科大学学报, 2019, 48(1): 90-93
- Journal of China Medical University, 2019, 48(1): 90-93
-
文章历史
- 收稿日期:2018-05-27
- 网络出版时间:2019-01-02 09:35
遗传性白质脑病主要累及脑白质,临床表现复杂且常伴有多系统受累,因此诊断较为困难。近年来影像学和分子遗传学研究进展为临床医生寻找病因提供了依据。颅脑MRI所呈现的白质病变形式和特点对疾病的鉴别诊断具有很大作用。双侧颞极受累作为常染色体显性遗传性脑动脉病(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy,CADASIL)患者的特征性颅脑影像学改变已有很多报道[1],然而该影像学表现是否仅为CADASIL的特异表现仍无定论。本研究对12例双侧颞极白质受累的神经系统遗传疾病患者的临床表现、影像学特点和基因诊断结果进行分析,旨在为临床上双侧颞极脑白质受累病变诊断提供参考。
1 材料与方法从我院中心神经遗传疾病数据库150多个神经遗传疾病家系中经颅脑MRI筛查出12例双侧颞极白质受累神经遗传疾病患者,患者就诊时间为2014年5月至2017年10月,12例共11个家系。入选标准:具有经家系图分析的遗传背景;在颅脑MRI的T2加权像或FLAIR序列表现为双侧颞极脑白质高信号。排除标准:有获得性疾病证据患者。收集12例患者的家系资料、首发症状及主要临床表现等。12例均由两名以上有经验的神经内科医师进行专科查体,并行颅脑MRI检查。同时,经知情同意后对部分患者行基因检测及肌电图等检查。
2 结果 2.1 患者家系分析12例患者中,女7例,男5例,年龄19~57岁。符合常染色体显性遗传规律的有6个家系,符合常染色体隐性遗传规律有5个家系。根据患者的临床表现、相关检查及基因检测结果,上述双侧颞极脑白质受累患者诊断如下:CADASIL患者4例(33.3%);强直性肌营养不良1型(myotonic dystrophy type 1,DM1)患者4例(33.3%);尼曼-匹克病C型(Niemann-Pick disease type C,NPC)患者1例(8.3%);遗传性弥漫性白质脑病合并轴索球样变(Hereditary diffuse leukoencephalopathy with axonal spheroids,HDLS)患者1例(8.3%);尚不明确病因2例(16.7%)。
2.2 患者的临床表现、MRI特点和基因检测结果4例CADASIL患者临床表现为短暂性脑缺血发作和缺血性脑卒中,1例出现头痛。2例行基因检测发现NOTCH3基因杂合突变。MRI检查结果显示,1例出现不连续外囊受累,1例出现双侧额叶、顶叶及额顶叶分水岭区异常片状长T2信号;4例DM1患者临床表现为肌肉萎缩、无力,基因检测发现DMPK基因3’UTR区CTG重复 > 50次;NPC患者临床表现为记忆力减退,肢体活动笨拙。基因检测发现NPC1基因杂合突变。颅脑除了双颞极白质及侧脑室白质长T2信号外,还可见小脑上部脑叶萎缩;HDLS患者出现双侧额叶、左侧颞叶及岛叶大片状软化灶,临床表现为进行性智力减退及运动症状,基因检测发现CSF1R杂合突变;诊断不明确的2例患者均可见广泛白质受累,并累及脑干和桥臂。见图 1和表 1。
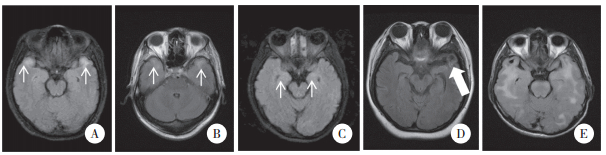
|
| A,CADASIL患者;B,DM1患者;C,NPC患者;D,HDLS患者;E,未确诊患者.细箭头示双侧颞极白质受累,粗箭头示左侧颞叶软化灶. 图 1 患者颅脑MRI表现 |
| 病例序号 | 临床表现 | 双颞极部位 | MRI表现 | 诊断 | 基因检测结果 |
| 1 | 头痛、偏瘫、偶有视物模糊 | 内侧 | 双侧额叶、顶叶及额顶叶分水岭区异常片状长T2信号 | CADASIL | NOTCH3基因杂合突变(c.467G > A) |
| 2 | 阵发性头痛、半身麻木、记忆力减退 | 前部 | 双侧外囊、双侧脑室旁及半卵圆中心点状长T2信号 | CADASIL | NE |
| 3 | 一过性言语不清、左上肢麻木 | 前部 | 脑内多发梗塞灶,白质为主,累及皮质下、脑干 | CADASIL | NOTCH3基因杂合突变(c.397G > T) |
| 4 | 偏瘫、言语不清、视物模糊 | 前部 | 双侧额顶叶皮质下、脑室旁、半卵圆中心多发斑片状长T2信号 | CADASIL | NE |
| 5 | 肌肉萎缩、无力 | 前部 | 双侧额顶叶多发点状长T2信号 | DM1 | DMPK基因3' UTR区CTG重复 > 50次 |
| 6 | 肌肉萎缩、无力 | 前部 | 右额叶及双顶叶双颞叶及双侧脑室前角长T2信号 | DM2 | DMPK基因3' UTR区CTG重复 > 50次 |
| 7 | 四肢无力 | 前、内部 | 双侧基底节腔梗灶 | DM3 | DMPK基因3' UTR区CTG重复 > 50次 |
| 8 | 精细动作困难 | 前、内部 | 双侧大脑皮质下、侧脑室旁多发点状长T2信号 | DM4 | DMPK基因3' UTR区CTG重复 > 50次 |
| 9 | 记忆力下降、肢体活动笨拙 | 内侧 | 双侧侧脑室后角白质长T2信号,小脑上部脑叶萎缩 | NPC可能性大 | NPC1基因杂合突变(c.3176G > A) |
| 10 | 头痛、记忆力减退、易怒 | 皮质白质均受累 | 双侧额叶、左侧颞叶及岛叶大片状软化灶 | HDLS | CSF1R杂合突变(c.1084C > T) |
| 11 | 发作性走路不稳 | 颞叶白质大面积 | 双侧脑室旁、半卵圆中心、基底节、脑干、小脑多发长T2信号 | 未确诊 | 未发现致病突变 |
| 12 | 双下肢无力 | 颞叶白质大面积 | 广泛脑白质受累 | 未确诊 | 未发现致病突变 |
| NE,患者未行基因检测. | |||||
3 讨论
研究[2]表明,双侧颞极受累在成人神经系统遗传疾病中并不多见。本研究筛查了150多个神经系统遗传疾病家系,仅发现11个家系共12例双侧颞极受累神经系统遗传疾病患者,与以往研究结果一致。CADASIL是一种最常见的中年起病,表现为反复卒中发作、痴呆和偏头痛的遗传性脑小动脉病,是由位于19号染色体(19p13.2-p13.1)的NOTCH3基因突变引起的[3]。CADASIL最主要的临床表现是短暂性脑缺血发作和缺血性卒中[4]。CADASIL患者颅脑MRI主要表现为皮质下脑白质异常信号、腔隙梗死灶及脑内微出血[5]。白质病变主要累及双侧半卵圆中心,也可累及基底核及丘脑,白质病变的范围与年龄和疾病的进展有关[6],其中双侧颞极和外囊的白质病变高度提示CADASIL [5]。本研究12例患者中有4例CADASIL,说明CADASIL确实是双侧颞极受累神经系统遗传疾病的重要病因。除此之外,还存在额叶顶叶皮质下、侧脑室旁及半卵圆中心的多发病变,这与既往研究[5]结果一致。本研究仅有1例患者出现不连续的外囊白质受累,明显低于国外研究[6]报道的外囊受累比例(约90%),这可能是与患者的疾病进程有关[7],同时也提示CADASIL外囊的白质病变可能也存在人种和地域差异,有待于今后大样本研究加以证实。
除CADASIL外,本研究还发现有4例DM1患者出现双侧颞极受累。DM1是一种遗传性肌病,主要表现为肌肉强直、肌无力和肌萎缩,还可以导致心脏传导阻滞、白内障以及内分泌紊乱等,部分DM1患者可累及中枢神经系统(central nerve system,CNS),主要表现为嗜睡及淡漠,严重者可智力减退[8]。由于DM1的CNS症状缺乏特异性,临床上往往容易忽视。有研究[9]表明,DM1颅脑MRI表现多样,主要为白质病变、脑室扩张和弥漫性脑萎缩。其中脑白质病变分布广泛,在脑叶、脑干及胼胝体均可见到[10],而颞极白质受累为其特征性改变[11]。在10例DM1患者颅脑MRI研究[12]中,9例见到白质病变,其中6例有双侧颞前部白质异常信号。本研究DM1患者的MRI检查结果显示,脑白质病变主要表现为双侧颞极及各脑叶皮质下点状白质受累,1例可见轻度脑萎缩,这与以往研究结果一致,说明双侧颞极白质病变在DM1患者中并不少见,甚至有些影像学改变出现在CNS症状之前,因此具有较早的预警作用。
本研究结果显示,1例患者发现NPC1基因杂合突变,结合其临床特点及相应检查结果,诊断为NPC可能性大。NPC是由于NPC1或NPC2基因突变引起[13],进而导致单核巨噬细胞系统及神经系统内聚积大量含有神经鞘磷脂的泡沫细胞,出现肝、脾肿大,慢性进展的CNS退行性病变(共济失调、张力失调、语言障碍和垂直性核上性眼肌麻痹等) [14]。以往研究[15-16]显示NPC患者的颅脑MRI无特异表现,可表现为正常,也可出现皮质或小脑萎缩。本研究1例患者颅脑MRI见双侧侧脑室后角白质改变,髓鞘形成不良,小脑上部脑叶萎缩,双侧颞极可见轻微白质受累。其中颞极病变在既往文献中未见报道,说明NPC患者在CNS受累部位上存在差异性。NPC可在学龄期即起病且逐渐进展,最终可能因吞咽困难而行胃造瘘手术[16]。值得注意的是,NPC是一种极少见的常染色体隐性遗传病,理论需2条染色体上同时出现致病性突变才能发病,本例患者临床表现高度符合NPC,这也许否定了其遗传模式,但需要进一步完善相关分子遗传学研究加以证实。
本研究中1例患者表现为双颞极白质皮质均受累,患者与其母亲均在CSF1R基因上发现杂合突变,诊断为HDLS。目前也有学者[17]认为HDLS与显性遗传性色素型正染性脑白质营养不良为同一疾病。HDLS是极少见的成年起病的常染色体显性遗传病,临床表现多样,主要为进行性认知障碍和运动障碍。颅脑MRI主要表现为双侧不对称的额叶为主的脑白质病变、中央萎缩和胼胝体变薄[18],白质病变位于脑室旁的深部脑白质,同时胼胝体和皮质脊髓束也存在,无明显灰质受累[19]。本研究HDLS患者出现双侧额叶及左侧颞叶岛叶大片软化灶,同时累及双侧颞极。随访1年后发现患者在原病灶基础上出现左侧额叶新近病灶。与既往研究[19-20]报道不同的是,患者在累及白质的同时,对应位置皮质亦出现受累,这种改变的机制需进一步研究。
本研究2例患者诊断尚不明确,均出现大面积脑白质受累,排除继发因素后对2例患者进行脑白质病、痉挛性截瘫以及代谢障碍病等相关基因筛查,未见明确的致病突变。
综上所述,双侧颞极白质受累的神经系统遗传疾病不仅限于CADASIL,在许多DM1患者中也可有此表现。此外,还可见于NPC、HDLS。另外,有研究[1]报道伴有皮质下梗死和白质病变的常染色体隐性遗传性脑动脉病的颅脑MRI表现与CADASIL十分相似,也可出现双侧颞极白质受累,临床上应该仔细鉴别。
| [1] |
SAARA T, MARC B, SⅡTONEN M, et al. CADASIL and CARASIL[J]. Brain Pathol, 2014, 24(5): 525-544. DOI:10.1111/bpa.12181 |
| [2] |
AYELET E, ADINA H, IZLEM I. Bilateral temporal lobe disease:looking beyond herpes encephalitis[J]. Insight Imag, 2016, 7(2): 265-274. DOI:10.1007/s13244-016-0481-x |
| [3] |
JOUTEL A, CORPECHOT C, DUCROS A, et al. Notch3 mutations in CADASIL, a hereditary adult-onset condition causing stroke and dementia[J]. Nature, 1996, 383(6602): 707-710. DOI:10.1038/383707a0 |
| [4] |
RIGHART R, DUERING M, GONIK M, et al. Impact of regional cortical and subcortical changes on processing speed in cerebral small vessel disease[J]. Neuroimage Clin, 2013, 2(1): 854-861. DOI:10.1016/j.nicl |
| [5] |
STOJANOV D, ARACKITRENKIC A, VOJINOVIC S, et al. Imaging characteristics of cerebral autosomal dominant arteriopathy with subcortical infarcts and leucoencephalopathy (CADASIL)[J]. Bosnian J Basic Med, 2015, 15(1): 1-8. DOI:10.17305/bjbms.2015.247 |
| [6] |
DONATO ID, BIANCHI S, STEFANO ND, et al. Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy (CADASIL) as a model of small vessel disease:update on clinical, diagnostic, and management aspects[J]. BMC Med, 2017, 15(1): 41. DOI:10.1186/s12916-017-0778-8 |
| [7] |
ZHU S, NAHAS SJ. CADASIL:Imaging characteristics and clinical correlation[J]. Curr Pain Headache Rep, 2016, 20(10): 57. DOI:10.1007/s11916-016-0584-6 |
| [8] |
SCHNEIDERGOLD C, BELLENBERG B, PREHN C, et al. Cortical and subcortical grey and white matter atrophy in myotonic dystrophies type 1 and 2 is associated with cognitive impairment, depression and daytime sleepiness[J]. PLoS One, 2015, 10(6): e0130352. DOI:10.1371/journal.pone.0130352 |
| [9] |
LIU L, LIU HM, LIU ZJ, et al. Myotonic dystrophy type 1 associated with white matter hyperintense lesions:clinic, imaging, and genetic analysis[J]. Chin Med J, 2015, 128(10): 1412-1414. DOI:10.4103/0366-6999.156812 |
| [10] |
MINNEROP M, WEBER B, SCHOENE-BAKE JC, et al. The brain in myotonic dystrophy 1 and 2:evidence for a predominant white matter disease[J]. Brain J Neurol, 2011, 134(Pt 12): 3530-3546. DOI:10.1093/brain/awr299 |
| [11] |
CABADA T, IRIDOY M, JERICÓ I, et al. Brain involvement in myotonic dystrophy type 1:a morphometric and diffusion tensor imaging study with neuropsychological correlation[J]. Arch Clin Neuropsych, 2017, 32(4): 401-412. DOI:10.1093/arclin/acx008 |
| [12] |
KORNBLUM C, REUL J, KRESS W, et al. Cranial magnetic resonance imaging in genetically proven myotonic dystrophy type 1 and 2[J]. J Neurol, 2004, 251(6): 710-714. DOI:10.1007/s00415-004-0408-1 |
| [13] |
任守臣, 高宝勤. 尼曼匹克病C型诊疗新进展[J]. 中国当代儿科杂志, 2015, 17(5): 533-538. |
| [14] |
MENGEL E, KLÜNEMANN HH, LOURENÇO CM, et al. Niemann-Pick disease type C symptomatology:an expert-based clinical description[J]. Orphanet J Rare Dis, 2013, 8(1): 166. DOI:10.1186/1750-1172-8-166 |
| [15] |
VANIER MT. Niemann-Pick diseases type C[J]. Orphanet J Rare Dis, 2010, 5: 16. DOI:10.1186/1750-1172-5-16 |
| [16] |
ABE K, SAKAI N. Patient with Niemann-Pick disease type C:over 20 years' follow-up[J]. BMJ Case Rep, 2017, 2017: bcr-2017220134. DOI:10.1136/bcr-2017-220134 |
| [17] |
ADAMS SJ, KIRK A, AUER RN. Adult-onset leukoencephalopathy with axonal spheroids and pigmented glia (ALSP):integrating the literature on hereditary diffuse leukoencephalopathy with spheroids (HDLS) and pigmentary orthochromatic leukodystrophy (POLD)[J]. J Clin Neurosci, 2017, 48: 42-49. DOI:10.1016/j.jocn.2017.10.060 |
| [18] |
STABILE C, TAGLIA I, BATTISTI C, et al. Hereditary diffuse leukoencephalopathy with axonal spheroids (HDLS):update on molecular genetics[J]. Neurol Sci, 2016, 37(9): 1-5. DOI:10.1007/s10072-016-2634-6 |
| [19] |
SUNDAL C, VAN GERPEN JA, NICHOLSON AM, et al. MRI characteristics and scoring in HDLS due to CSF1R gene mutations[J]. Neurology, 2012, 79(6): 566-574. DOI:10.1212/WNL.0b013e318263575a |
| [20] |
程欣欣, 徐俊. 遗传性弥漫性白质脑病合并轴索球样变研究进展[J]. 中华医学遗传学杂志, 2014, 31(3): 330-333. DOI:10.3760/cma.j.issn.1003-9406.2014.03.016 |
| [21] |
DI DONATO I, BANCHI S, FEDERICO A, et al. Adult-onset genetic leukoencephalopathies. focus on the more recently defined forms[J]. Curr Mol Med, 2014, 14(8): 944-958. DOI:10.2174/1566524014666141010130545 |
 2019, Vol. 48
2019, Vol. 48