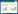文章信息
- 许勇民, 孙大壮, 宋春青, 王蕊, 董雪松
- XU Yongmin, SUN Dazhuang, SONG Chunqing, WANG Rui, DONG Xuesong
- MnTMPyP通过抑制氧化应激和内质网应激减轻百草枯致肺上皮细胞损伤
- MnTMPyP Reduces Paraquat-induced Lung Epithelial-like Cell Injury by Inhibiting Oxidative Stress and Endoplasmic Reticulum Stress
- 中国医科大学学报, 2019, 48(1): 1-6
- Journal of China Medical University, 2019, 48(1): 1-6
-
文章历史
- 收稿日期:2018-03-27
- 网络出版时间:2019-01-02 09:55
百草枯(paraquat,PQ)化学名称为1,1’-二甲基-4,4’-联吡啶阳离子盐,是一种非选择性高效吡啶类接触性除草剂。目前,它是发展中国家使用最频繁的除草剂之一。自从20世纪60年代初首次推出以来,使用PQ引起的问题(如自杀意图、意外中毒或职业暴露等)经常被报道[1]。PQ经皮肤、呼吸道和消化道均可吸收,进入体内的PQ可迅速分布至各个器官,从而引起机体多器官功能损害,其中肺组织是PQ中毒的主要靶器官。肺组织中的浓度是血浆中浓度的6~10倍,并且在血浆中PQ浓度降低时,仍可在肺内维持高浓度状态,进一步导致肺炎症反应及不可逆性肺纤维化[2]。以往研究[3]显示,PQ对肺的毒性主要通过氧化还原反应生成活性氧(reactive oxygen species,ROS),导致细胞氧化还原状态失衡而引起氧化应激,进一步诱导内质网(endoplasmic reticulum,ER)应激及线粒体凋亡途径,最终导致细胞死亡。PQ中毒目前尚无有效治疗方法,近年来,很多研究[4-6]针对减少ROS的生成、清除已生成的ROS和减少炎症反应等方面,但上述治疗仍无法逆转PQ的毒性作用。因此,临床上迫切需要寻找有效的治疗方法。
PQ诱导的肺损伤中氧化应激和超氧化物歧化酶(superoxide dismutase,SOD)的改变已被广泛认知[5, 7]。研究[5, 8-9]表明,SOD模拟物有效抑制了PQ诱导的氧化应激。SOD模拟物通过穿透细胞并有效清除线粒体中电子转移反应所生成的超氧化物离子,可以使受损的抗氧化防御系统得到修复。锰-SOD(MnSOD)是位于线粒体基质中的SOD模拟物,MnSOD杂合小鼠对PQ极其敏感,在果蝇中敲掉MnSOD的RNA后,增加了PQ对果蝇的毒性[10]。研究SOD模拟物的作用,可以进一步了解线粒体功能障碍和氧化应激之间的关系。
锰(Ⅲ)-四(4-N-甲基吡啶基)卟啉(MnTMPyP)是一种超氧化物歧化酶的模拟物,可以穿透细胞并有效清除ROS。MnTMPyP可抑制脂多糖诱导的自由基的生成和多巴胺能神经变性[11]。MnTMPyP在肝、肾、脑缺血/再灌注过程中对产成的ROS的清除作用已在以往研究[12-14]中被报道,然而其在PQ诱导的肺损伤模型中的作用报道较少。本研究探讨了MnTMPyP是否减轻PQ诱导的肺上皮细胞损伤以及相关机制。
1 材料与方法 1.1 材料人肺泡Ⅱ型上皮样细胞A549细胞株由中国医科大学实验中心提供。胎牛血清(美国Gemini公司),RPMI 1640培养基(美国Hyclone公司),MnTMPyP(美国默克集团),PQ、胰蛋白酶、谷胱甘肽还原酶(glutathione reductase,GR)检测试剂盒、ECL发光液、细胞裂解液(碧云天生物技术研究所),MTT、DMSO、BCA蛋白定量试剂盒、ROS检测试剂盒、HRP标记的山羊抗兔Ig G抗体、HRP标记的山羊抗鼠IgG抗体(北京鼎国昌盛生物技术公司),葡萄糖调节蛋白78(glucose regulatory protein 78,Grp78)、C/EBP同源蛋白(C/EBP homologus protein,CHOP)、β-actin(美国Proteintech Group公司)。
1.2 方法 1.2.1细胞培养及分组:在A549细胞中加入含10%胎牛血清的RPMI 1640培养基培养细胞,培养条件为含5%CO2的37 ℃培养箱。将SOD的模拟物MnTMPyP设置为干预因素。实验分为4组:对照组,加入RPMI 1640培养液;MnTMPyP组,加入MnTMPyP 10 μmol/L[14];PQ组,加入PQ 750 μmol/L;PQ+ MnTMPyP组,MnTMPyP 10 μmol/L预处理90 min,吸弃原液后加入PQ 750 μmol/L。各组细胞处理24 h后检测以下指标。
1.2.2细胞活性检测:在96孔板内加入密度为1×105/mL的A549细胞,每孔100 μL,细胞贴壁后,按照实验分组加入处理因素继续培养24 h。每孔加入5 mg/mL的MTT 20 μL混匀,在37 ℃培养箱中继续孵育4 h,弃上清,加入DMSO 150 μL,震荡10 min充分溶解沉淀。酶标仪492 nm测定吸光度值。
1.2.3DCFH-DA法检测细胞内ROS水平:各组细胞按处理因素处理后,用无血清的培养基冲洗细胞1次,加入用无血清培养基以1:1 000稀释的DCFH-DA(终浓度为10 μmol/L)1 mL,在37 ℃培养箱中孵育30 min,消化、离心后,无血清培养基洗涤细胞3次,去除未进入细胞内的DCFH-DA,流式细胞仪以激发波长488 nm、发射波长525 nm检测细胞荧光强度。
1.2.4DCFH-DA荧光检测:各组细胞按实验分组处理24 h后,吸弃原液,用无血清培养基冲洗细胞1次,加入1:1 000用无血清培养基稀释的DCFH-DA(终浓度为10 μmol/L)500 μL,在5%CO2的37 ℃培养箱中孵育20 min,吸出染液后用无血清培养基冲洗3次,倒置荧光显微镜下观察细胞内ROS荧光强度。
1.2.5检测细胞内Ca2+水平:细胞孵育完成后,使用不含EDTA的胰蛋白酶消化后收集细胞,加入Fluo-3/AM Ca2+荧光探针,37 ℃孵育30 min,PBS洗涤2次,流式细胞仪检测Ca2+荧光强度。
1.2.6细胞内GR活性检测:各组细胞做相应处理后培养24 h,吸取培养液,PBS冲洗2次,0.25%胰蛋白酶消化,用等量的PBS收集细胞。超声细胞破碎仪破碎裂解细胞,BCA法蛋白定量后,按照GR活性检测试剂盒的操作说明进行测定。
1.2.7Western blotting检测Grp78、CHOP蛋白的表达:收集各组细胞,以PBS冲洗2次,加入适量预冷的细胞裂解液,震荡混匀,置冰上进行超声裂解,每次5 s,共2次,促进细胞完全破碎,超声后在4 ℃、12 000 r/min离心30 min,收集上清,通过BCA试剂盒测定各组蛋白浓度。蛋白样品经SDS-PAGE电泳分离,湿电转移至PVDF膜上,膜在室温下用5%脱脂牛奶封闭2 h,加入TBST稀释的Grp78、CHOP和β-actin抗体,4 ℃孵育过夜,TBST洗膜10 min,3次,加入二抗,室温孵育2 h。用ECL显色,最后进行显影、定影。采用Image J图像分析软件进行灰度分析。
1.3 统计学分析应用SPSS 20.0统计软件进行分析,数据均采用x±s表示,组间比较采用单因素方差分析,方差齐时组间两两比较采用Dunnett t检验,方差不齐时采用Dunnett T3检验。P < 0.05为差异有统计学意义。
2 结果 2.1 MnTMPyP增加PQ抑制的A549细胞活性A549细胞以不同处理因素处理24 h后,与对照组相比,MnTMPyP组细胞活性下降不明显,差异无统计学意义(P > 0.05),表明选用的MnTMPyP干预浓度无明显细胞毒性。PQ组与对照组比较,细胞活性显著下降(P < 0.01),表明该浓度可以有效制作PQ致肺泡上皮细胞损伤的模型。与PQ组相比,PQ+MnTMPyP组细胞活性显著增加(P < 0.01),表明MnTMPyP对PQ引起的细胞活性下降具有保护作用。见图 1。
|
| ** P < 0.01 vs control group; ## P < 0.01 vs PQ group. 图 1 各组细胞处理24 h后MTT法检测的细胞活性 Fig.1 Cell viability analyzed with MTT assay after 24-h treatment of cells in each group |
2.2 MnTMPyP减少PQ诱导的A549细胞内ROS生成
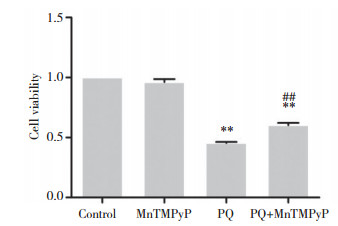
按不同处理因素处理A549细胞24 h后,DCFH-DA法检测细胞内ROS水平。与对照组相比,MnTMPyP组ROS稍增加,但差异无统计学意义(P > 0.05),PQ组ROS显著增加(P < 0.01);与PQ组相比,PQ+MnTMPyP组A549细胞内ROS水平显著降低(P < 0.01),表明MnTMPyP预处理有效减少A549细胞内ROS的生成。见图 2。
|
| A, ROS was detected by flow cytometry; B, fluorescence intensity of ROS was measured by fluorescence microscopy (×400). ** P < 0.01 vs control group; ## P < 0.01 vs PQ group. 图 2 各组细胞处理24 h后DCFH-DA法检测细胞内ROS水平 Fig.2 Intracellular ROS levels detected by the DCFH-DA method after 24-h treatment of cells in each group |
2.3 MnTMPyP降低PQ诱导的A549细胞内Ca2+水平
对照组和MnTMPyP组细胞内Ca2+无明显升高(P > 0.05),与对照组相比,PQ组Ca2+水平显著升高(P < 0.01);与PQ组相比,PQ+MnTMPyP组Ca2+水平明显降低(P < 0.01),表明MnTMPyP预处理显著降低PQ处理的细胞内Ca2+水平。见图 3。

|
| ** P < 0.01 vs control group; ## P < 0.01 vs PQ group. 图 3 各组细胞处理24 h后细胞内Ca2+水平 Fig.3 Cytoplasmic Ca2+ levels after 24-h treatment of cells in each group |
2.4 MnTMPyP增强PQ抑制的A549细胞内GR活性
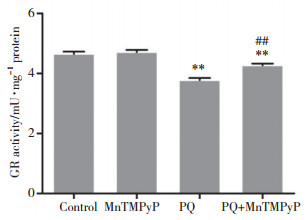
GR催化NADPH还原氧化性谷胱甘肽(oxidized glutathione,GSSG)生成谷胱甘肽(reduced glutathione,GSH),有助于维持体内GSH/GSSG比值。GR在氧化还原反应中对ROS清除起关键作用。与对照组相比,MnTMPyP组GR活性无明显变化(P > 0.05),PQ组的GR活性显著降低(P < 0.01);与PQ组相比,PQ+MnTMPyP组的GR活性明显增加(P < 0.01),表明MnTMPyP有效增加GR活性并有助于清除氧自由基的作用。见图 4。
|
| ** P < 0.01 vs control group; ## P < 0.01 vs PQ group. 图 4 各组细胞处理24 h后GR活性 Fig.4 Glutathione reductase activity after 24-h treatment of cells in each group |
2.5 MnTMPyP减少PQ诱导的A549细胞ER应激蛋白Grp78及CHOP蛋白表达
为了证明MnTMPyP的保护作用也可以减轻ER应激诱导的细胞凋亡,进一步检测ER应激蛋白Grp78及CHOP的表达。以不同处理因素处理A549细胞24 h后,与对照组相比,MnTMPyP组Grp78及CHOP的表达量无统计学差异(P > 0.05),但PQ组Grp78和CHOP蛋白的表达量明显增加(P < 0.01);与PQ组相比,PQ+MnTMPyP组Grp78和CHOP蛋白表达量显著降低(P < 0.01),表明MnTMPyP可以减少ER应激途径的凋亡来保护PQ诱导的A549细胞损伤。见图 5。
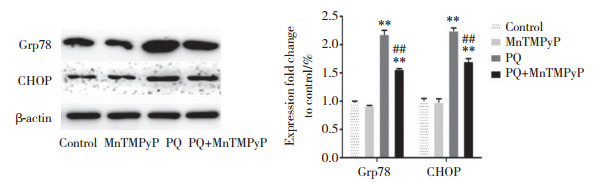
|
| ** P < 0.01 vs control group; ## P < 0.01 vs PQ group. 图 5 各组细胞处理24 h后Western blotting检测ER应激途径诱导凋亡过程中标志性蛋白的表达 Fig.5 Expression of marker proteins of the endoplasmic reticulum stress pathway during apoptosis detected by Western blotting after 24-h treatment of cells in each group |
3 讨论
PQ对人体的毒性是临床毒理学中的重要关注点。研究证明,PQ细胞毒性的机制为干扰细胞内呼吸链电子转移途径及ROS的生成[3]。本研究观察了MnTMPyP在PQ诱导肺损伤中是否通过抗氧化作用起到保护作用。结果表明,MnTMPyP在PQ诱导肺上皮细胞损伤中有显著地保护作用,其机制涉及到减少ROS产生、减少氧化应激相关的细胞内GR活性降低、Ca2+超载及ER应激通路蛋白的激活。
本研究为了证明MnTMPyP的抗氧化作用,检测了细胞内ROS及GR活性。GSH是一种非酶促抗氧化剂,也是细胞质中含量最丰富的巯基物质。它是细胞内生化反应中的天然ROS清除剂和主要还原剂。PQ毒性的机制包括NADPH氧化、GR活性降低[15]。实验表明,PQ确实增加了ROS的产生以及减弱了GR活性,然而MnTMPyP成功的减少了ROS的生成,增加了GR活性,验证了其抗氧化作用。
许多研究表明ER在化学毒物诱导的细胞凋亡中起重要作用,ER应激介导的凋亡也参与许多疾病的发病机制[16]。ER是具有维持细胞内钙稳态、蛋白质合成、翻译后修饰和蛋白质折叠功能的重要细胞器。ER是Ca2+的重要储存场所,并在细胞质内Ca2+信号传导途径中起重要作用。大部分ER内分子伴侣都是Ca2+结合蛋白[17]。ROS的积累以及由其引发的Ca2+外流导致未折叠蛋白的积累,这进一步增强ER应激,加强ER应激通路诱导的凋亡[18]。
ER内蛋白质合成或加工失调导致未折叠蛋白的积累,从而导致ER应激中未折叠蛋白应答(unfolded protein response,UPR)的激活。UPR可以通过减少蛋白质合成、促进蛋白质降解和生成分子伴侣蛋白来协助蛋白质的正常折叠,从而缓解ER应激。典型的UPR由3条ER跨膜转导蛋白介导,PERK、IRE1a和ATF6。UPR由结合免疫球蛋白(BiP)感应,也称为Grp78。在正常情况下,PERK、ATF6、IRE1与分子伴侣Bip/Grp78结合,但是未折叠蛋白的积累使Grp78与UPR的3个蛋白分离并促进它们活化。Grp78作为ER应激的感应蛋白之一,当ER应激开始时通过调节ER腔内Ca2+水平作为对ER应激的反应,因此被认为是ER应激发生的标志性蛋白[16]。
CHOP既可以作为ER应激标记,也可以作为促凋亡转录因子。CHOP在生理条件下表达水平非常低,但在严重或持续的ER应激下其表达水平显著升高。CHOP是ER应激诱导细胞凋亡的中心调控因子,其活性受UPR全部3个蛋白的调控。CHOP作为生长抑制和DNA损伤诱导基因,是ER应激诱导凋亡的关键转录因子。当细胞不能维持稳态时,UPR的所有3个ER跨膜转导蛋白共同作用以促进CHOP表达,并在ER应激持续状态下进一步诱导细胞凋亡[19]。
本研究结果表明,PQ可以诱导细胞中ROS和细胞质中Ca2+水平增高,与ER应激相关的Grp78及CHOP蛋白的表达增高。提示PQ引起的ROS产生以及由其诱导的Ca2+外流可能会导致未折叠或错误折叠蛋白在ER腔内大量积累,使Ca2+平衡紊乱,激活ER应激UPR。长期持续的ER应激下,ER的功能稳态遭到破坏,进而激活凋亡信号传导通路并诱导凋亡。然而,MnTMPyP成功减少了PQ诱导的ROS的生成,增强了GR活性,通过降低Grp78及CHOP的表达成功抑制了ROS诱导的ER应激反应。
综上所述,MnTMPyP对PQ诱导的A549细胞损伤起到保护作用,其机制是通过降低ROS的产生以及抑制氧化应激反应和ER应激。本研究表明,有效的抗氧化药物可能是治疗PQ中毒的关键,这将有助于PQ中毒的下一步基础研究,并为临床治疗提供依据。
| [1] |
ZHANG BL, YAO L, OU Y. Literature analysis of paraquat poisoning in China (1991-2008)[J]. Chin J Crit Care Med, 2010, 30(2): 139-141. DOI:10.3969/j.issn.1002-1949.2010.02.013 |
| [2] |
DINIS-OLIVEIRA RJ, DUARTE JA, S NCHEZ-NAVARRO A, et al. Paraquat poisonings:mechanisms of lung toxicity, clinical features and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13-71. DOI:10.1080/10408440701669959 |
| [3] |
BLANCO-AYALA T, ANDERICA-ROMERO AC, PEDRAZA-CHAV-ERRI J. New insights into antioxidant strategies against paraquat toxicity[J]. Free Radic Res, 2014, 48(6): 623-640. DOI:10.3109/10715762.2014.899694 |
| [4] |
SHOKRZADEH M, SHAKI F, MOHAMMADI E, et al. Edaravone decreases paraquat toxicity in a549 cells and lung isolated mitochondria[J]. Iran J Pharm Res, 2014, 13(2): 675-681. |
| [5] |
POURGHOLAMHOSSEIN F, RASOOLI R, POURNAMDARI M, et al. Pirfenidone protects against paraquat-induced lung injury and fibrosis in mice by modulation of inflammation, oxidative stress, and gene expression[J]. Food Chem Toxicol, 2018, 112: 39-46. DOI:10.1016/j.fct.2017.12.034 |
| [6] |
JAVAD-MOUSAVI SA, HEMMATI AA, MEHRZADI S, et al. Protective effect of Berberis vulgaris fruit extract against Paraquat-induced pulmonary fibrosis in rats[J]. Biomed Pharmacother, 2016, 81: 329-336. DOI:10.1016/j.biopha.2016.04.027 |
| [7] |
SHEN HN, WU Y, WANG H, et al. Chloroquine attenuates paraquat-induced lung injury in mice by altering inflammation, oxidative stress and fibrosis[J]. Int Immunopharmacol, 2017, 46: 16-22. DOI:10.1016/j.intimp.2017.02.020 |
| [8] |
COCHEME HM, MURPHY MP. Complex Ⅰ is the major site of mitochondrial superoxide production by paraquat[J]. Biol Chem, 2008, 283(4): 1786-1798. DOI:10.1074/jbc.M708597200 |
| [9] |
PATKI G, LAU YS. Melatonin protects against neurobehavioral and mitochondrial deficits in a chronic mouse model of Parkinson's disease[J]. Pharmacol Biochem Behav, 2011, 99(4): 704-711. DOI:10.1016/j.pbb.2011.06.026 |
| [10] |
KIRBY K, HU J, HILLIKER AJ, et al. RNA interference-mediated silencing of Sod2 in Drosophila leads to early adult-onset mortality and elevated endogenous oxidative stress[J]. Proc Natl Acad Sci U S A, 2002, 99(25): 16162-16167. DOI:10.1073/pnas.252342899 |
| [11] |
DIXIT A, SRIVASTAVA G, VERMA D. Minocycline, levodopa and MnTMPyP induced changes in the mitochondrial proteome profile of MPTP and maneb and paraquat mice models of Parkinson's disease[J]. Biochim Biophys Acta, 2013, 1832(8): 1227-1240. DOI:10.1016/j.bbadis.2013.03.019 |
| [12] |
HAN SJ, JANG HS, SEU SY, et al. Hepatic ischemia/reperfusion injury disrupts the homeostasis of kidney primary cilia via oxidative stress[J]. Biochim Biophys Acta, 2017, 1863(7): 1817-1828. DOI:10.1016/j.bbadis.2017.05.004 |
| [13] |
KIM JI, KIM J, JANG HS, et al. Reduction of oxidative stress during recovery accelerates normalization of primary cilia length that is altered after ischemic injury in murine kidneys[J]. Am J Physiol Renal Physiol, 2013, 304(10): F1283-F1294. DOI:10.1152/ajprenal.00427.2012 |
| [14] |
CHOI IY, LEE SJ, JU C, et al. Protection by a manganese porphyrin of endogenous peroxynitrite-induced death of glial cells via inhibition of mitochondrial transmembrane potential decrease[J]. Glia, 2000, 31(2): 155-164. DOI:10.1002/(ISSN)1098-1136 |
| [15] |
SUNTRES ZE. Role of antioxidants in paraquat toxicity[J]. Toxicology, 2002, 180(1): 65-77. DOI:10.1016/S0300-483X(02)00382-7 |
| [16] |
LI X, WANG Y, WANG H, et al. Endoplasmic reticulum stress is the crossroads of autophagy, inflammation, and apoptosis signaling pathways and participates in liver fibrosis[J]. Inflamm Res, 2015, 64(1): 1-7. DOI:10.1007/s00011-014-0772-y |
| [17] |
PRELL T, LAUTENSCHLAGER J, GROSSKREUTZ J. Calcium-dependent protein folding in amyotrophic lateral sclerosis[J]. Cell Calcium, 2013, 54(2): 132-143. DOI:10.1016/j.ceca.2013.05.007 |
| [18] |
CLARKE HJ, CHAMBERS JE, LINIKER E, et al. Endoplasmic reticulum stress in malignancy[J]. Cancer Cell, 2014, 25(5): 563-573. DOI:10.1016/j.ccr.2014.03.015 |
| [19] |
ZHANG J, LI Y, JIANG S, et al. Enhanced endoplasmic reticulum SERCA activity by overexpression of hepatic stimulator substance gene prevents hepatic cells from ER stress-induced apoptosis[J]. Am J Physiol Cell Physiol, 2014, 306(3): C279-C290. DOI:10.1152/ajpcell.00117.2013 |
 2019, Vol. 48
2019, Vol. 48