文章信息
- 周冬梅, 孔灵菲
- ZHOU Dongmei, KONG Lingfei
- N-乙酰半胱氨酸对哮喘小鼠气道上皮细胞自噬水平的影响
- Effect of N-acetylcysteine on Autophagy in Airway Epithelial Cells in Asthmatic Mice
- 中国医科大学学报, 2018, 47(7): 626-630
- Journal of China Medical University, 2018, 47(7): 626-630
-
文章历史
- 收稿日期:2017-12-13
- 网络出版时间:2018-06-28 10:13
支气管哮喘是一种涉及基因和环境相互作用的复杂疾病,病因仍不完全清楚。气道上皮细胞在肺内环境和外部环境之间提供了重要的保护层,支气管上皮中表达的多个基因的多态性均与哮喘易感性相关[1],而环境因素可能影响表观遗传机制,改变上皮细胞功能和对环境污染的反应。详细了解气道上皮细胞的调节作用,有助于肺部疾病的进一步诊治。大量的研究[2]表明,哮喘患者的气道上皮细胞存在功能障碍,它在哮喘的发生发展过程中起重要作用。气道上皮屏障功能损伤的严重程度与支气管哮喘急性发作的严重程度相关。近期研究[3]发现,支气管哮喘患者的气道上皮细胞存在自噬功能障碍。哮喘患者的肺组织电镜检查亦显示,哮喘患者的气道上皮细胞内可见许多双层膜结构的自噬体[4]。本研究旨在检测N-乙酰半胱氨酸(N-acetylcysteine,NAC)能否调控支气管哮喘小鼠气道上皮细胞的自噬水平。
1 材料与方法 1.1 模型的制备与处理将18只SPF级BALB/C小鼠分为磷酸盐(phosphate buffer saline,PBS)对照组(PBS组)、卵清白蛋白(ovalbumin,OVA)支气管哮喘组(OVA组)及NAC治疗组(NAC组),每组6只,由辽宁长生生物有限公司提供。支气管哮喘小鼠于第1天、第8天、第15天腹腔注射OVA(美国Sigma公司)20 μg与氢氧化铝凝胶(美国Pierce公司)2 mg的混合液致敏,第22天开始雾化吸入2%OVA30 min,5 d/周,持续4周。PBS组用磷酸盐缓冲液替代,NAC组于每次雾化前1 h腹腔注射NAC(300 mg/kg,美国Sigma公司)。
1.2 小鼠气道反应性检测末次雾化后24~48 h内行气道反应性检测(法国EMKA无创肺功能仪),检测小鼠在不同浓度的乙酰甲胆碱(分别为0、3.125、6.25、12.5、25、50 mg/mL)雾化后增强呼气间歇(enhanced pause,Penh)的水平,Penh较基线水平的倍数变化反映气道高反应程度。
1.3 小鼠肺泡灌洗液细胞计数小鼠肺功能检测后予戊巴比妥钠(2%,50 mg/kg,美国Sigma公司)麻醉,气道内插入留置针,予生理盐水0.5 mL注入气道内后回收,重复3次,回收量均 > 80%。显微镜下计数细胞总数,4 ℃离心并重悬至合适浓度后甩片,行瑞氏-吉姆萨染色(北京索莱宝科技有限公司,按说明书操作),每张涂片计数200个细胞进行细胞分类。
1.4 肺组织切片病理染色左侧肺组织取出后放入4%多聚甲醛中固定,石蜡包埋后切片。肺组织切片(5 μm)按照HE染色试剂盒、Masson三色染色试剂盒、AB-PAS染色试剂盒(北京索莱宝科技有限公司)说明书进行染色。
1.5 免疫荧光检测切片脱蜡至水,柠檬酸钠抗原修复1 min后,1% BSA封闭45 min,微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3B)(武汉爱博泰克生物科技有限公司,1:200)4 ℃湿盒孵育过夜。洗后避光加入荧光二抗(异硫氰酸荧光素,1:100)37 ℃ 30 min。清洗后加入DAPI染核(20 μg/μL)37 ℃ 30 min。甘油封片,图像采集。
1.6 电镜检查自噬体沿支气管束走行方向剪下约0.3 cm×0.3 cm组织块浸入2.5%戊二醛中固定,送入电镜室行电镜检查。
1.7 LC3B蛋白电泳BCA蛋白定量法测定蛋白浓度,12% SDS-聚丙烯酰胺凝胶电泳分离,PVDF膜转印,LC3B抗体4 ℃孵育过夜(1:1 000),二抗室温1 h,ECL发光,UVP凝胶成像系统(美国Bio-Rad公司)成像。
1.8 统计学分析应用SPSS 22.0软件进行数据统计分析,所有数据采用x±s表示,组间比较采用单因素方差分析,方差齐时采用LSD法,方差不齐时采用Dunnett’s T3法,P < 0.05为差异有统计学意义。
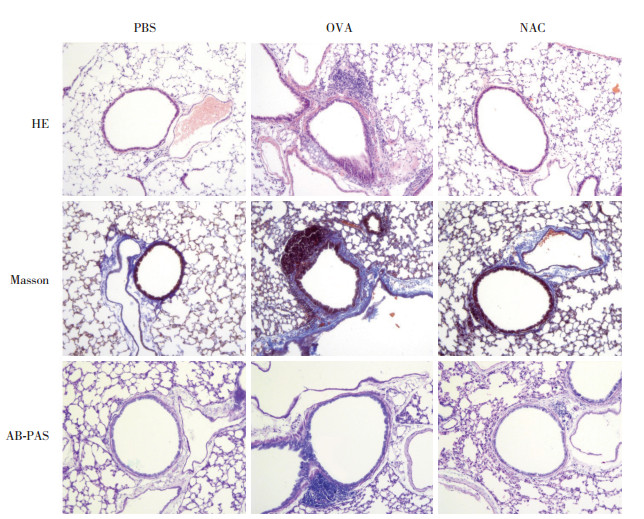
2 结果 2.1 NAC可减轻支气管哮喘小鼠气道炎症为了解NAC能否降低支气管哮喘小鼠气道炎症,对肺组织行HE染色(图 1)和肺泡灌洗液细胞分类计数(表 1)。肺HE染色显示,PBS组小鼠的支气管气道上皮细胞完整,气道周围没有或仅有少量炎症细胞浸润;支气管哮喘小鼠有显著的炎症细胞浸润,上皮细胞层增厚,气道管腔缩窄,平滑肌增厚;而NAC组显示出良好的抑制气道炎症作用,气道周围仅有轻度炎症细胞浸润,气道上皮细胞结构完整,管腔狭窄较OVA组亦明显好转。
|
| 图 1 各组小鼠肺组织切片染色×200 Fig.1 Histochemical staining of lung tissue sections in each group ×200 |
| Group | n | Total cells | Neutrophils | Macrophages | Lymphocytes | Eosinophils |
| PBS | 6 | 1.42±0.49 | 0.02±0.01 | 1.26±0.42 | 0.14±0.07 | 0.01±0.01 |
| OVA | 6 | 33.00±3.001) | 5.13±0.971) | 10.87±1.001) | 3.06±0.361) | 13.95±2.531) |
| NAC | 6 | 15.25±1.451),2) | 1.11±0.111),2) | 10.47±1.14 | 1.57±0.251),2) | 2.10±0.141),2) |
| 1)P < 0.001 compared with PBS group;2)P < 0.001 compared with OVA group. | ||||||
小鼠肺泡灌洗液结果也显示,NAC具有抑制气道炎症的作用。NAC组小鼠肺泡灌洗液较OVA组小鼠细胞总数明显下降,其中嗜酸性粒细胞、淋巴细胞及中性粒细胞下降明显,有统计学差异(P < 0.001)。
2.2 NAC抑制支气管哮喘小鼠的气道高反应性(表 2)| Group | n | Penh/baseline | |||||
| 0 mg/mL | 3.125 mg/mL | 6.25 mg/mL | 12.5 mg/mL | 25 mg/mL | 50 mg/mL | ||
| PBS | 6 | 1.05±0.03 | 1.24±0.17 | 1.69±0.32 | 1.92±0.39 | 2.27±0.57 | 3.0±1.13 |
| OVA | 6 | 1.06±0.05 | 1.48±0.26 | 2.31±0.281) | 4.34±1.261) | 6.60±1.271) | 9.13±1.421) |
| NAC | 6 | 1.03±0.02 | 1.32±0.13 | 1.92±0.37 | 2.37±0.352) | 4.23±0.491),2) | 5.45±0.601),2) |
| 1)P < 0.05 compared with PBS group;2)P < 0.05 compared with OVA group. | |||||||
随着乙酰甲胆碱浓度逐步上升,各组小鼠的Penh均呈上升趋势,OVA组小鼠气道反应性升高最为明显,乙酰甲胆碱浓度为6.25 mg/mL时即显著升高(P < 0.05)。NAC组自12.5 mg/mL浓度后较OVA组明显下降,有统计学差异(P < 0.05),自25 mg/mL浓度后才较PBS组升高,有统计学差异(P < 0.05)。
2.3 NAC抑制气道上皮细胞黏液分泌及胶原蛋白沉积OVA组小鼠气道AB-PAS染色显示,大多数气道上皮细胞均呈强阳性改变,而NAC组PAS阳性细胞数显著下降。气道上皮下胶原蛋白沉积是支气管哮喘气道重塑的重要病理生理学改变。Masson染色可见,OVA组较PBS组气道上皮及血管周围大量的胶原蛋白沉积,上皮层明显增厚,而NAC组上皮下胶原沉积减少。
2.4 NAC抑制肺组织气道上皮细胞的自噬水平LC3B免疫荧光显示,PBS组的气道上皮细胞的细胞质中仅有极少量细胞阳性表达,OVA组的气道上皮细胞的细胞质中LC3B高表达,几乎所有的上皮细胞均发生自噬反应,而NAC组中LC3B的表达减弱,表达LC3B的上皮细胞数目减少(图 2)。透射电镜结果亦显示,OVA组小鼠部分气道上皮细胞中出现很多自噬体。NAC可见少量自噬体(图 3)。蛋白电泳结果(图 4)同样显示,OVA组LC3BⅡ型明显增多,NAC组LC3BⅡ型减少。

|
| 图 2 肺组织LC3B免疫荧光染色×200 Fig.2 Immunohistochemical staining of microtubule-associated proteins 1A/1B light chains 3B in lung tissues ×200 |

|
| A, PBS group; B, OVA group; C, NAC group. 图 3 气道上皮细胞透射电镜检查 Fig.3 Transmission electron microscopy examination of airway epithelial cells |

|
| 1, PBS group; 2, OVA group; 3, NAC group. 图 4 Western blotting分析各组小鼠肺组织LC3B表达 Fig.4 LC3B expression by Western blotting analysis in mice lung tissues in each group |
3 讨论
气道上皮细胞是肺组织的第1道屏障,其屏障功能除物理屏障功能外还发挥着化学屏障及免疫屏障的功能[2, 5]。越来越多的研究[6-9]表明,气道上皮细胞在支气管哮喘发病及气道重塑过程中发挥着不容忽视的作用。气道上皮细胞通过分泌MUC5AC黏蛋白、促纤维化生长因子自噬与上皮间充质转化等参与气道重塑。
本研究结果显示,NAC具有良好的抗气道炎症及气道重塑的作用,这与既往研究NAC对哮喘小鼠的作用结果相一致[10]。然而既往的研究均关注于NAC对气道的抗氧化抗炎作用,本研究着重关注于NAC对气道上皮细胞自噬水平的影响。本研究表明,NAC组小鼠肺泡灌洗液中不仅嗜酸性粒细胞数减少,中性粒细胞数亦明显减少,说明NAC在缓解气道炎症的基础上针对难治性哮喘可能有进一步的治疗作用,亦有文献[11]支持NAC可抑制激素耐受型支气管哮喘的急性发作。近期许多研究[12-13]均表明,自噬是导致支气管哮喘气道上皮细胞发生杯状细胞转化及MUC5AC分泌的关键环节,自噬同样是导致气道上皮细胞间充质转化的关键因素之一[14]。过度的自噬可能是气道上皮细胞功能障碍的原因。本研究结果显示,NAC可减轻气道上皮细胞的黏液分泌,抑制支气管哮喘气道上皮细胞的过度自噬。由此可推测NAC可能通过抑制气道上皮细胞的过度自噬从而保护气道上皮细胞,减少胶原沉积及黏液分泌,进而缓解气道重塑。
本研究通过动物模型的方法验证NAC对哮喘小鼠气道上皮细胞自噬水平的作用具有局限性,需进一步完善细胞实验,明确NAC针对气道上皮细胞自噬水平的作用机制及作用靶点。值得注意的是,NAC对支气管哮喘的是否真的有效目前尚没有确切证据,相关的临床试验表明,NAC在抑制哮喘患者的急性发作的研究中未见明确疗效,但该研究仅有50例患者入选,NAC也仅应用5 d[15]。是否可以长期应用NAC辅助控制气道上皮细胞的自噬水平,从而达到减轻气道重塑效果尚不清楚,本研究通过动物实验表明,NAC对气道上皮细胞自噬功能的影响有可能成为治疗支气管哮喘新的突破口。
综上所述,NAC可减轻支气管哮喘的气道炎症及气道重塑,气道上皮细胞自噬水平的降低可能在其中发挥了关键作用,有望成为治疗哮喘,缓解气道重塑的新方向,但其具体机制仍有待进一步研究。
| [1] |
TSICOPOULOS A, DE NADAI P, GLINEUR C. Environmental and genetic contribution in airway epithelial barrier in asthma pathogenesis[J]. Curr Opin Allergy Clin Immunol, 2013, 13(5): 495-499. DOI:10.1097/ACI.0b013e328364e9fe |
| [2] |
GEORAS SN, REZAEE F. Epithelial barrier function:at the frontline of asthma immunology and allergic airway inflammation[J]. J Allergy Clin Immunol, 2014, 134(3): 509-520. DOI:10.1016/j.jaci.2014.05.049 |
| [3] |
POON A, EIDELMAN D, LAPRISE C, et al. ATG5, autophagy and lung function in asthma[J]. Autophagy, 2012, 8(4): 694-695. DOI:10.4161/auto.19315 |
| [4] |
POON AH, CHOUIALI F, TSE SM, et al. Genetic and histological evidence for autophagy in asthma pathogenesis[J]. J Allergy Clin Immunol, 2012, 129(2): 569-571. DOI:10.1016/j.jaci.2011.09.035 |
| [5] |
LOXHAM M, DAVIES DE, BLUME C. Epithelial function and dysfunction in asthma[J]. Clin Exp Allergy, 2014, 44(11): 1299-1313. DOI:10.1111/cea.12309 |
| [6] |
SHIMIZU S, KOUZAKI H, OGAWA T, et al. Eosinophil-epithelial cell interactions stimulate the production of MUC5AC mucin and profibrotic cytokines involved in airway tissue remodeling[J]. Am J Rhinol Allergy, 2014, 28(2): 103-109. DOI:10.2500/ajra.2014.28.4018 |
| [7] |
HACKETT TL. Epithelial-mesenchymal transition in the pathophysiology of airway remodeling in asthma[J]. Curr Opin Allergy Clin Immunol, 2012, 12(1): 53-59. DOI:10.1097/ACI.0b013e32834ec6eb |
| [8] |
ROYCE SG, LI X, TORTORELLA S, et al. Mechanistic insights into the contribution of epithelial damage to airway remodeling. Novel therapeutic targets for asthma[J]. Am J Respir Cell Mol Biol, 2014, 50(1): 180-192. DOI:10.1165/rcmb.2013-0008OC |
| [9] |
PROUD D, LEIGH R. Epithelial cells and airway diseases[J]. Immunol Rev, 2011, 242(1): 186-204. DOI:10.1111/j.1600-065X.2011.01033.x |
| [10] |
BLESA S, CORTIJO J, MARTINEZ-LOSA M, et al. Effectiveness of oral N-acetylcysteine in a rat experimental model of asthma[J]. Pharmacol Res, 2002, 45(2): 135-140. DOI:10.1006/phrs.2001.0917 |
| [11] |
EFTEKHARI P, HAJIZADEH S, RAOUFY MR, et al. Preventive effect of N-acetylcysteine in a mouse model of steroid resistant acute exacerbation of asthma[J]. EXCLI J, 2013, 12: 184-192. |
| [12] |
DICKINSON JD, ALEVY Y, MALVIN NP, et al. IL13 activates autophagy to regulate secretion in airway epithelial cells[J]. Autophagy, 2016, 12(2): 397-409. DOI:10.1080/15548627.2015.1056967 |
| [13] |
ZHOU JS, ZHAO Y, ZHOU HB, et al. Autophagy plays an essential role in cigarette smoke-induced expression of MUC5AC in airway epithelium[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 310(11): L1042-1052. DOI:10.1152/ajplung.00418.2015 |
| [14] |
LIU T, LIU Y, MILLER M, et al. Autophagy plays a role in FSTL1-induced epithelial mesenchymal transition and airway remodeling in asthma[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 313(1): L27-L40. DOI:10.1152/ajplung.00510.2016 |
| [15] |
ALIYALI M, POORHASAN AMIRI A, SHARIFPOOR A, et al. Effects of N-acetylcysteine on asthma exacerbation[J]. Iran J Allergy Asthma Immunol, 2010, 9(2): 103-109. |
 2018, Vol. 47
2018, Vol. 47