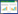文章信息
- 赵芳英, 高秀秋, 刘姊凤
- ZHAO Fangying, GAO Xiuqiu, LIU Zifeng
- Wnt3a对人骨髓间充质干细胞成骨分化的影响及机制研究
- Effect and Mechanism of Wnt3a on Osteogenic Differentiation of Human Bone Marrow Mesenchymal Stem Cells
- 中国医科大学学报, 2018, 47(7): 617-621
- Journal of China Medical University, 2018, 47(7): 617-621
-
文章历史
- 收稿日期:2017-11-16
- 网络出版时间:2018-06-28 10:12
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)是具有多种分化潜能的细胞,在成人的骨骼中,BMMSCs主要向成骨细胞和脂肪细胞分化,两者的比例对调控骨组织重建与代谢有重要作用[1]。Wnt信号通路在牙发育和骨形成过程中作用显著[2-3]。活化的经典Wnt通路通过上调成骨分化相关基因Runx2、Dlx5、Osterix和ALP促进BMMSCs向成骨分化[4]。可见Wnt信号通路与许多骨疾病密切相关,并参与BMMSCs分化方向的调控,但在Wnt信号通路中关键基因调控BMMSCs的分化方向及变化趋势尚未见文献报道。因此本研究探究Wnt3a蛋白对BMMSCs不同时间点成骨分化的影响,以及与Wnt/β-catenin信号通路调控的关系,以期为Wnt3a诱导的BMMSCs在骨修复中的应用提供理论依据。
1 材料与方法 1.1 主要试剂和仪器BMMSCs购自北纳创联生物技术有限公司;DMEM/F12购自美国Hyclone公司;胎牛血清FBS购自美国SerePro公司;BMMSCs成骨诱导液购自美国Cyagen公司;细胞RNA提取试剂盒购自德国Qiagen公司;RNA逆转录试剂盒及荧光定量PCR试剂盒购自日本Takara公司;引物由大连宝生物有限公司合成;Wnt3a蛋白购自美国Absci公司。
1.2 实验分组实验分为诱导对照组和Wnt3a蛋白诱导组,诱导对照组:成骨诱导培养基(地塞米松、β-甘油磷酸钠、维生素C、10%FBS、1%双抗),Wnt3a蛋白诱导组:成骨诱导培养基(地塞米松、β甘油磷酸钠、维生素C、10%FBS、1%双抗)和10 ng/mL Wnt3a蛋白。2组分别在诱导后的第1、5、10、15和20天于显微镜下观察细胞形态、染色、RNA提取及蛋白提取。
1.3 BMMSCs成骨诱导培养将冻存的BMMSCs从液氮罐中取出,置于37 ℃水浴锅内,摇动使其融化。将细胞悬液移入加有适量培养液的离心管中离心,弃上清后加入含地塞米松、β-甘油磷酸钠、维生素C、10%FBS、1%双抗和10 ng/mLWnt3a蛋白的成骨培养基,37 ℃,5%CO2培养。每2~3 d换液1次,显微镜下观察细胞状态,待细胞密度达70%~80%时进行传代培养。
1.4 茜素红染色选择生长状态良好的BMMSCs,用0.05%胰蛋白酶消化,接种于6孔板中,加入上述已配好的成骨诱导培养基,于诱导第1、5、10、15和20天显微镜下观察细胞形态及生长变化情况,应用10%中性甲醛固定30 min后,PBS冲洗,加入茜素红染液染色。显微镜下观察成骨染色效果。
1.5 实时PCR检测RUNX2、β-catenin及BSP mRNA提取总RNA,反转录合成cDNA,操作按照产品说明书进行。实时PCR反应条件:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环;55 ℃ 30 s 80个循环,绘制熔解曲线。RUNX2引物序列为F 5’-AGGGGCTGTGG AGTTTGGT-3’,R 5’-TGACTTTTCGGGGAGGAGA G-3’;β-catenin引物序列为F 5’-GCCAG TGGATTCC GTACTG-3’,R 5’-TGAGTGGCTGTCTTTTGACG- 3’;BSP引物序列为F 5’-GCGTGCTTCTTAGACGGACT G-3’,R 5’-CGTCAGAGGGCTGGGATG-3’;GAPDH引物序列为F 5’-TGCACCACCAACTGCTTAG-3,R 5’-GGATGCAGGGATGATGTTC-3。采用2-ΔΔCT法计算目的基因相对表达量。
1.6 Western blotting检测蛋白表达用蛋白裂解液提取细胞蛋白,BCA法做蛋白定量,取已制备样品10 μL进行SDS-PAGE电泳。120 V转膜2 h,5%脱脂牛奶室温封闭1 h,加1:1 000 Runx2/ 1:1 000 β-catenin/1:1 000 BSP/1:5 000 actin一抗,4 ℃过夜。加1:10 000 HRP IgG二抗,室温孵育1 h。ECL显影,用Scion Image 4. 03软件分析。
1.7 统计学分析采用SPSS 17.0统计软件One-Way ANOVA分析实验数据。实验结果以x±s表示,P < 0.05为差异有统计学意义。
2 结果 2.1 细胞形态光学显微镜下观察BMMSCs不同生长阶段形态学,Wnt3a蛋白诱导组第1天可见细胞呈小圆形、散在分布,随着时间的延长细胞分化明显,至第10天细胞呈纺锤形,偶呈扁平状和多角形,有小集落形成,呈不规则短梭,至第20天细胞形态基本一致,排列较整齐,呈长梭形成纤维样,漩涡状生长,见图 1。诱导对照组细胞较Wnt3a蛋白诱导组,在各个时间点分化程度明显减弱。
|
| A, 1 d; B, 5 d; C, 10 d; D, 15 d; E, 20 d. 图 1 BMMSCs形态×100 Fig.1 Morphology of human bone marrow mesenchymal stem cells ×100 |
2.2 茜素红染色
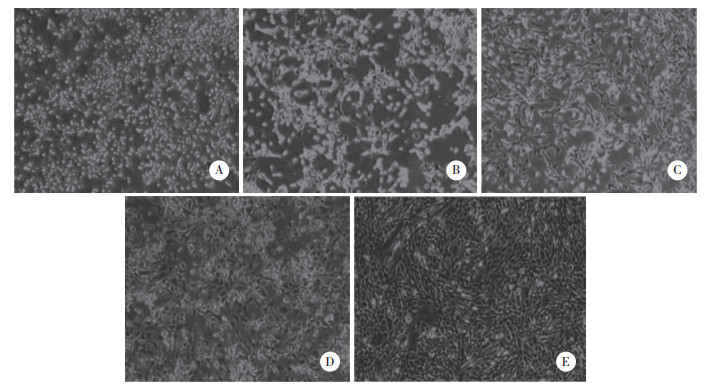
茜素红染色镜下显示,BMMSCs向成骨诱导分化的过程,部分细胞逐渐聚集一起呈“集落状”生长,形成矿化结节,在诱导第5天后茜素红染色可见密集的散在的橘红色矿化结节。与诱导对照组相比,Wnt3a蛋白诱导组各时间点可见较多的橘红色矿化结节。见图 2。
|
| A, 1 d; B, 5 d; C, 10 d; D, 15 d; E, 20 d. 图 2 茜素红染色×100 Fig.2 Alizarin red staining × 100 |
2.3 RUNX2、β-catenin及BSP mRNA表达水平
研究结果表明,诱导对照组和Wnt3a蛋白诱导组BMMSCs成骨过程中,RUNX2、β-catenin及BSP mRNA有不同水平的增加,均在第10天达到峰值。Wnt3a蛋白诱导组RUNX2、β-catenin及BSP mRNA表达水平在各个时间点均明显高于诱导对照组(P < 0.05)。诱导对照组RUNX2、β-catenin及BSP mRNA表达在诱导后第1、5、10天有明显上升趋势(P < 0.05),随后在第15、20天呈下降趋势,但下降幅度无统计学意义(P > 0.05)。见图 3。

|
| * P < 0.05 compared with control group at the same time point. A, RUNX2 mRNA; B, β-catenin mRNA, C, BSP mRNA. 图 3 RUNX2、β-catenin及BSP mRNA相对表达量 Fig.3 Relative mRNA expression of RUNX2, β-catenin, and BSP |
2.4 RUNX2、β-catenin及BSP蛋白表达情况
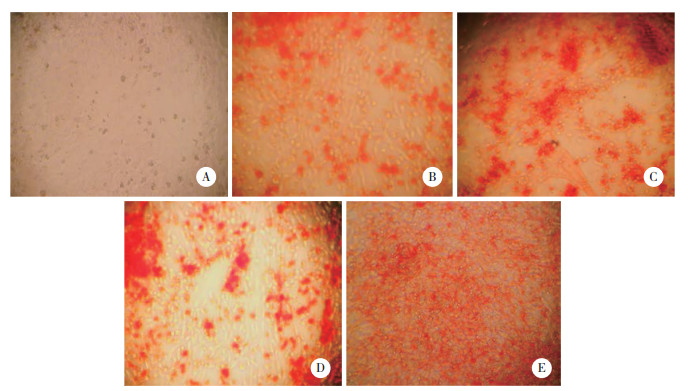
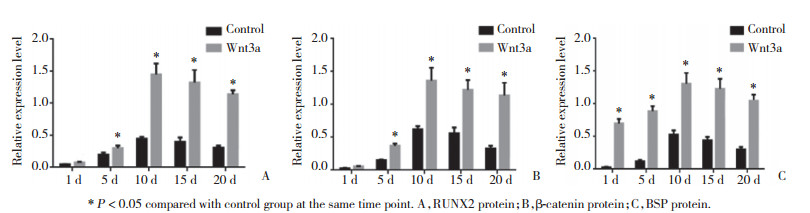
诱导对照组和Wnt3a蛋白诱导组BMMSCs成骨过程中,RUNX2、β-catenin及BSP蛋白表达有不同水平的增加,均在第10天达到峰值。Wnt3a蛋白诱导组RUNX2、β-catenin蛋白表达水平在诱导后的第5、10、15和20天明显高于诱导对照组(P < 0.05),BSP蛋白表达在各个时间点均明显高于诱导对照组(P < 0.05)。诱导对照组RUNX2、β-catenin及BSP表达在诱导后第1、5、10天有明显上升趋势(P < 0.05),随后小幅下降(P > 0.05)。见图 4、5。
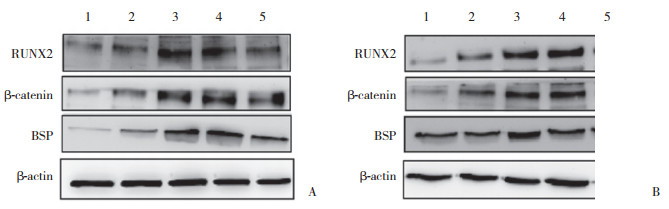
|
| A, control group, B, Wnt3a intervention group. 1, 1 d; 2, 5 d; 3, 10 d; 4, 15 d; 5, 20 d. 图 4 RUNX2、β-catenin及BSP的蛋白表达 Fig.4 Expression of RUNX2, β-catenin and BSP |
|
| * P < 0.05 compared with control group at the same time point. A, RUNX2 protein; B, β-catenin protein; C, BSP protein. 图 5 RUNX2、β-catenin及BSP蛋白相对表达量 Fig.5 Relative expression of RUNX2, β-catenin and BSP |
3 讨论
BMMSCs具有自我克隆增殖,并能向成脂细胞、成骨细胞、神经细胞等分化的能力,体外通过不同的诱导方法使BMMSCs分化成软骨、成骨细胞等用于多种疾病的治疗,被称为“种子细胞”[5]。Wnt信号通路是近年来研究细胞生物学行为的新热点,激活经典Wnt/β-catenin信号能够促进干细胞骨向分化、自我更新及抑制凋亡等机制增加骨组织的再生[6]。但是,BOLAND等[7]报道Wnt/β-catenin信号通路中一些蛋白信号的过度增强反而会诱导BMMSCs衰老。Wnt3a是Wnt蛋白家族一员,主要通过旁分泌、自分泌方式释放于胞外,并结合细胞表面受体,激活下游信号产生级联效应[8-9]。本研究采用小剂量Wnt3a蛋白对BMMSCs进行干预,观察Wnt3a在不同分化时间点对BMMSCs成骨分化的调控作用,探索经典Wnt/β-catenin信号通道对于BMMSCs成骨分化的调节机制。
本研究中,茜素红染色结果显示,BMMSCs在体外培养的环境下,进入干细胞定向期,启动向成骨细胞的分化。通过成骨诱导液(地塞米松、维生素C、β-磷酸甘油钠)联合Wnt3a蛋白,诱导干细胞进入细胞外基质沉积期。本研究诱导5 d后,Wnt3a蛋白诱导组与诱导正常组比较,前者向成骨细胞诱导分化的干细胞中Wnt信号通路关键信号转导因子β-catenin和成骨相关蛋白RUNX2、BSP表达明显升高,表达高峰出现在第10天,之后有轻度下降趋势。提示Wnt3a蛋白通过活化Wnt信号通路进而调节转导因子和成骨相关蛋白水平。周大凯等[10]研究发现,高表达Runx2可上调成骨相关基因、BMP-2、OCN、ALP基因和蛋白的表达水平,进而促进脐血间充质干细胞成骨分化。涂艳等[11]发现淫羊藿苷可以提高β-catenin和Runx2的蛋白表达水平,激活Wnt/β-catenin信号通路,参与并调控BMMSC的成骨分化。本研究结果显示,Wnt3a可能通过Wnt/β-catenin信号途径促进BMMSCs成骨分化,且在成骨诱导的早期刺激效果最佳,在成骨诱导的后期,Wnt3a蛋白对成骨诱导效果减弱。这说明经典Wnt信号通路对骨分化的调节作用依细胞分化程度的不同而不同。一旦BMMSCs启动向成骨分化的方向,Wnt信号通路促进干细胞向成骨分化,即细胞形态由梭形转变成多角形;RUNX2、BSP等成骨特定基因高表达;ALP特异性蛋白的表达;矿化结节的出现。而CHO等[13]和DE BOER等[14]报道高水平Wnt3a表达能减缓正在发生骨生成BMMSCs的基质钙化进程和降低ALP活性,抑制地塞米松诱导BMMSCs的成骨发生。可见Wnt3a对BMMSCs成骨分化的调控作用与Wnt3a剂量有直接关系。
综上所述,BMMSCs的体外成骨受Wnt/β-catenin信号通路调控,并受细胞分化阶段的影响,在BMMSCs进入分化阶段后,Wnt3a所介导的Wnt信号通路促进BMMSCs向成骨分化,但在成骨细胞发育晚期,Wnt3a介导的Wnt信号通路对BMMSCs作用由促进变为抑制成骨细胞,最终发育成熟。
| [1] |
OHISHI M, SCHIPANI E. Bone marrow mesenchymal stem cells[J]. J Cell Biochem, 2010, 109(2): 277-282. DOI:10.1002/jcb.22399 |
| [2] |
CAWTHORN WP, BREE AJ, YAO Y, et al. Wnt6, Wnt10a and Wnt10b inhibit adipogenesis and stimulate osteoblastogenesis through β-catenin-dependent mechanism[J]. Bone, 2012, 50(2): 477-489. DOI:10.1016/j.bone.2011.08.010 |
| [3] |
VELASCO J, ZARRABEITIA MT, PRIETO JR, et al. Wnt pathway genes in osteoporosis and osteoarthritis:differential expression and genetic association study[J]. Osteoporos Int, 2010, 21(1): 109-118. DOI:10.1007/s00198-009-0931-0 |
| [4] |
XU ML, BI CWC, LIU EYL, et al. Wnt3a induces the expression of acetylcholinesterase during osteoblast differentiation via the Runx2 transcription factor[J]. J Biol Chem, 2017, 292(30): 12667-12678. DOI:10.1074/jbc.M117.777581 |
| [5] |
GILCHRIST ES, PLEVRIS JN. Bone marrow-derived stem cells in liver repair:10 years down the line[J]. Liver Transpl, 2011, 16(2): 118-129. DOI:10.1002/lt.21965 |
| [6] |
ZHANG Z, WANG X, ZHANG L, et al. Wnt/β-catenin signaling pathway in trophoblasts and abnormal activation in preeclampsia[J]. Mol Med Rep, 2017, 16(2): 1007-1013. DOI:10.3892/mmr.2017.6718 |
| [7] |
BOLAND M, PERKINS G, HALL DJ, et al. Wnt 3a promotes proliferation and suppresses osteogenic differentiation of adult human mesenchymal stem cells[J]. J Cell Biochem, 2004, 93(6): 1210-1230. DOI:10.1002/jcb.20284 |
| [8] |
LI YS, XI Y, LI XJ, et al. Up-regulation of the biosynthesis and release of substance p through wnt/β-catenin signaling pathway in rat dorsal root ganglion cells[J]. PLoS One, 2015, 10(6): e0129701. DOI:10.1371/journal.pone.0129701 |
| [9] |
DENYSENKO T, ANNOVAZZI L, CASSONI P, et al. WNT/β-catenin signaling pathway and downstream modulators in low-and high-grade glioma[J]. Cancer Genomics Proteomics, 2016, 13(1): 31-45. |
| [10] |
周大凯, 李慧宁, 马珊珊, 等. 基因高表达对脐血间充质干细胞成骨分化相关基因表达的影响[J]. 中国组织工程研究, 2017, 21(9): 1444-1449. DOI:10.3969/j.issn.2095-4344.2017.09.024 |
| [11] |
涂艳, 熊莉娜, 柳湘洁, 等. 淫羊藿苷对成骨细胞成骨分化的影响及Wnt/β-catenin信号系统的关系研究[J]. 中国中医急症, 2017, 26(3): 448-450. DOI:10.3969/j.issn.1004-745X.2017.03.023 |
| [12] |
WANG Y, UEMURA T, DONG J, et al. Application of perfusion culture system improves in vitro and in vivo osteogenesis of bone marrow-derived osteoblastic cells in porous ceramic materials[J]. Tissue Eng, 2003, 9(6): 1205-1214. DOI:10.1089/10763270360728116 |
| [13] |
CHO HH, KIM YJ, KIM SJ, et al. Endogenous Wnt signaling promotes proliferation and suppresses osteogenic differentiation in human adipose derived stromal cells[J]. Tissue Eng, 2006, 12(1): 111-121. DOI:10.1089/ten.2006.12.111 |
| [14] |
DE BOER J, SIDDAPPA R, GASPAR C, et al. Wnt signaling inhibits osteogenic differentiation of human mesenchymal stem cells[J]. Bone, 2004, 34(5): 818-826. DOI:10.1016/j.bone.2004.01.016 |
 2018, Vol. 47
2018, Vol. 47